β-乳球蛋白IgE抗原决定簇的识别
2010-09-13丛艳君任发政云战友
丛艳君,任发政,云战友
(1.北京工商大学化学与环境工程学院,北京 100048;2.中国农业大学食品科学与营养工程学院,北京 100083;3.内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特 010080)
β-乳球蛋白IgE抗原决定簇的识别
丛艳君1,任发政2,*,云战友3
(1.北京工商大学化学与环境工程学院,北京 100048;2.中国农业大学食品科学与营养工程学院,北京 100083;3.内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特 010080)
以β-乳球蛋白氨基酸序列为模板,错位合成β-乳球蛋白多肽,以收集到的牛乳过敏患者血清为抗体,鉴定β-乳球蛋白IgE抗原决定簇,分析影响致敏性的关键氨基酸,探讨牛乳过敏机理。结果表明:β-乳球蛋白IgE抗原决定簇有4条,氨基酸序列分别为17~31、72~86、92~106、152~166,并且苏氨酸(AA20)、蛋氨酸(AA23)、天冬氨酸(AA27)是影响β-乳球蛋白致敏性的关键氨基酸。说明特异性水解抗原决定簇或定点修饰氨基酸可以实现过敏原脱敏的目的。
牛奶;β-乳球蛋白;IgE;抗原决定簇
Abstract:A series of overlapping decapeptides (offset by five amino acids) were synthesized on the basis of the amino acid sequence of β-lactoglobulin. IgE-binding epitopes were identified using individual sera from cow milk allergic patients. In addition,we also identified critical amino acids (AAs) for IgE binding. The results showed that four IgE-binding epitopes were identified,which located in the sequences of AA 17-31, AA 72-86, AA 92-106 and AA 152-166, respectively. Threonine,methionine and aspartic acid were the critical amino acids for allergenicity of β-lactoglobulin.
Key words:cow milk;β-lactoglobulin;IgE;epitope
β-乳球蛋白占牛乳总蛋白的10%,乳清蛋白的50%。IgE介导的牛乳过敏中60%的病人对β-乳球蛋白过敏[1]。β-乳球蛋白一般是二聚体,其每个单位为18kD,含有162个氨基酸,5个二硫键,其中4个为链内,1个为链间。有关牛乳过敏原表位的研究在2000年左右最为活跃,其内容涉及到对B细胞表位(包括IgE表位和IgG表位)及T细胞表位的研究。Sélo等[2]在研究β-乳球蛋白时,确定了人的主要IgE表位为肽链1~8、25~40、41~60、102~124、149~162 位,同时21~40、42~60、107~117、148~162位也被致敏的大鼠所识别。而Fritsché等[3]研究表明:β-乳球蛋白氨基酸序列41~60、102~124、149~162位,这3个表位被90%~100%过敏患者的血清所识别,是主要过敏表位,肽链1~8、25~40、92~100位,被50%~65%过敏患者血清IgE所识别,为次要过敏表位。目前对β-乳球蛋白的IgG表位研究则较少,只确定了6个识别位点:肽链1~16、51~64、67~88、85~96、129~144、139~156位,其中1~16位和58~96位为次要识别位点,其余为主要识别位点[4]。关于β-乳球蛋白抗原决定簇的关键氨基酸的研究报道很少。
各国牛乳患者过敏血清不同,本研究收集中国牛乳过敏患者血清,鉴定β-乳球蛋白IgE抗原决定簇及影响致敏性的关键氨基酸,以期为牛乳过敏的临床诊治及低过敏牛乳制品的开发提供参考。
1 材料与方法
1.1 材料与试剂
β-乳球蛋白、HRP标记的鼠抗人IgE(ε链特异性)、四甲基联苯胺(TMB)、三氟乙酸(TFA) 美国Sigma公司;链霉亲和素(SA) 北京博奥森生物技术有限公司;96孔聚苯乙烯酶标板 美国Costar公司。
1.2 仪器与设备
Bio-Rad550型酶标仪 美国Bio-Rad公司;PSH500A生化培养箱 中国重庆银河实验仪器有限公司;F-32酸度计 日本崛厂制作公司;Th-80D-2B型冻干机 北京天地精仪科技有限公司;高效液相Vydac C18柱 美国Vydac公司。
1.3 方法
1.3.1 多肽的合成
采用Fmoc固相肽合成法[5],将C-末端氨基酸连接到一种合适的固相载体上,采用常规Fmoc法进行逐步缩合。合成结束后,用强酸将序列从固相载体上切割下来,经HPLC纯化,冷冻干燥后备用。
1.3.2 合成多肽的纯化和鉴定
采用高效液相色谱(RP-HPLC)和质谱进行分析。色谱条件:色谱柱:C18柱(4.6mm×250mm,5μm);流动相:A为体积分数0.1%TFA的溶液,B为乙腈,采用按体积分数梯度洗脱程序:0~5min,15% B;5~10min,20% B;10~30min,40% B。流速:1.0mL/min;检测波长:220nm;柱温:20℃。质谱条件:采用ESI离子源,喷雾压力:15psi;干燥气温度:350℃;流速:5L/min;扫描质量范围:m/z 500~2200u。
1.3.3 牛乳过敏患者血清的收集
按照文献[2]相关参数(典型的食物过敏史、皮肤点刺实验、Immunol CAP实验)筛选牛乳过敏患者血清。6份牛乳过敏患者血清用来识别β-乳球蛋白IgE抗原决定簇,以A~F表示。另外取5份血清等体积混合分析影响β-乳球蛋白致敏性的关键氨基酸。
1.3.4 酶联免疫吸附实验(ELISA)鉴定抗原决定簇及关键氨基酸
合成多肽致敏性的检测在96孔微板上进行,每孔均先用链霉亲和素包被,分别依次加入待进行抗原决定簇鉴定的肽系列,再用抗体检测,具体操作参考文献[6]。
2 结果与分析
2.1 β-乳球蛋白肽的合成
以β-乳球蛋白氨基酸序列为模板,用Fmoc固相合成法错位合成β-乳球蛋白多肽30条(错位氨基酸为5个),见表1。
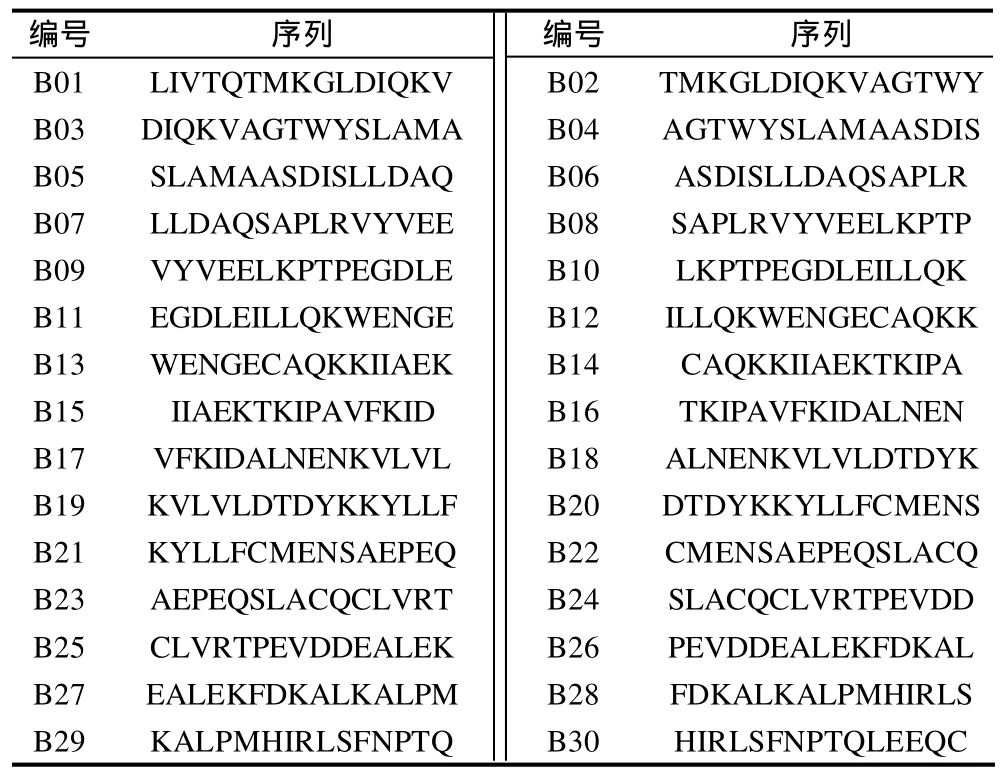
表1 合成多肽氨基酸序列Table 1 Amino acid sequence of synthesized peptides
2.2 合成多肽的纯化及鉴定
合成的多肽通过高效液相纯化,纯度都达到了80%以上,进一步通过质谱鉴定多肽的相对分子质量(加上生物素的相对分子质量),表明多肽相对分子质量误差均小于5%。本实验代表性的附上了两条多肽(偶联生物素)的质谱图(图1、2)。
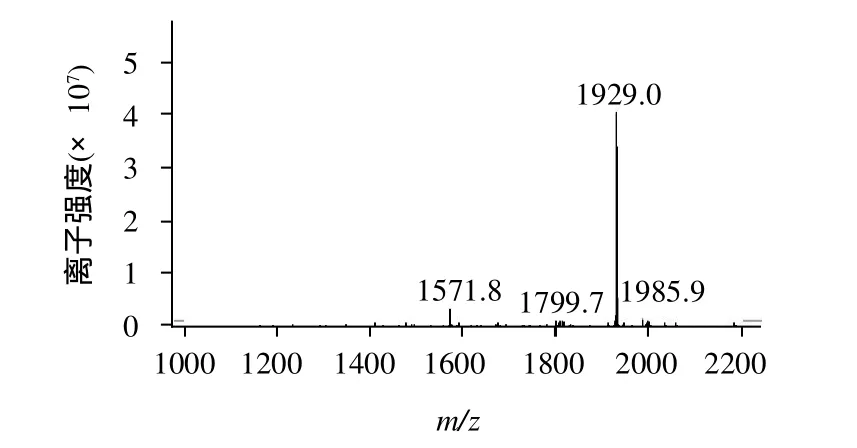
图1 Biotin-LIVTQTMKGLDIQKV多肽的MS图谱Fig.1 MS spectrum of the peptide containing LIVTQTMKGLDIQKV sequence coupled with biotin
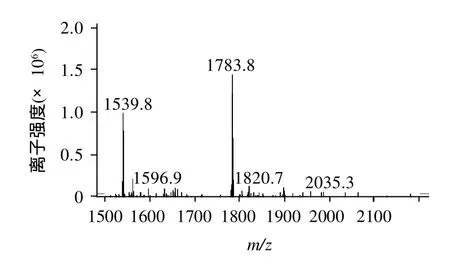
图2 Biotin-TKIPAVFKIDALNEN多肽的MS图谱Fig.2 MS spectrum of the peptide containing TKIPAVFKIDALNEN sequence coupled with biotin
2.3 β-乳球蛋白IgE抗原决定簇的识别
由图3可知,A患者识别到的抗原决定簇为B01、B04、B07、B12、B16、B20、B25、B26;B 患者识别到的抗原决定簇为B01、B03、B09、B12、B14、B20、B26、B30;C患者识别到的抗原决定簇为B01、B02、B05、B10、B14、B16、B19、B25、B28、B29;D患者识别到的抗原决定簇为B01、B04、B07、B12、B16、B23、B28、B30;E患者识别到的抗原决定簇为B01、B06、B12、B15、B22、B28;F患者识别到的抗原决定簇为B01、B02、B04、B07、B12、B16、B20、B26、B28。
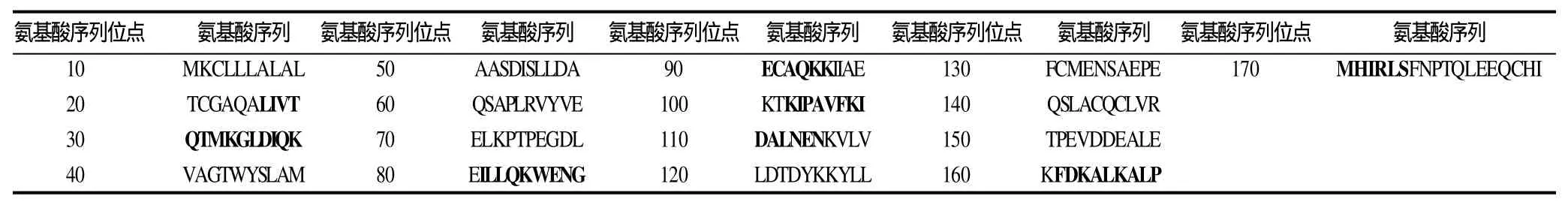
表2 IgE抗原决定簇在β-乳球蛋白序列中的定位Table 2 Location of IgE-binding epitopes on β-lactoglobulin
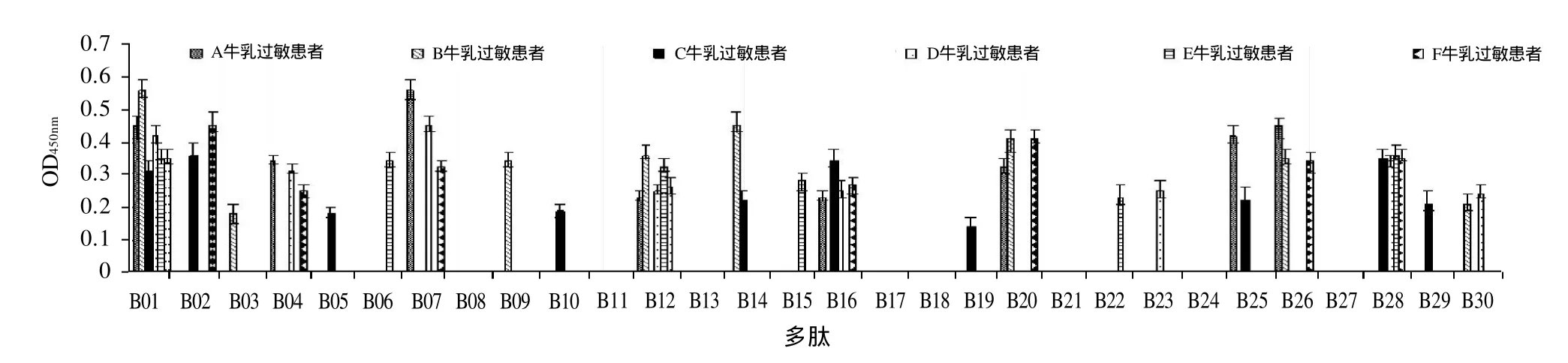
图3 A~F牛乳过敏患者识别β-乳球蛋白IgE抗原决定簇Fig.3 Identification of immunodominantβ-lactoglobulin epitopes from cow milk allergic patients numbered A through F
本研究以牛乳过敏患者血清反应率为65%以上的多肽为抗原决定簇。由图3可知,编号为B01多肽的识别率为100%(6/6,即与6份血清均发生免疫反应);B12的识别率为83.3%(5/6);B16、B28的识别率为66.7%(4/6);B04、B07、B20、B26的识别率为50%(3/6);个别个体血清对B03、B05、B09、B10、B29、B30发生免疫反应。因此,B01、B12、B16、B28为抗原决定簇,其氨基酸序列分别为LIVTQTMKGLDIQKV、ILLQKWENGECAQKK、TKIPAVFKIDALNEN、FDKALKALPMHIRLS。4条抗原决定簇在β-乳球蛋白氨基酸序列中的定位分别为17~31、72~86、92~106、152~166,结果见表2粗体部分。多肽17~31识别率为100%,是显性抗原决定簇。用非牛乳过敏患者血清识别抗原决定簇的OD450nm均低于0.1,本实验未附阴性对照的具体数据。
2.4 β-乳球蛋白IgE显性抗原决定簇(LIVTQTMK GLDIQKV)关键氨基酸的分析
为了找到影响致敏性的关键氨基酸,本研究选用分子较小的中性丙氨酸作为取代氨基酸。用丙氨酸依次取代LIVTQTMKGLDIQKV抗原决定簇的氨基酸,以未取代的抗原决定簇(AA17~31)作对照,由图4可知,第25位的甘氨酸被丙氨酸取代后的多肽致敏性增强,第20位的苏氨酸被丙氨酸取代合成的多肽、第23位蛋氨酸被丙氨酸取代合成的多肽及第27位的天冬氨酸被丙氨酸取代合成的多肽光密度值为零,多肽致敏性消失,其他氨基酸被丙氨酸取代后的多肽光密度值与对照相差不大。因此苏氨酸(AA20)、蛋氨酸(AA23)、天冬氨酸(AA27)是影响β-乳球蛋白致敏性的关键氨基酸。
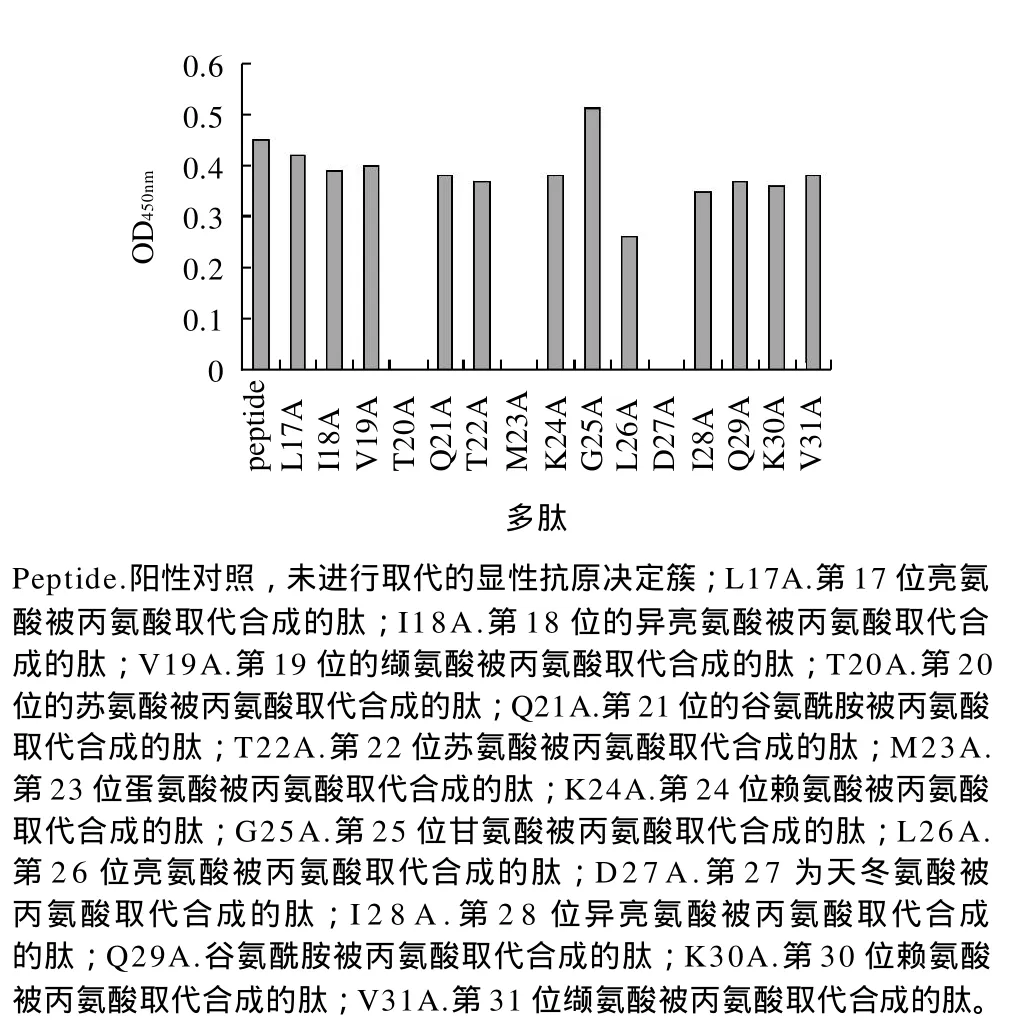
图4 影响β-乳球蛋白致敏性的关键氨基酸Fig.4 Critical amino acids for allergenicity of β-lactoglobulin
3 讨 论
Ⅰ型速发型超敏反应一般是由IgE介导的,鉴定牛乳过敏原IgE抗原决定簇,对于指导临床诊治牛乳过敏疾病及降低牛乳过敏原的致敏性均具有重要意义。有研究表明,在临床诊断牛乳过敏疾病时,发现αs1-酪蛋白抗原决定簇的特异性IgE抗体[7]。
人乳中β-乳球蛋白含量几乎为零,但是β-乳球蛋白与一些人类及动物lipocalin蛋白家族具有同源性。据报道这一类蛋白具有强致敏性,许多动物源性过敏原,如马的主要过敏原Equ c1、几种主要的鼠源性尿蛋白等都属于这类蛋白[8]。
早在乳蛋白的水解物中就发现了β-乳球蛋白的致敏片断[9-11]。本研究通过化学合成多肽的方法分析抗原决定簇,用6位牛乳过敏患者血清识别到β-乳球蛋白IgE抗原决定簇4条,其氨基酸序列分别为LIVTQTMKGLDIQKV、ILLQKWENGECAQKK、TKIPAVFKIDALNEN、FDKALKALPMHIRLS。其中识别率最高的LIVTQTMKGLDIQKV位于β-乳球蛋白的第17~31位,主要是由疏水性氨基酸构成,可能位于乳球蛋白的内部,在外界因素处理条件下才有可能暴露出来,而之前研究发现的抗原决定簇多位于分子表面的亲水性片段(AA124~134)[7,9-10]。氨基酸序列为AA17~31的IgE抗原决定簇位于β-乳球蛋白的N端,是显著区别于其他科属蛋白的保守序列,抗原决定簇AA152~166位于β-乳球蛋白的C端,与其他乳源蛋白序列具有相似性,此结论很好的解释了乳蛋白之间存在的免疫交叉反应性的原因。Ball等[12]发现的肽链97~108和Heinzmann等[11]识别的肽链95~113与本研究识别的肽链92~106抗原决定簇相一致。另外,本研究还识别到ILLQKWENGEC AQKK(AA72~86)和FDKALKALPMHIRLS(AA152~166)两条抗原决定簇,这在其他研究中尚未见报道。
找到IgE结合的关键氨基酸,通过基因工程或氨基酸修饰的方法降低过敏原致敏性是当前学者致力研究重点。花生过敏原Ara h1、Ara h2和Ara h3取代单个氨基酸可以实现IgE结合能力丧失或降低[8-10],而虾过敏原Pen a1需要取代两个以上氨基酸才能实现脱敏的目的[12]。本研究表明通过取代单个氨基酸可以实现β-乳球蛋白IgE结合能力的丧失,进而可以通过基因工程或氨基酸修饰的方法降低β-乳球蛋白致敏性,为低过敏婴儿配方粉的开发提供依据。
[1] TAYLOR S L. Immunologic and allergic properties of cow' s milk proteins in humans[J]. J Food Protection, 1986, 49(3): 239-250.
[2] SELO I, NEGRONI L, CREMINON C, et al. Allergy to bovine betalactoglobulin: specificity of human IgE using CNBr derived peptides[J].Int Arch Allergy Immunol, 1998, 117(1): 20-28.
[3] FRITSCHE R, ADEL-PATIENT K, BERNARD H, et al. IgE-mediated rat mast cell triggering with tryptic and synthetic peptides of bovine βlactoglobulin[J]. Int Arch Allergy Immunol, 2005, 138(4): 291-297.
[5] BARNETT D, BALDO B A, HOWDEN M E. Multiplicity of allergens in peanuts[J]. J Allergy Clin Immunol, 1983, 72(1): 61-68.
[6] 哈洛E, 莱恩D. 抗体技术实验指南[M]. 沈关心, 龚非力, 译. 北京:科学出版社, 2002: 240.
[7] WILLIAMS S C, BADLEY R A, DAVIS P J, et al. Identification of epitopes within beta-lactoglobulin recognized by polyclonal antibodies using phage display and PEPSCAN[J]. J Immunol Methods, 1998, 213(1): 1-17.
[8] FENNMA O R. 食品化学[M]. 3 版. 王璋, 译. 北京: 中国轻工业出版社, 2003: 715.
[9] ADAMS S L, BARNETT D, WALSH B J, et al. Human IgE-binding synthetic peptides of bovine β -lactoglobulin and α -lactalbumin. In vitro cross-reactivity of the allergens[J]. Immunol Cell Biol, 1991, 69(Pt3): 191-197.
[10] TOKITA F. Some readings on antigenic determinants of bovine milk protein[J]. Japan J Dairy Sci, 1985, 34: 229-235.
[11] HEINZMANN A, BLATTMANN S, SPUERGIN P, et al. The recognition pattern of sequential B cell epitopes of beta-lactoglobulin does not vary with the clinical manifestations of cow's milk allergy[J]. Int Arch Allergy Immunol, 1999, 120(4): 280-286.
[12] BALL G, SHELTON M J, WALSH B J, et al. A major continuous allergenic epitope of bovine beta-lactoglobulin recognized by human IgE binding[J]. Clin Exp Allergy, 1994, 24(8): 758-764.
Identification of IgE-binding Epitopes on β-lactoglobulin
CONG Yan-jun1,REN Fa-zheng2,*,YUN Zhan-you3
(1. School of Chemical and Environmental Engineering, Beijing Technology and Business University, Beijing 100048, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;3. Inner Mongolia Yili Industrial Group Co. Ltd., Hohhot 010080, China)
TS252.1
A
1002-6630(2010)15-0190-04
2009-11-18
“十一五”国家科技支撑计划项目(2006BAD04A06)
丛艳君(1978—),女,讲师,博士,主要从事乳蛋白质结构与功能研究。E-mail:congyj@th.btbu.edu.cn
*通信作者:任发政(1962—),男,教授,博士,主要从事功能乳制品研究。E-mail:renfazheng@263.net
