刺参对运动小鼠抗疲劳作用的研究
2010-09-13王静凤李晓林薛长湖
李 冰,王静凤,傅 佳,李晓林,李 辉,赵 芹,薛长湖*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
刺参对运动小鼠抗疲劳作用的研究
李 冰,王静凤,傅 佳,李晓林,李 辉,赵 芹,薛长湖*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
研究北方养殖刺参的主要活性成分和对运动小鼠抗疲劳的作用。结果表明:养殖刺参体壁富含酸性黏多糖、胶原蛋白、活性氨基酸和活性脂质等多种活性成分,能提高小鼠负重游泳能力、肝糖元含量和安静状态下小鼠血红蛋白含量,保持运动小鼠血红蛋白水平稳定,显著降低运动小鼠血乳酸的生成,促进运动后血乳酸的消除,加速运动血清尿素氮的清除。说明养殖刺参具有显著的抗疲劳和提高运动耐力的作用。
养殖刺参;抗疲劳;肝糖原;血乳酸;血清尿素氮
Abstract :This paper describes the bioactive composition of cultured sea cucumber Stichopus japonicus and its anti-fatigue effect in mice. The results indicated that body wall of S. japonicus was rich in acidic mucopolysaccharides, collagen, bioactive amino acids and lipids. In comparison with the control group, administration of Stichopus japonicus for 30 consecutive days prolonged the duration of exhaustive swimming in mice weighted with weights (approximately 5% of body weight), promoted the synthesis of liver glycogen and hemoglobin and kept a level of hemoglobin 90 min post-swimming similar to that before swimming, significantly decreased the generation of blood lactic acid and accelerated the elimination of blood lactic acid and blood urea nitrogen in mice after swimming. Based on these investigations, S. japonicus has an obvious anti-fatigue effect and improves exercise endurance in mice.
Key words:cultured Stichopus japonicus;anti-fatigue;liver glycogen;blood lactic acid;blood urea nitrogen
运动性疲劳既与体内内源性物质的消耗有关,也与神经、内分泌以及免疫系统的平衡调节相关。海参为棘皮动物门(Echinodermata)海参纲(Holothuroidea)楯手目(Aspidochirota)动物,是海洋中重要的食物和药物资源。现已证明,海参体壁中含有海参多糖、海参皂苷、海参胶原蛋白肽、海参脑苷酯、神经节苷酯等多种生物活性物质[1],这些活性物质作为生物信息分子对人类生理功能的调节起着重要的信号转导作用,具有提高免疫功能、抗肿瘤、抗凝血、抗血栓、降血脂、抗衰老等多种生理功效[2-5]。海参的种类和来源不同,因生活环境和所摄食物各异,致使其营养成分和功效存有差异。本实验拟在前期工作的基础上,以北方养殖刺参为研究对象,分析养殖刺参的主要成分及其对运动小鼠抗疲劳作用的影响,以期为养殖刺参的深度开发利用提供参考。
1 材料与方法
1.1 材料、试剂与仪器
养殖刺参,购自青岛市胶南养殖场,经本院中试实验基地加工成干制刺参。用于成分分析的刺参,经粉碎后备用。用于动物实验的刺参,分别制成匀浆,-40℃贮存,实验时以蒸馏水配成所需浓度悬浊液。Balb/c小鼠,雄性,体质量(18±1)g,SPF级,由北京维通利华实验动物中心提供,动物许可证号为SCXK(京)2007 — 0001。
糖原试剂盒、尿素氮试剂盒、乳酸试剂盒 南京建成科技有限公司;岩藻聚糖硫酸酯 美国Sigma公司;木瓜蛋白酶 广西南宁庞博生物工程有限公司;其他试剂均为国产分析纯或以上级别。
CA-958D型半自动生化分析仪 长春光机医疗仪器有限公司;Model 680型酶标仪 Bio RAD公司;835-50型氨基酸自动分析仪 日本日立公司。
1.2 方法
1.2.1 蛋白含量分析
采用凯氏定氮法测定[6]。
1.2.2 胶原蛋白含量分析
刺参经水解后,采用比色法测定其中羟脯氨酸含量,再经系数折算的方法测定胶原蛋白含量[7]。
1.2.3 酸性黏多糖含量分析
将刺参以木瓜蛋白酶酶解24h后,经离心、上清液定容,采用次甲基蓝法测定[8]。
1.2.4 总脂质含量分析
总脂质含量测定采用Folch法[9]。将刺参切碎,用氯仿:甲醇(2:1,V/V)匀浆,用乙酸锌静置过夜分层。收集下层氯仿层,无水硫酸钠脱水后过滤,真空旋蒸至干,所得残余物即为总脂质。氮气吹旋蒸瓶至质量恒定后称质量,旋蒸瓶增加的质量即为总脂质质量,除以原料质量即为总脂质含量。
1.2.5 总脂质组成成分分析
脂肪组分的测定采用硅胶柱层析法[10]。采用湿法装柱,将活化后的硅胶缓缓倒入层析柱(30cm×2.1cm)中,静置30min待硅胶柱稳定后,将含200~300mg总脂质的少量氯仿溶液上样,依次用氯仿洗脱中性脂、丙酮洗脱糖脂、甲醇洗脱磷脂,各自单独收集后旋蒸至干、称质量。得到各脂肪组分质量。
1.2.6 氨基酸组成分析
刺参准确称量(精确到0.0001g),经6mol/L HCl 溶液水解,采用氨基酸自动分析仪对其主要氨基酸组成进行分析。
1.2.5 动物分组及实验
Balb/c小鼠共4批,每批小鼠随机分为正常对照组和海参低、中、高剂量组,每组10只,分别测定负重游泳时间、血清尿素氮与血红蛋白含量、肝糖原含量、血乳酸含量。剂量组小鼠分别灌胃不同剂量的刺参(剂量分别为100、200mg/(kg bw·d)和400mg/(kg bw·d))。正常对照组小鼠灌胃生理盐水,灌胃体积为0.1mL/10g bw,连续30d。于末次灌胃后1h进行实验。
1.2.5.1 负重游泳实验
将各组小鼠分别称质量、编号,尾部各负一重物(约为体质量的5%)。分别把小鼠放入玻璃水族箱(50cm×30cm×40cm),水深为30cm,水温保持在(25±0.5)℃中游泳,以小鼠头部沉入水中10s不能浮出水面者为体力耗竭,记录小鼠自游泳开始至体力耗竭的时间,作为小鼠游泳时间。
1.2.5.2 血清尿素氮的测定
使小鼠在30℃的水中无负重游泳。分别于游泳前、游泳90min休息60min等不同时间,眼眶静脉丛采血,分离血清。按试剂盒法测定血清尿素氮含量。
1.2.5.3 血红蛋白水平测定
使各组小鼠分别在30℃的水中无负重游泳。分别于游泳前、游泳90min等不同时间,眼眶静脉丛取血,按照试剂盒法测定小鼠血红蛋白含量。
1.2.5.4 肝糖原含量测定
使各组小鼠分别在30℃的水中无负重游泳。分别于游泳前、游泳10min、游泳90min等不同时间脱颈椎处死小鼠,取肝脏。按照试剂盒法测定小鼠肝糖原含量。
1.2.5.5 血乳酸含量测定
使各组小鼠分别在30℃的水中无负重游泳。分别于游泳前、游泳10min、游泳10min休息20min等不同时间,眼眶静脉丛采血,按照试剂盒法测定小鼠全血乳酸含量。
1.3 统计学分析
数据分析采用SPSS 11.0软件进行单因素方差分析,并以LSD法进行两两比较,以P<0.05为具有统计学意义上的差异。实验结果用±s表示。
2 结果与分析
2.1 刺参的主要活性成分
化学分析结果表明,刺参体壁中蛋白、胶原蛋白、酸性黏多糖、总脂质的含量分别为72.7%、52.1%、14.9%和4.24%。总脂质中中性脂、糖脂和磷脂含量分别占26.1%、30.1%和43.8%。
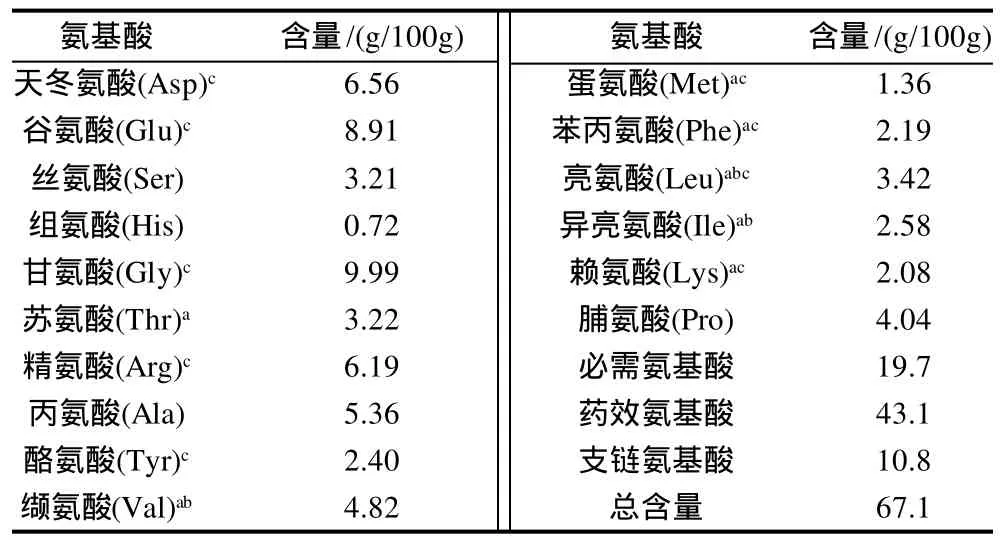
表1 刺参体壁氨基酸的组成和含量Table 1 Amino acid composition of body wall of Stichopus japonicus
由表1可见,除色氨酸和胱氨酸因水解时被破坏,共检测出16种氨基酸,总含量为67.1%,以Gly、Glu、Asp、Arg等药效氨基酸含量为高。必需氨基酸、支链氨基酸和药效氨基酸分别占氨基酸总量的29.3%、16.1%和64.2%。
2.2 对小鼠负重游泳耐力的影响
表2 刺参对小鼠负重游泳时间及对运动小鼠血红蛋白和血清尿素氮含量的影响(±s,n=10)Table 2 Effect of Stichopus japonicus on the duration of weightloaded exhausive swimming and the contents of hemoglobin and blood urea nitrogen in mice (± s,n=10)
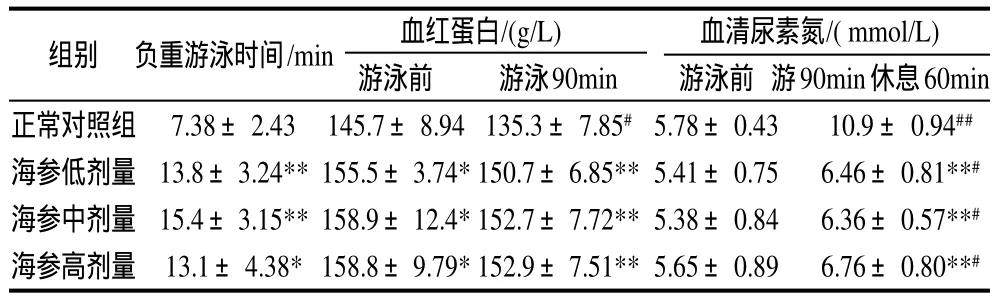
表2 刺参对小鼠负重游泳时间及对运动小鼠血红蛋白和血清尿素氮含量的影响(±s,n=10)Table 2 Effect of Stichopus japonicus on the duration of weightloaded exhausive swimming and the contents of hemoglobin and blood urea nitrogen in mice (± s,n=10)
注:*.与正常对照组相比,差异显著(P<0.05);**.与正常对照组相比,差异极显著(P<0.01);#.与游泳前相比,差异显著(P<0.05);##.与游泳前相比,差异极显著(P<0.01)。下同。
组别 负重游泳时间/min 血红蛋白/(g/L) 血清尿素氮/( mmol/L)游泳前 游泳90min 游泳前 游90min休息60min正常对照组 7.38±2.43 145.7±8.94135.3±7.85#5.78±0.43 10.9±0.94##海参低剂量 13.8±3.24**155.5±3.74*150.7±6.85**5.41±0.75 6.46±0.81**#海参中剂量 15.4±3.15**158.9±12.4*152.7±7.72**5.38±0.84 6.36±0.57**#海参高剂量 13.1±4.38*158.8±9.79*152.9±7.51**5.65±0.89 6.76±0.80**#
由表2可见,不同剂量的刺参均能显著提高小鼠负重游泳时间。与正常对照组比较,小鼠的平均负重游泳时间提高了91.1%,表明刺参能明显提高小鼠的运动耐力。
2.3 对运动小鼠血红蛋白含量的影响
由表2可见,不同剂量刺参均能显著提高安静状态下小鼠体内血红蛋白含量。当游泳开始后,随着体力继续消耗,正常对照组小鼠的血红蛋白含量明显下降,而刺参各组小鼠的变化不大,表明刺参能维持运动小鼠体内血红蛋白含量的相对稳定。
2.4 对运动小鼠血清尿素氮含量的影响
由表2可见,刺参对运动前安静状态下小鼠体内的血清尿素氮含量无显著性影响。运动后,各组小鼠体内血清尿素氮含量都明显增加。但与正常对照组比较,刺参组小鼠的血清尿素氮平均降低了40.15%。说明刺参能加速运动后血清尿素氮的清除。
2.5 对运动小鼠肝糖原含量的影响
表3 刺参对小鼠肝糖原和全血乳酸含量的影响(±s,n=10)Table 3 Effect of Stichopus japonicus on the contents of liver glycogen and blood lactic acid in mice (±s,n=10)
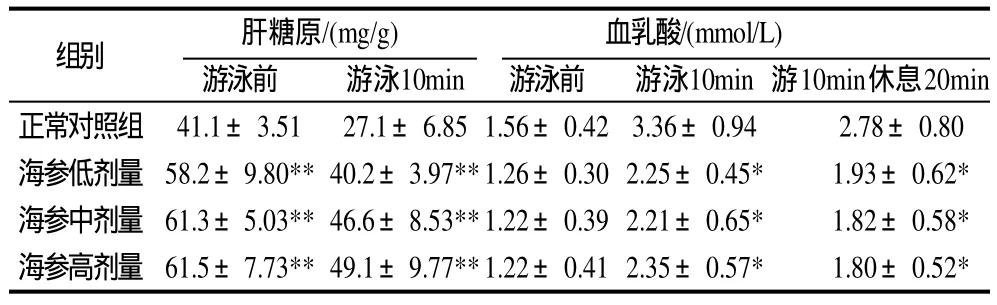
表3 刺参对小鼠肝糖原和全血乳酸含量的影响(±s,n=10)Table 3 Effect of Stichopus japonicus on the contents of liver glycogen and blood lactic acid in mice (±s,n=10)
组别 肝糖原/(mg/g) 血乳酸/(mmol/L)游泳前 游泳10min 游泳前 游泳10min游10min休息20min正常对照组 41.1±3.51 27.1±6.851.56±0.423.36±0.94 2.78±0.80海参低剂量 58.2±9.80**40.2±3.97**1.26±0.302.25±0.45* 1.93±0.62*海参中剂量 61.3±5.03**46.6±8.53**1.22±0.392.21±0.65* 1.82±0.58*海参高剂量 61.5±7.73**49.1±9.77**1.22±0.412.35±0.57* 1.80±0.52*
由表3可见,不同剂量刺参均能显著提高运动前安静状态下小鼠的肝糖元含量,与正常对照组比较,平均提高了49.7%。运动后小鼠要消耗肝糖元来维持血糖水平稳定,肝糖元含量随游泳时间的延长而迅速降低。游泳10min后,刺参组小鼠肝糖元含量较正常对照组平均提高了29.1%,说明刺参能明显延缓疲劳出现。
2.6 对运动小鼠血乳酸水平的影响
由表3可见,在游泳前安静状态时,刺参对小鼠全血乳酸含量无显著性影响。游泳10min,各组小鼠全血乳酸含量均较安静状态下显著提高。但与正常对照组比较,刺参能显著降低运动小鼠全血乳酸含量,平均下降了30.1%。游泳10min休息20min后,不同剂量的刺参均能显著降低运动后小鼠全血乳酸含量,较正常对照组平均降低了35.3%。说明刺参具有明显的消除乳酸、促进疲劳恢复的作用。
3 讨 论
本实验对北方养殖刺参体壁的主要活性成分及其抗疲劳作用进行了研究。结果表明,养殖刺参体壁中富含酸性黏多糖、胶原蛋白、药效和支链氨基酸、糖脂和磷脂等主要活性成分,具有显著的抗疲劳作用。
疲劳最直接和客观的表现是运动耐力下降,而力竭游泳时间是反映运动耐力的重要指标。负重游泳实验结果表明,刺参能显著提高小鼠的负重游泳时间,提高小鼠的运动耐力。血糖是影响长时间运动能力的重要限制性因素之一。肝糖元是血糖的贮存库,在机体血糖降低时可迅速分解释放入血,以维持血糖水平的稳定[11]。实验结果表明,刺参能显著提高小鼠的肝糖元储备,保证小鼠在运动过程中的供糖能力,从而延缓运动小鼠疲劳出现。乳酸是机体在激烈运动初期通过葡萄糖的无氧糖酵解途径获能的代谢终产物,乳酸在肌肉和血液中的堆积是运动性疲劳产生的主要原因之一。乳酸的消除有利于疲劳的恢复,提高小鼠的运动能力。实验结果显示,刺参能显著降低运动小鼠血乳酸的生成和促进运动后血乳酸的消除。血红蛋白的主要功能是运输氧气,其含量直接影响机体的运动耐力。实验结果表明,刺参能维持运动小鼠体内血红蛋白含量的相对稳定,保证机体氧气供应充足,进而促进机体有氧代谢的进行和乳酸的消除,提高运动耐力。血清尿素氮是蛋白质代谢的终产物,是评定机体对运动适应能力的重要指标之一。机体血清尿素氮含量随运动负荷的增加而增加,机体对负荷的适应能力越差,血清尿素氮的增加就越明显。实验结果显示,刺参能加速运动小鼠血清尿素氮的清除,显著提高小鼠的运动适应能力。
自由基的生成是导致运动性疲劳的一个重要的因素。自由基以及脂质过氧化产物一方面引起线粒体膜脂和膜蛋白发生交联,膜脂链缩短,引起线粒体膜流动性下降,膜的完整性破坏或者引起酶构象变化,亚基结构受损,致使ATP酶活性下降,机体分解利用ATP减少[12];另一方面破坏了电子漏的受控机制使线粒体呼吸Ⅲ态出现电子漏,致使合成ATP的效率下降[13]。养殖刺参体壁的化学分析结果显示,刺参体壁富含酸性黏多糖、胶原蛋白、活性脂质和活性氨基酸。有关海参酸性黏多糖的药效学已进行了深入研究,证明海参酸性黏多糖能显著提高红细胞SOD活性,具有显著的抗氧化作用。胶原蛋白是刺参体壁粗蛋白的主要成分,含有多种功能性活性肽,能有效清除超氧阴离子自由基和羟自由基,降低细胞MDA含量,提高细胞抗氧化能力,增强细胞膜的稳定性[14-15]。刺参体壁的药效氨基酸Gly、Glu、Asp、Arg具有抗疲劳活性。Gly是合成血红蛋白的基本原料,是生血、补血的物质基础;Gly和Glu是细胞合成谷胱甘肽的重要原料,谷胱甘肽在机体的抗氧化机制中起重要作用,尤其是还原型谷胱甘肽对于维持红细胞膜的完整性以及血红蛋白的运氧能力十分重要[16]。Glu是肌肉合成谷氨酰胺的前体物质,而谷氨酰胺能直接通过血脑屏障调节中枢神经系统的兴奋性。另外,谷氨酰胺还能将运动时产生的氨运送到肝肾解毒,从而维持血氨浓度的稳定,延迟中枢疲劳的出现。谷氨酰胺是糖异生供能的重要能源物质,在糖氧化供能不足的情况下,谷氨酰胺糖异生作用增强,从而提高运动能力[17]。L-Arg和L-Asp是较早提出的氨基酸抗疲劳产品,已经证明,Arg和Asp分别通过NO和促进脂肪氧化代谢途径提高运动耐力[18-20]。
支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)作为必需氨基酸,不仅是合成机体蛋白质的原料,还具有显著的抗疲劳作用[21]:能够抑制血液中的色氨酸进入脑内,减少5-羟色氨的合成,减轻中枢疲劳;通过清除生成的过多自由基或阻断线粒体膜上的自由基链式反应,保护心肌和骨骼肌的抗氧化功能,维持细胞膜的结构。另外,支链氨基酸能促进机体胰岛素、生长激素的分泌[22],从而加速肌肉蛋白质的合成,防止肌肉组织的降解,具有抗外周性疲劳作用,加快运动后机体的修复,具有糖的异生作用。黄金丽等[23]的研究表明,补充支链氨基酸可促进糖的异生作用,减少骨骼肌乳酸的积累,延缓疲劳的发生和促进运动后疲劳的消除。
另外,糖脂和磷脂是构成生物膜的重要脂质组分,具有参与造血、促进免疫功能、保持生物膜的结构和功能、促进大脑发育和提高反应能力、抗疲劳等重要生理功能[1]。
综上所述,养殖刺参体壁中含有全面的抗疲劳活性物质,具有显著的抗疲劳和提高运动耐力的作用。
[1] 宋迪, 吉爱国, 梁浩, 等. 刺参生物活性物质的研究进展[J]. 中国生化药物杂志, 2006, 27 (5): 316-319.
[2] 王静凤, 王奕, 逄龙, 等. 日本刺参(Apostichopus japonicus)的抗肿瘤及免疫调节作用研究[J]. 中国海洋大学学报, 2007, 37(1): 93-96.
[3] 赵芹, 王静凤, 逄龙, 等. 三种海参的主要活性成分和免疫调节作用的比较研究[J]. 中国水产科学, 2008, 15(1): 154-159.
[4] 高森, 王静凤, 王玉明, 等. 冰岛刺参调节血脂及其作用机制[J]. 武汉大学学报: 理学版, 2009, 55(3): 324-328.
[5] 逄龙, 王静凤, 王玉明, 等. 北极刺参多糖、皂苷和胶原蛋白多肽对血管内皮细胞的保护作用[J]. 中国药科大学学报, 2007, 38(5): 437-441.
[6] 刘箭. 生物化学实验教程[M]. 北京: 科学出版社, 2004: 9-13.
[7] SATTO M, KUNISAKI N, URANO N, et al. Collagen as the major edible component of sea cucumber (Stichopus japonicus)[J]. Food Chemistry and Toxicology, 2002, 67(4): 1319-1322.
[8] 刘红英, 薛长湖, 李兆杰, 等. 海带岩藻聚糖硫酸酯测定方法的研究[J]. 青岛海洋大学学报, 2002, 32(2): 236-240.
[9] FOLCH J, LEES M, SLOANE STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissues[J].Journal of Biological Chemistry, 1957, 226(1): 497-509.
[10] 张智翠. 太平洋牡蛎品质的季节性变化及贮藏过程中的生化变化[D].青岛: 中国海洋大学, 2006.
[11] 邓树勋, 王健. 高级运动生理学: 理论与应用[M]. 北京: 高等教育出版社, 2003: 4-5.
[12] 王友令, 张胜, 唐兆新. 氨基胍对内毒素血症肉鸡肝线粒体自由基代谢的影响[J]. 中国兽医科学, 2006, 36(2): 143-146.
[13] 戴捷, 梅启明. 六氯苯对大鼠肝脏线粒体抗氧化物酶同工酶的影响[J]. 毒理学杂志, 2006, 20(6): 385-387.
[14] ZHAO Qin, XUE Changhu , LI Zhaojie , et al. Neuroprotective effects of gelatin hydrolysates from Stichopus japonicus on hydrogen peroxideinduced PC12 cell damage[C]//2009 International Conference of Natural Product and Traditional Medicine. Xi' an: Springer-Verlag, 2009: 393-397.
[15] WANG Jingfeng, WANG Yuming, TANG Qingjuan, et al. Antioxidant activities of low-molecular-weight gelatin hydrolysate derived from the sea cucumber Stichopus japonicus[J]. Journal of Ocean University of China, 2010, 9(1): 94-98.
[16] 郑云郎. 谷胱苷肽的生物学功能[J]. 生物学通报, 1995, 30(5): 22-24.
[17] 曹桂霞, 李世昌, 白俊伟. 谷氨酰胺对机体免疫系统和运动能力的影响[J]. 中国临床康复, 2006, 10(16): 150-151.
[18] MARTIN B, FRITZ B, MARTIN F, et al. The prolonged intake of L-arginine-L-aspartate reduces blood lactate accumulation and oxygen consumption during submaximal exercise[J]. Journal of Sports Science and Medicine, 2005(4): 314-322.
[19] MAXWELL A J, HO H V, LE C Q, et al. L-arginine enhances aerobic exercise capacity in association with augmented nitric oxide production[J]. Journal Applied Physiology, 2001, 90(3): 933-938.
[20] SCHAEFER A, PIQUARD F, GENY B, et al. L-arginine reduces exercise-induced increase in plasma lactate and ammonia[J]. International Journal of Sports Medicine, 2002, 23(6): 403-407.
[21] 徐运杰, 方热军. 支链氨基酸的抗疲劳作用[J]. 氨基酸和生物资源,2008, 30(1): 65-69.
[22] de PALO E F, GATTI R, CAPPELLIN E, et al. Plasma lactate, GH and GH-binding protein levels in exercise following BCAA supp- lementation in athletes[J]. Amino acids, 2001, 20(1): 1-11
[23] 黄金丽, 欧明毫. 支链氨基酸对赛艇运动员极限运动血葡萄糖异生的影响[J]. 天津体育学院学报, 2006, 21(4): 297-298.
Anti-fatigue Effect of Sea Cucumber Stichopus japonicus in Mice
LI Bing,WANG Jing-feng,FU Jia,LI Xiao-lin,LI Hui,ZHAO Qin,XUE Chang-hu*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
TS254.1
A
1002-6630(2010)15-0244-04
2009-12-22
国家“863”计划项目(2007AA091805);国家自然科学基金项目(30972284;30871944)
李冰(1985—),男,硕士研究生,研究方向为海洋生物活性物质。E-mail:lb435317714@163.com
*通信作者:薛长湖(1964—),男,教授,博士,研究方向为水产品化学。E-mail:xuech@ouc.edu.cn
