笃斯越橘花青素提取物对3T3-L1前脂肪细胞生长的抑制作用
2010-10-27DavidPopovich
柳 嘉, David G. Popovich,景 浩,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2. 新加坡国立大学化学系,新加坡 117543)
笃斯越橘花青素提取物对3T3-L1前脂肪细胞生长的抑制作用
柳 嘉1, David G. Popovich2,景 浩1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2. 新加坡国立大学化学系,新加坡 117543)
目的:研究笃斯越橘花青素提取物对3T3-L1前脂肪细胞生长抑制作用及其作用机理。方法:采用MTT法观察细胞生长抑制并确定半数抑制浓度(IC50),LDH(lactate dehydrogenase)法评价提取物引起的细胞膜损伤,流式细胞计法测定细胞周期,荧光显微镜观察凋亡细胞的形态学特征。结果:笃斯越橘花青素提取物能够有效地抑制3T3-L1前脂肪细胞的生长且IC50约为214μg/mL;LDH实验表明细胞LDH释放率在24、48、72h分别为89.0%、85.2%、67.8%,72h时相对24h或48h明显降低(P<0.05),提取物对3T3-L1前脂肪细胞膜的通透性未见明显增加;笃斯越橘花青素提取物能够有效诱导细胞凋亡,同时在S或G0/G1期产生阻滞,但是对细胞的G2/M期未见明显影响,荧光显微镜观察细胞出现典型凋亡特征。结论:笃斯越橘花青素提取物能有效抑制3T3-L1前脂肪细胞生长的作用,具有开发为天然抗肥胖功能因子的潜在可能。
笃斯越橘花青素提取物;3T3-L1前脂肪细胞;生长抑制;细胞凋亡
笃斯越橘(Vaccinium uliginosum L.)是我国最主要的越橘属植物之一,其果实富含黄酮类物质,如花青素[1]、原花青素[2]、杨梅黄素[3]等。每100g笃斯越橘鲜果中花青素含量达343mg,是红豆越橘的两倍[4]。研究发现,花青素具有多种生物活性和药物功能,如抗氧化[5]以及抑制癌细胞生长和诱导细胞凋亡[6]等作用。花青素减肥功效的研究在近几年成为热点[7-8],抑制肥胖的主要途径包括减少能量摄入,增加能量支出,减少前脂肪细胞分化和增殖,减少脂肪细胞脂肪合成,增加脂肪分解和氧化等。前脂肪细胞可转化成为成熟脂肪细胞并增加脂肪组织,因此抑制前脂肪细胞生长是抗肥胖非常重要的一个途径[9]。本研究从笃斯越橘花青素提取物抑制细胞增殖、改变细胞膜通透性和引起细胞凋亡角度,研究笃斯越橘花青素提取物对3T3-L1前脂肪细胞增殖的抑制作用。以期为进一步开发和综合利用笃斯越橘资源提供有益的信息。
1 材料与方法
1.1 材料与试剂
笃斯越橘花青素提取物(bog bilberry anthocyanin extract,BBAE;花青素含量为25%) 大兴安岭华野生物工程有限公司;Swiss小鼠3T3-L1前脂肪细胞细胞株ATCC公司。
胎牛血清(FBS)、磷酸缓冲盐溶液(PBS)、三羟甲基氨基甲烷(Tris) 新加坡1st Base公司;十二烷基磺酸钠(SDS) 国药控股沈阳有限公司;DMEM培养基、四甲基偶氮唑蓝(MTT)、碘化丙啶(PI)、辅酶I(NADH)、丙酮酸钠 Sigma公司;0.04%台盼蓝溶液 美国MP Biomedicals公司;青霉素-链霉素溶液、胰蛋白酶-EDTA溶液(0.25%, EDTA 0.52 mmol/L) 加拿大Gibco公司;细胞周期反应液 美国Guava科技公司;其他试剂均为进口分析纯。
1.2 仪器与设备
全波长酶标仪 美国热电集团;BIO-RAD680酶标仪 美国伯乐公司;倒置显微镜、CX3生物显微镜、C-5060数码相机 日本Olympus公司;PCA流式细胞计 美国Guava科技公司。
1.33 T3 -L1前脂肪细胞的细胞培养
细胞在含有10%胎牛血清、100U/L青霉素、100 μg/mL链霉素的DMEM培养液中(以下简称DMEM10),于37℃、5%CO2、饱和湿度环境下常规培养。当细胞生长至80%~90%融合时,用胰蛋白酶-EDTA溶液化细胞。
1.4 MTT实验
取9 6孔培养板,每孔加入100μL细胞悬液,3T3-L1前脂肪细胞为2.5×104个/mL。96孔板放入37℃、5% CO2培养箱中进行贴壁培养。24h后弃去培养液,每孔加入100μL含有不同质量浓度的笃斯越橘花青素提取物的培养液(150~1500μg/mL),以不含有样品的DMEM10为空白对照,温箱孵育72h。除去培养液后,加入含有0.5mg/mL MTT的DMEM10培养基孵育4h,再加入100μL的0.1g/mL SDS(含0.1mol/L HCl)溶液过夜,以完全溶解出MTT紫色结晶产物。用酶标仪在570nm处(以630nm为参考波长)测定光密度值。实验重复3次。以药物浓度的对数与细胞存活率进行直线回归并求出 IC50(半数抑制浓度,即细胞存活率为50%时所需要的提取物的浓度)[10]。

1.5 乳酸脱氢酶释放量检测
取24孔培养板,每孔加入1mL 3T3-L1前脂肪细胞悬液,浓度为5×104个/mL。于37℃、5%CO2培养箱中培养。24h后弃去培养液,每孔加入1mL含有相应IC50的笃斯越橘花青素提取物的培养液,以不含有样品的DMEM10为空白对照,分别于24、48、72h收集上清液,500×g离心10min。取50μL离心后的上清液与2mL的Tris-EDTA-NADH溶液(含有50mmol/L Tris缓冲液,pH 7.4,37℃;5mmol/L EDTA;150μmol/L NADH)混合,温箱孵育12min,再加入200μL预热(37℃)过的13.5mmol/L丙酮酸钠溶液,混合均匀,于37℃、340nm波长用酶标仪测定3min内每分钟OD值的下降数值(ΔOD值)。实验重复3次,3个平行测定。结果以LDH(lactate dehydrogenase)释放率(样品LDH释放量与对照LDH释放量之比)表示。每分钟的ΔOD值下降率是每分钟样品ΔOD值与对照ΔOD值的比值,LDH释放率则为3min内每分钟ΔOD值下降率之和的均值[10]。
1.6 细胞周期及细胞凋亡测定
取24孔培养板,每孔加入1mL 3T3-L1前脂肪细胞悬液,浓度为5×104个/mL。于37℃、5%CO2培养箱中培养。24h后弃去培养液,每孔加入1mL含有相应IC50的笃斯越橘提取物的培养液孵育,以不含有样品的DMEM10为空白对照,实验重复3次,3个平行测定。分别于24、48、72h弃去培养液, 用1mL PBS溶液清洗细胞层,洗液收集至离心管中。每孔加入500μL 胰蛋白酶-EDTA消化液,在37℃培养箱内消化10min,加入1mL DMEM10培养液终止反应,将细胞悬液打匀后加入离心管中。以1mL PBS溶液清洗各孔,洗液收集至离心管中。离心管于500×g离心5min。小心吸去上清液,用1mL PBS溶液打匀细胞并500×g离心5 min,重复一次。去除上清液后,边剧烈振荡边向细胞沉淀中逐滴加入1mL预冷至-20℃的70%乙醇。置于4℃过夜。过夜后的溶液于500×g离心5min,小心吸去上清液,用1mL PBS溶液打匀细胞并500×g离心5min,重复一次。 去除上清液后, 加入200μL Guava细胞周期反应液并打匀。避光室温放置30min。于流式细胞计检测细胞周期,用Guava CytoSoft软件处理数据。
1.7 荧光显微镜观察
取94mm培养皿培养3T3-L1前脂肪细胞,浓度为5×104个/皿, 贴壁培养24h后弃去培养液,向皿中加入5mL含有相应IC50的笃斯越橘提取物的培养液,以不含有样品的DMEM10为空白对照。孵育72h后弃去培养液, 用5mL PBS溶液轻柔清洗细胞层,重复一次。缓慢加入5mL的质量分数3.7%福尔马林,覆盖细胞层,室温放置15min。去除福尔马林后,用5mL PBS溶液轻柔清洗细胞层,重复一次。 缓慢加入5mL预冷至-20℃甲醇,覆盖细胞,室温放置5min。去除甲醇,用5mL PBS溶液轻柔清洗细胞层2次。避光缓慢加入3mL的50 μg/mL PI染液,温箱孵育30min。去除染液后,用PBS溶液轻柔清洗细胞层2次,于超净台上放置直至干燥。于荧光显微镜下放大400倍观察细胞。
1.8 统计分析
每个实验重复3次,结果以x±s表示。LDH数据结果采用SPSS12.0软件进行One-Way ANOVA分析,邓肯氏多重检验用来确定数据间的显著性差异,显著水平设定为P<0.05;细胞周期数据组间结果(两组数据)采用两组资料的t检验,显著水平设定为P<0.05 。
2 结果与分析
2.1 笃斯越橘花青素提取物对3T3-L1前脂肪细胞的生长抑制
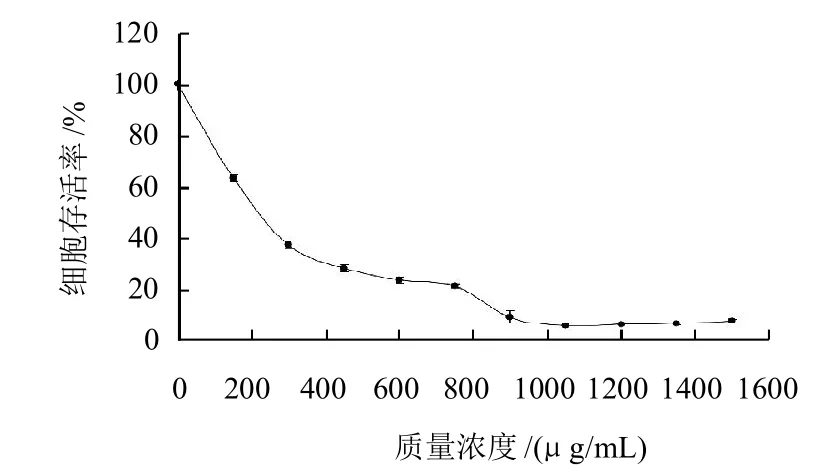
图1 笃斯越橘花青素提取物对3T3-L1前脂肪细胞生长抑制作用的剂量效应关系Fig.1 Cell growth inhibition effect of BBAE on 3T3-L1 preadipocytes
由图1可知,笃斯越橘花青素提取物对3T3-L1前脂肪细胞有明显生长抑制作用。随着笃斯越橘花青素提取物质量浓度的升高(150~900μg/mL),其抑制细胞生长的能力增强,剂量效应关系明显,细胞存活率从约100%降至10%。当提取物质量浓度介于900~1500μg/mL时,细胞存活率基本不变。以细胞存活率与提取物质量浓度的对数进行直线回归并求出IC50。经计算,笃斯越橘花青素提取物对3T3-L1前脂肪细胞生长抑制的IC50为(213.9 ± 19.6)μg/mL。
2.2 3T3-L1前脂肪细胞的LDH释放量检测
图2显示出3T3-L1前脂肪细胞LDH释放率与时间的关系。经处理24、48、72h LDH释放率分别为89.0%、85.2%、67.8%,48h和72h相对24h时分别减少了4%和21%。3T3-L1前脂肪细胞在3个时间段LDH释放率均低于100%,说明处理组和对照组相比没有更多的LDH释放,即笃斯越橘花青素提取物对3T3-L1前脂肪细胞细胞膜通透性未见明显变化。经统计分析,处理48h的3T3-L1前脂肪细胞LDH释放率与24h相比无明显差异,但72h与24h或48h相比均有明显降低(P<0.05)。研究原始数据发现(未列出),对照组细胞的LDH释放量随时间延长缓慢增长,但处理组细胞的LDH释放量基本保持不变,导致72h时细胞LDH释放率有显著减少。
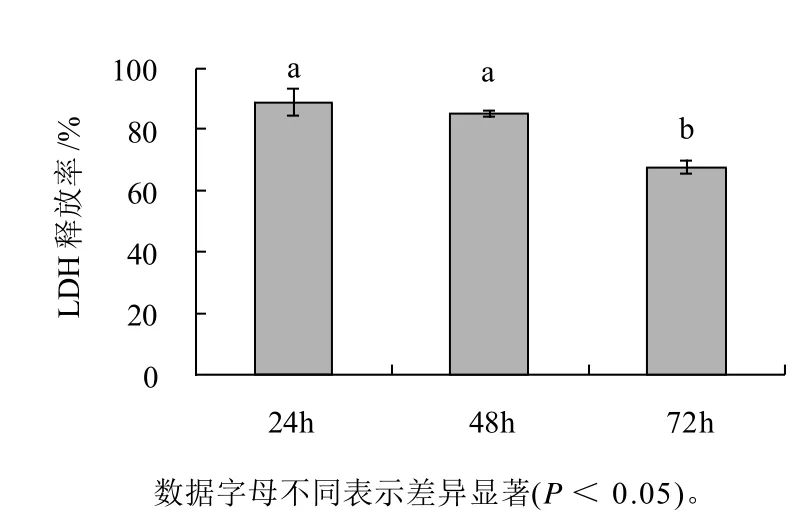
图2 3T3-L1前脂肪细胞LDH释放率Fig.2 LDH activity in 3T3-L1 preadipocytes after incubation for different periods of time in the presence of BBAE
2.3 3T3-L1前脂肪细胞的细胞周期变化
经过相应的IC50笃斯越橘花青素提取物处理,3T3-L1前脂肪细胞分别在24、48、72h于流式计上测定细胞周期的变化。用Guava CytoSoft软件进行细胞周期分析,表1为3T3-L1前脂肪细胞空白对照组和处理组细胞各个时期细胞组成的比例。每个时间段Sub-G1期的细胞,处理组均多于对照组;且随时间的增加(24~72h),处理组的Sub-G1期即凋亡细胞明显增多,24h至72h凋亡细胞比例从1%上升至14%;G2/M期细胞数量则未见明显变化;72h时G0/G1期细胞数量明显减少(P<0.05);24h时S期细胞数量显著下降(P<0.05),72h时则增多(P<0.05)。 笃斯越橘花青素提取物对3T3-L1前脂肪细胞有生长抑制作用,但没有明显改变细胞膜的通透性,却改变了细胞周期,诱导了细胞凋亡。

表1 3T3-L1前脂肪细胞细胞周期的变化Table 1 Cell cycle distribution of 3T3-L1 preadipocytes after incubation for different periods of time in the presence of BBAE
2.4 3T3-L1前脂肪细胞的细胞形态观察
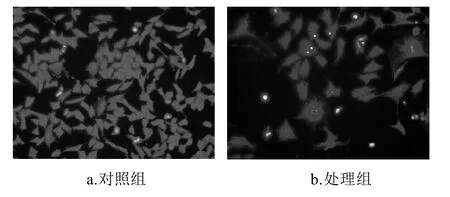
图3 笃斯越桔花青素提取物对3T3-L1前脂肪细胞细胞形态的影响(×400)Fig.3 Morphological micrographs of 3T3-L1 preadipocytes after incubation for 72 h with and without the presence of BBAE (×400)
将处理72h的3T3-L1前脂肪细胞固定并染色,利用荧光显微镜观察细胞形态,如图3所示。对照组的细胞完整,细胞核集中,生长状况良好。而处理组的细胞相对分散,细胞数量减少,细胞体积变大,细胞间连接基本消失,失去纤维状形态;细胞核内具有典型的凋亡细胞形态特征:如细胞核固缩、体积缩小,核染色质边集聚,凝聚成大小不同的块,断裂分散到细胞质中,可见致密浓染的黄色荧光。
3 讨 论
研究表明,笃斯越橘花青素提取物对Swiss小鼠前脂肪细胞3T3-L1有明显的生长抑制作用,且呈剂量效应。对其生长抑制机理进行研究发现,3T3-L1前脂肪细胞经笃斯越橘花青素提取物处理后,LDH释放率在24h和48h没有增加,在72h减少,表明笃斯越橘花青素提取物对3T3-L1前脂肪细胞产生的抑制作用,不是由改变细胞膜通透性途径实现的。Fantinelli等[11]用无酒精的阿根廷红酒花青素对Wistar大鼠心脏进行缺血再灌注损伤,与对照组相比L D H释放量较对照组降低。Marcollet等[12]用越橘花青素喂养SD大鼠,3min后发现血浆中的LDH释放量较对照组小。这些报道与本研究结果相一致,表明笃斯越橘花青素提取物不是通过改变细胞膜通透性途径抑制3T3-L1前脂肪细胞的生长,可能是通过直接和LDH结合改变3T3-L1前脂肪细胞的细胞膜性质[13]。提取物对3T3-L1前脂肪细胞细胞膜性质的影响有待进一步研究。
本实验结果显示,笃斯越橘花青素提取物能够有效诱导3T3-L1前脂肪细胞的细胞凋亡,细胞周期Sub-G1期凋亡细胞量有显著提高(P<0.05),呈时间效应,细胞形态出现典型凋亡特征。由于前脂肪细胞可转化成为成熟脂肪细胞,因此抑制前脂肪细胞生长是抗肥胖的一个重要途径[9]。有研究显示,一些天然产物可以抑制3T3-L1前脂肪细胞的生长并诱导细胞凋亡,如芦丁、柚皮素、柚皮苷、橙皮苷、白藜芦醇和染料木黄酮等[14-15]。笃斯越橘花青素提取物能有效抑制前脂肪细胞生长并诱导其凋亡,因此具有开发为抗肥胖食品的潜力。
近几年发现,天然产物诱导前脂肪细胞凋亡存在多种途径。槲皮素可通过降低线粒体膜电位,减少多聚(ADP-核糖)聚合酶合成等途径诱导3T3-L1前脂肪细胞凋亡[16]。茶多酚可以影响细胞周期蛋白激酶CDK2表达,最终抑制细胞有丝分裂[17]。辣椒素通过激发半胱氨酸蛋白酶-3等途径抑制前脂肪细胞生长并诱导产生大量凋亡细胞[18]。笃斯越橘花青素提取物诱导3T3-L1前脂肪细胞的细胞凋亡的途径有待进一步的研究。
综合MTT和LDH实验结果,笃斯越橘花青素提取物对3T3-L1前脂肪细胞有生长抑制作用,其生长抑制机理不是通过改变细胞膜的通透性,而是通过改变细胞周期并诱导了细胞凋亡,从而达到对3T3-L1细胞的生长抑制效果。
4 结 论
笃斯越橘花青素提取物对Swiss小鼠前脂肪细胞3T3-L1有明显的生长抑制作用,且呈剂量效应,IC50约为214μg/mL。
经笃斯越橘花青素提取物处理后,3T3-L1细胞的LDH释放率没有增加(24~48h),反而在72h有减少。细胞生长抑制作用不是通过提取物改变细胞膜通透性实现的。
笃斯越橘花青素提取物能够有效诱导3T3-L1细胞细胞凋亡,细胞周期Sub-G1期凋亡细胞量有显著提高(P<0.05), 细胞形态出现典型细胞凋亡特征。
[1]JIAO Hongjun, WANG S Y. Correlation of antioxidant capacities to oxygen radical scavenging enzyme activities in blackberry[J]. Journal of Agricultural and Food Chemistry, 2000, 48: 5672-5676.
[2]张兴茂, 林松毅, 刘静波, 等. 长白山笃斯越橘果实原花青素浸提工艺的研究[J]. 食品科学, 2007, 28(11): 186-189.
[3]杨桂霞, 范海林, 郑毅男, 等. 笃斯越橘果实中黄酮类化合物的分离鉴定[J]. 吉林农业大学学报, 2005, 27(6): 643-644.
[4]孟凡丽. 越橘果实中花色苷的提取分离、定量和结构鉴定研究[D].长春: 吉林农业大学, 2003.
[5]ASTADI I R, ASTUTI M, SANTOSO U, et al. In vitro antioxidant activity of anthocyanins of black soybean seed coat in human low density lipoprotein (LDL)[J]. Food Chemistry, 2009, 112: 659-663.
[6]LIU M, LI X Q, WEBER C, et al. Antioxidant and antiproliferative activities of raspberries[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 2926-2930.
[7]TSUDA T, UENO Y, KOJO H, et al. Microarray profiling of gene expression in human adipocytes in response to anthocyanins[J]. Biochemical Pharmacology, 2006, 71: 1184-1197.
[8]MOLAN A L, LILA M A, MAWSON J. Satiety in rats following blueberry extract consumption induced by appetite-suppressing mecha-nisms unrelated to in vitro or in vivo antioxidant capacity[J]. Food Chemistry, 2008, 107: 1039-1044.
[9]WANG Y W, JONES P J. Conjugated linolic acid and obesity control: efficacy and mechanisms[J]. International Journal of Obesity and Related Metabolic Disorders, 2004, 28: 941-955.
[10]JING H, KITTS D D. Antioxidant activity of sugar-lysine Maillard reaction products in cell free and cell culture systems[J]. Archives of Biochemistry and Biophysics, 2004, 429: 154-163.
[11]FANTINELLI J C, SCHINELLA G, CINGOLANI H E, et al. Effects of different fractions of a red wine non-alcoholic extract on ischemia-reperfusion injury[J]. Life Science, 2005, 76(23): 2721-2733.
[12]MARCOLLET M, BASTIDE P, TRONCHE P. Effect angio-protecteur des anthocyanosides de Vaccinium myrtillus objectivevis-à-vis de la liberération de la lactate deshydrogenase (LDH) et de ses isoenzymes cardiaques chez le rat soumisauneepreuve de nage[J]. Socie té De Biologie De Clermont-Ferrand, 1969, 163: 1786-1789.
[13]DANPURE C J. Lactate dehydrogenase and cell injury[J]. Cell Biochemistry and Functinon, 1984, 2(3):144-148.
[14]HSU C L, HUANG S L, YEN G C. Inhibitory effect of phenolic acids on the proliferation of 3T3-L1 preadipocytes in relation to their antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2006, 54: 4191-4197.
[15]HARMON A, HARP J. Differential effects of flavonoids on 3T3-L1 adipogenesis and lipolysis[J]. American Journal of Physiology-Cell Physiology, 2001, 280: 807-813.
[16]HSU C L, YEN G C. Induction of cell apoptosis in 3T3-L1 preadipocytes by flavonoids is associated with their antioxidant activity[J]. Molecular Nutrition and Food Research, 2006, 50(11): 1072-1079.
[17]KAO Y H, HIIPAKKA R A, LIAO S. Modulation of obesity by a green tea catechin[J]. American Journal of Clinical Nutrition, 2000, 72: 1232-1234.
[18]HSU C L, YEN G C. Effects of capsaicin on induction of apoptosis and inhibition of adipogenesis in 3T3-L1 cells[J]. Journal of Agricultural and Food Chemistry, 2007, 55:1730-1736.
Growth Inhibition Effect of Bog Bilberry Anthocyanin Extract on 3T3-L1 Preadipocytes
LIU Jia1,David G. Popovich2,JING Hao1,*
( 1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;
2. Department of Chemistry, National University of Singapore, Singapore 117543, Singapore)
Objective: To study the inhibition effect and its mechanism of bog bilberry (Vaccinium uliginosum L.) anthocyanin extract (BBAE) on the growth of 3T3-L1 preadipocytes. Methods: MTT assay, LDH (lactate dehydrogenase) assay, flow cytometry and fluorescence microscope were used for measuring cell growth inhibition (IC50), membrane permeability, cell cycle and the morphological features of apoptotic cells, respectively. Results: BBAE effectively inhibited the growth of 3T3-L1 preadipocytes in a dosage-dependent way, with an IC50 of approximately 214μg/mL. 3T3-L1 preadipocytes showed a significant (P<0.05) lower LDH release (67.8%) after exposure to BBAE for 72 h than for 24h (89.0%) and 48 h (85.2%). No obvious improvement in the membrane permeability in 3T3-L1 preadipocytes was observed after BBAE treatment. BBAE effectively induced apoptosis of 3T3-L1 preadipocytes, significantly (P<0.05) increased cell population in the sub-G1 phase, had no significant effect in the G2/M phase and exhibited a block in the S and G0/G1 phases. After incubation for 72 h in the presence of BBAE, 3T3-L1 preadipocytes exhibited typical apoptosis features observed under fluorescence microscope.
bog bilberry anthocyanin extract;3T3-L1 preadipocytes;growth inhibition;apoptosis
R282.71
A
1002-6630(2010)15-0248-05
2010-01-06
中央高校基本科研业务费专项资金项目(2009-2-11)
柳嘉(1985—),女,硕士,研究方向为营养与食品安全。E-mail:jessicaliujia@gmail.com
*通信作者:景浩(1957—),男,教授,博士后,研究方向为营养与安全。E-mail:haojing@cau.edu.cn
