硫化氢对大鼠机体重要脏器的损伤观察
2010-09-13褚银平
褚银平
硫化氢(H2S)是新近发现的第3个内源性气体信号分子,在心血管系统中具有舒张血管、负性肌力、抑制血管平滑肌细胞增殖及保护心肌等多种生物学效应[1],尤其在心肌保护中的作用备受关注。研究发现,在异丙肾上腺素引起的大鼠心肌缺血模型中,H2S可有效保护心肌细胞及心肌收缩功能[2];在硫氢化钠(NaHS)预处理的大鼠离体心肌缺血再灌注模型中,H2S可以减轻心肌损害程度及心肌梗死面积,缩短心律失常的持续时间[3];在大鼠心肌缺血再灌注模型中,外源性给予NaHS后,心肌梗死面积缩小[4]。但是,H2S作为一种有毒气体,是造成环境污染,引起某些职业病的有毒物质之一,超生理剂量的H2S对中枢神经系统和呼吸系统产生抑制作用[5,6],因此有必要就H2S对大鼠机体重要脏器的作用进行研究。
1 材料与方法
1.1 实验动物及分组 健康雄性Wistar大鼠32只,体重270 g~320 g,由山西医科大学生理教研室提供。将32只大鼠随机分成4组,每组 8只。即对照组、NaHS 2.8 μ mol/kg组、NaHS 8.4 μ mol/kg 组和 NaHS 14.0 μ mol/kg 组 。
1.2 血流动力学监测 实验大鼠腹腔注射25%的乌拉坦(0.4 mL/100 g)麻醉、固定在手术台上。分离右颈总动脉,经右颈总动脉将导管插入左心室接BL-410生物机能试验系统(成都泰盟科技有限公司)。实验组分别于颈动脉插管30 min后静脉注射相应剂量的NaHS(购自美国Sigma公司);对照组注射等体积生理盐水。各组大鼠分别在给药前及给药后 0.5 h、1 h、2 h、4 h用BL-410生物机能试验系统记录左室收缩压(LVSP)、左室舒张末压(LVEDP)及左室内压最大变化速率(±dp/dtmax)。
1.3 标本采集与检测 全部动物于用药后4 h,打开胸腹腔直视下从腹主动脉抽取血标本,离心(6 000 r/min)分离血浆。采用亚甲蓝分光光度法测定血浆H2S浓度,测定仪器为上海光谱仪器有限公司生产的721型可见光分光光度计。用放射免疫法(ELISA)测定血浆肿瘤坏死因子(TNF-α)、髓过氧化物酶(MPO)浓度,采用试剂盒购自美国R&D公司。测定仪器为北京航宇浪琴医疗设备有限公司生产的ZS-2型自动化板式酶标仪。
1.4 形态学观察 经腹主动脉采血后,迅速摘取大鼠的心、肝、脑、肺及肾组织置于10%中性甲醛液中固定保存,石蜡包埋、切片及苏木素-伊红(Hematoxylin-eosin,HE)染色,光学显微镜下观察各组织形态学变化。
2 结 果
2.1 血流动力学指标监测(见表1) 各实验组与对照组比较差异无统计学意义(P>0.05)。
表1 各组大鼠血流动力学指标变化(±s)
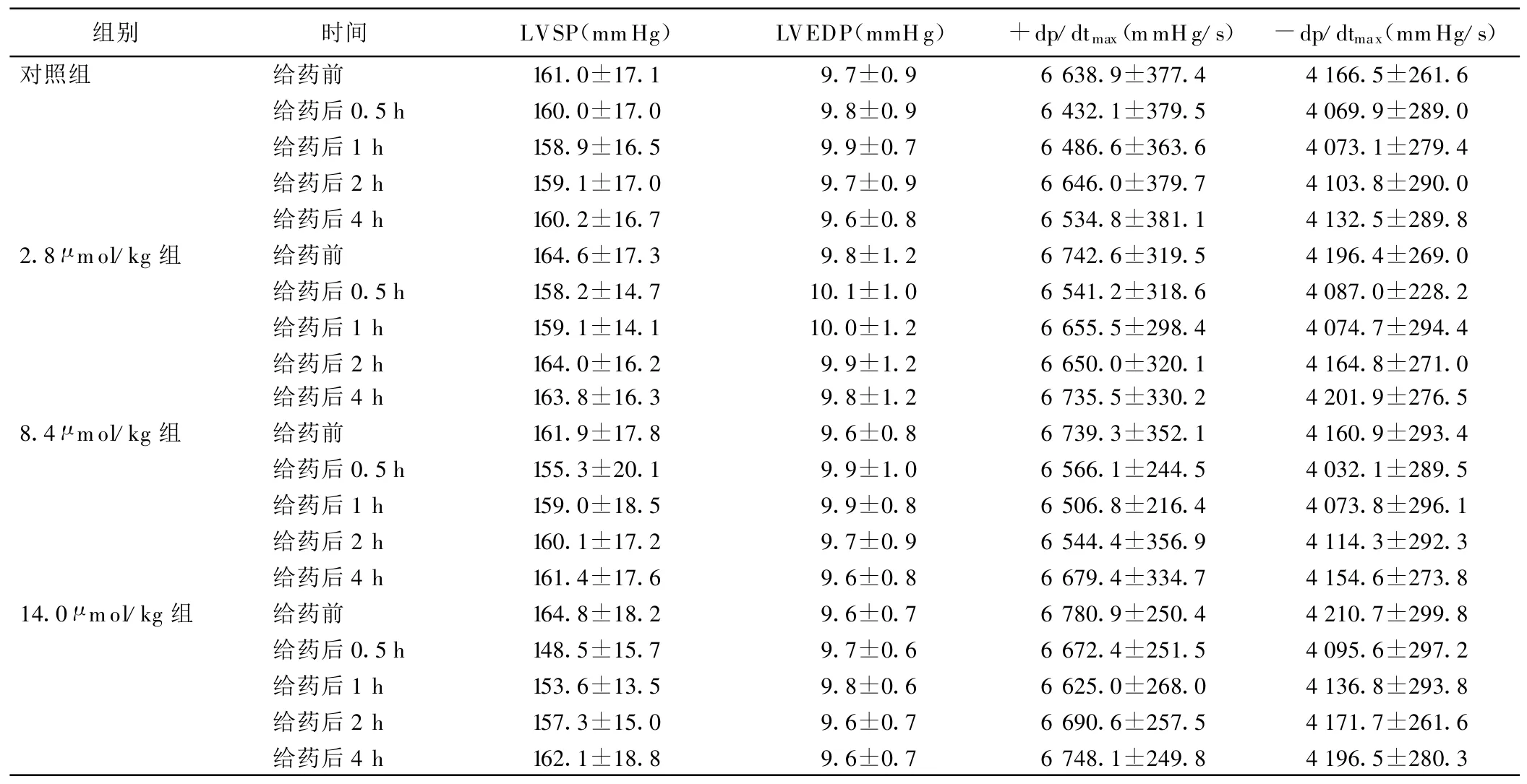
表1 各组大鼠血流动力学指标变化(±s)
组别 时间 LVSP(mmHg) LVEDP(mmHg) +dp/dtmax(mmHg/s) -dp/dtmax(mmHg/s)对照组 给药前 161.0±17.1 9.7±0.9 6 638.9±377.4 4 166.5±261.6给药后0.5 h 160.0±17.0 9.8±0.9 6 432.1±379.5 4 069.9±289.0给药后1 h 158.9±16.5 9.9±0.7 6 486.6±363.6 4 073.1±279.4给药后2 h 159.1±17.0 9.7±0.9 6 646.0±379.7 4 103.8±290.0给药后4 h 160.2±16.7 9.6±0.8 6 534.8±381.1 4 132.5±289.8 2.8 μ mol/kg组 给药前 164.6±17.3 9.8±1.2 6 742.6±319.5 4 196.4±269.0给药后0.5 h 158.2±14.7 10.1±1.0 6 541.2±318.6 4 087.0±228.2给药后1 h 159.1±14.1 10.0±1.2 6 655.5±298.4 4 074.7±294.4给药后2 h 164.0±16.2 9.9±1.2 6 650.0±320.1 4 164.8±271.0给药后4 h 163.8±16.3 9.8±1.2 6 735.5±330.2 4 201.9±276.5 8.4 μ mol/kg组 给药前 161.9±17.8 9.6±0.8 6 739.3±352.1 4 160.9±293.4给药后0.5 h 155.3±20.1 9.9±1.0 6 566.1±244.5 4 032.1±289.5给药后1 h 159.0±18.5 9.9±0.8 6 506.8±216.4 4 073.8±296.1给药后2 h 160.1±17.2 9.7±0.9 6 544.4±356.9 4 114.3±292.3给药后4 h 161.4±17.6 9.6±0.8 6 679.4±334.7 4 154.6±273.8 14.0 μ mol/kg组 给药前 164.8±18.2 9.6±0.7 6 780.9±250.4 4 210.7±299.8给药后0.5 h 148.5±15.7 9.7±0.6 6 672.4±251.5 4 095.6±297.2给药后1 h 153.6±13.5 9.8±0.6 6 625.0±268.0 4 136.8±293.8给药后2 h 157.3±15.0 9.6±0.7 6 690.6±257.5 4 171.7±261.6给药后4 h 162.1±18.8 9.6±0.7 6 748.1±249.8 4 196.5±280.3
2.2 各组大鼠血清生化指标测定(见表2)
表2 各组血浆中T NF-α、MPO 、H2S浓度的变化(±s)
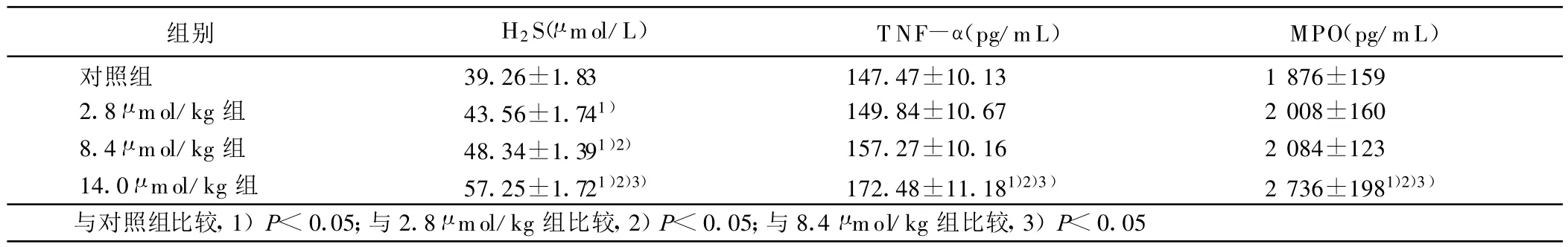
表2 各组血浆中T NF-α、MPO 、H2S浓度的变化(±s)
组别 H2S(μ mol/L) T NF-α(pg/mL) MPO(pg/mL)对照组 39.26±1.83 147.47±10.13 1 876±159 2.8 μ mol/kg 组 43.56±1.741) 149.84±10.67 2 008±160 8.4 μ mol/kg 组 48.34±1.391)2) 157.27±10.16 2 084±123 14.0 μ mol/kg 组 57.25±1.721)2)3) 172.48±11.181)2)3) 2 736±1981)2)3)与对照组比较,1)P<0.05;与 2.8 μ mol/kg组比较,2)P<0.05;与8.4 μ mol/kg组比较,3)P<0.05
2.3 实验动物形态学改变(见表3)

表3 硫化氢对大鼠重要脏器的作用
3 讨 论
大鼠血清中 H2S的含量约为(45.6±14.2)μ mol/L,生理状态下其通过细胞内环磷酸鸟苷(cGMP)途径使血管平滑肌舒张,达到舒张血管的作用[6]。研究发现:外源性给予NaHS后,H2S对在离体、在体实验动物的心肌具有保护作用[2-4]。然而,Trevisani等[7]研究发现,H2S能够激发神经源性气道炎症反应;在蛙皮素诱导的急性胰腺炎相关的肺损伤动物模型中,血浆H2S水平升高,使用CSE阻滞剂炔丙基甘氨酸(PPG)可降低血浆H2S水平,同时降低炎症反应,减轻胰腺及肺组织的损伤[8];在脂多糖诱导的内毒素血症和多脏器衰竭的大鼠模型中,血浆H2S水平升高,肺脏及肝脏中MPO活性随之增高,使用PPG可以减弱MPO活性,减轻组织损伤的程度[9,10];研究提示:内源性H2S的升高可能参与机体的炎症反应。
本研究结果显示,血浆超生理剂量的H2S对健康大鼠左心室LVSP、LVEDP及±dp/dtmax无明显影响(P>0.05)。此结果与先前心肌缺血-再灌注模型中H2S具有改善心功能的作用有差别,其原因有待进一步研究。本研究结果还显示,静脉注射不同剂量NaHS后,大鼠血浆中TNF-α和MPO浓度随血浆H2S浓度的增加而增加,尤其是NaHS 14.0 μ mol/kg组血浆TNF-α和MPO浓度的增加较明显(P<0.05)。提示静脉给予H2S供体 NaHS达到 14.0 μ mol/kg时,可引起大鼠机体明显的炎症反应,表现为血浆炎症因子TNF-α和M PO的浓度增加。
本实验采用HE染色,在光镜下观察大鼠各重要脏器的形态学变化,发现随大鼠血液H2S浓度的增加,大鼠的心、脑、肝、肾和肺脏组织的炎症反应在加重,组织损伤的程度也在加重,组织损伤尤其见于 NaHS 14.0 μ mol/kg组,提示超生理剂量的H2S参与了全身炎症反应。
[1]Zhao W,Zhang J,Lu Y,et al.The vaso relaxant effect of H(2)S as a novel endogenous gaseous K(ATP)channel opener[J].EMBO J,2001,20(21):6008-6016.
[2]Geng B,Chang L,Pan CS,et al.Endogenous hydrogen sulfide regulation of myocardial injury induced by isoproterenol[J].Biochem Biophys Res Commun,2004,318(3):756-763.
[3]Johansen D,Ytrehus K,Bax ter GF.Exogenous hydrogen sulfide(H2S)protects against regional myocardial ischemia-reperfusion injury:Evidence for a role of KATPchannels[J].Basic Res Cardiol,2006,101(1):53-60.
[4]Zhu YZ,Wang ZJ,Ho P,et al.Hydrogen sulfide and its possible roles in myocardial ischemia in experimental rats[J].J Appl Physiol,2007,102(1):261-268.
[5]Beauchamp RO,Bus JS,Popp JA,et al.A critical review of the literature on hydrogen sulfide toxicity[J].Critical Reviews in T oxicology,1984,13(1):25-97.
[6]Warenycia MW,Goodwin LR,Benishin CG,et al.Acute hydrogen sulfide poisoning:Demonstration of selective uptake of sulfide by the brain stem by measurement of brain sulfide levels[J].Biochem Pharmacol,1989,38(6):973-981.
[7]Trevisani M,Patacchini R,Nicoletti P,et al.Hydrogen sulfide causes vanilloid receptor 1-mediated neurogenic inflammation in the airway s[J].Br J Pharmacol,2005,145(8):1123-1131.
[8]Bhatia M,Wong FL,Fu D,et al.Role of hydrogen sulfide in acute pancreatitis and associated lung injury[J].FASEB J,2005,19(6):623-625.
[9]Li L,Bhatia M,Moore PK.Hydrogen sulphide:A novel mediator of inflammation[J].Curr Opin Pharmacol,2006,6(2):125-129.
[10]羡晓辉,黄新莉,周晓红,等.硫化氢与内毒素血症大鼠心肌损伤的关系[J].生理学报,2007,59(3):357-362.
