冈田酸致培养皮层神经元毒性作用的研究
2010-09-13赵晋枫李灵敏刘乃红
赵晋枫,王 丹,李灵敏,刘乃红,张 策
阿尔兹海默病(Alzheimer's disease,AD)即老年性痴呆是以进行性记忆和认知功能丧失为临床特征的大脑退行性疾病[1],神经细胞外以β淀粉样蛋白(Aβ)沉积为核心形成老年斑(senile plaques,SP),神经细胞内以异常过度磷酸化的tau蛋白为核心形成神经元纤维缠结(neurofibrillarytangle,NFTs),tau蛋白是一种微管相关蛋白主要存在于轴突内,它的主要功能是促进微管的形成和保持微管的稳定性[2]。研究表明,tau蛋白磷酸化程度是体内多种蛋白激酶的磷酸化和蛋白磷酸酶的去磷酸化两种作用平衡的结果,其中,PP2A是脑内调节tau蛋白去磷酸化主要的磷酸酶。冈田酸(okadaic acid,OA)是一种海洋生物提取物,对蛋白磷酸酶2A(PP2A)有特异性抑制作用[3],研究证实,OA能特异性降低PP2A活性引起神经元微管相关蛋白tau异常过度磷酸化[4,5],继而引起神经元毒性。
1 材料与方法
1.1 皮层神经元的培养 选用新生3 d以内的Wister大鼠(山西医科大学动物管理中心提供),乙醚麻醉后,常规消毒,打开颅骨,取出两侧大脑半球,置于D-Hank's液中。剥除脑膜,分离出大脑皮层组织。将皮层组织锐性切割成1 mm3大小,转移至离心管,加入0.125%的胰酶,小心吹打后静置2 min,吸出并收集上清液,用D-Hank's液重悬沉淀的组织,再次吹打,直至均形成单细胞悬液。1 000 r/min离心5 min,弃上清液。加入全培液,吹打均匀。将细胞悬液转移至预先铺有多聚赖氨酸的培养板上(M TT测定是细胞培养在96孔板上),置 37℃,5%CO2培养箱中贴壁培养。细胞贴壁3 d后,依据细胞生长情况,按每毫升培养液加入6 μ L10 μ mol/L的阿糖胞苷作用 24 h~48 h,以抑制胶质细胞的生长,使神经元得以纯化。根据细胞生长速度和培养液的pH变化,2 d~3 d半量换液。
1.2 实验分组 将Wister大鼠随机分为正常组、5 nmol/L OA组、10 nmol/L OA组、20 nmol/L OA组与皮层神经元共培养。
1.3 乳酸脱氢酶(LDH)的测定 加入OA24 h后,收集培养上清液,用PBS洗两遍,每瓶加入0.1 mol/L PBS-0.05 mmol/L EDTA(pH8.0)3 mL,再加入 150μ L 1%Triton-X100,用长吸管反复吹打使细胞溶解,收集细胞悬液。参照试剂盒说明书测定培养液LDH的活性。
1.4 四唑盐(MTT)法测定细胞存活率 取96孔板培养的10 d左右的细胞,吸弃各孔原培养液,加入含10%血清的DMEM培养基100 μ L,再加入 5 mg/mL M TT 工作液 20 μ L,混 匀,37℃孵育4 h。吸弃各孔培养液,每孔加入100μ L DM SO,振荡10 min,使其充分溶解,在酶标仪490 nm处测量各孔A值。以正常组A值均数为100%,计算细胞存活率(%)=各孔A值/正常值A值均数×100%。
2 结 果
2.1 原代神经细胞培养 原代细胞呈贴壁生长,接种1 d后,细胞完全贴壁,形成椭圆形的芽孢状,周围有明显的光晕,细胞折光性好,活性强。3 d后加入阿糖胞苷抑制胶质细胞的生长,并观察细胞的增殖情况,得到纯化的神经元。培养至10 d左右细胞状况良好,胞体呈梭形或锥形,胞浆透明,折光性强,有明显的立体感,突起发育好,相互交织成网状。可以用来进行以下试验。
2.2 LDH检测(见表1) 加入OA后,随着浓度的增加,LDH也显著增加,且呈现剂量依赖性,5 nmol/L OA组与正常组差异无统计学意义。显微镜观察显示,加入20 nmol/L OA后大部分神经元的胞体折光性下降,突起回缩明显,甚至断裂溶解成碎片,而5 nmol/L的OA与正常组差异无统计学意义。
表1 不同浓度OA对LDH的影响(±s) U/mg◦prot

表1 不同浓度OA对LDH的影响(±s) U/mg◦prot
组别 n LDH正常组 5 115.874±6.641 5 nmol/L OA组 5 121.434±8.259 10 nmol/L OA组 5 157.754±9.0101)20 nmol/L OA组 5 183.714±6.0651)与正常组比较,1)P<0.05
2.3 M TT检测(见表2) 正常组细胞存活率为100%,加入OA后,细胞活力显著降低,5 nmol/L OA组与正常组比较差异无统计学意义,10 nmol/L OA组、20 nmol/L OA组的OA引起细胞活力逐渐下降(P<0.05),表现为M TT水平降低。
表2 不同浓度OA对MT T的影响(±s)
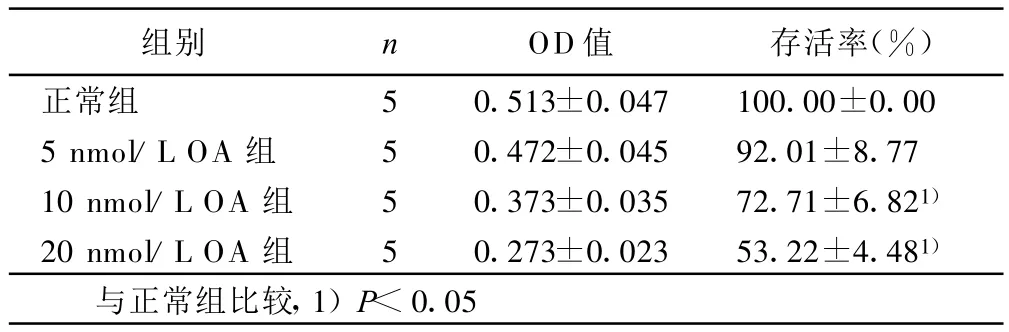
表2 不同浓度OA对MT T的影响(±s)
组别 n OD值 存活率(%)正常组 5 0.513±0.047 100.00±0.00 5 nmol/L OA 组 5 0.472±0.045 92.01±8.77 10 nmol/L OA 组 5 0.373±0.035 72.71±6.821)20 nmol/L OA 组 5 0.273±0.023 53.22±4.481)与正常组比较,1)P<0.05
3 讨 论
神经元纤维缠结是AD的特征性病理改变之一,由高度磷酸化的tau蛋白组成。生理条件下,蛋白磷酸酶(主要是PP2A)与蛋白激酶调节tau蛋白磷酸化水平,使之处于低水平磷酸化的动态平衡[6]。有研究报道,AD病人脑中PP2A活性降低30%左右,PP2A活性降低是导致AD病人tau蛋白过度磷酸化的主要原因[7]。OA是一种特异性的PP2A抑制剂,在体内或体外条件下,OA可使神经细胞内微管相关蛋白tau过度磷酸化,进而使tau蛋白结合组装微管的生物学功能降低而致微管解聚。由于微管在神经细胞的轴浆运输、极性维持等生理活动中具有重要作用,所以,tau蛋白过度磷酸化会严重阻碍细胞的正常生理功能,最终导致神经细胞退化[8,9]。据报道,在培养的皮层神经元中加入OA,可以引起 tau蛋白的异常过度磷酸化[10],另外,还有研究显示,在培养的海马神经元、小脑颗粒细胞和Neuro-2a成神经瘤细胞中加入OA 24 h后,检测LDH显著升高,M TT也显示细胞活力明显降低[11-13]。本实验结果也显示,在培养的皮层神经元中加入OA后,LDH增加,MT T的活力显著降低,本研究仅观察了OA对于培养神经元所产生的毒性作用,其具体机制还有待于进一步探讨。
[1]Tatsch MF,Bottino CM,Azevedo D,et al.Neuropsychiatric symptoms in Alzheimer's disease and cognitively impaired,nondemented elderly from a community-based sample in Brazil:Prevalence and relationship with dementia severity[J].Am J Geriatr Psychiatry,2006,14(5):438-451.
[2]Kawasumi M,Hashimoto Y,Chiba T,et al.M olecular mechanisms for neuronal cell death by Alzheimer's amyloid precursor protein2relevant insults[J].Neurosignals,2002,11(5):236-250.
[3]Fernandez JJ,Candenas M L,Souto ML,et al.Okadaic acid,useful tool for studying cellular processes[J].Curr Med Chem,2002,9(2):229-262.
[4]Ling qiang Zhu,Yangyang Yin,Jianzhi Wang.Effect of L-carnitine on tau hyperphosphorylation and spatial memory deficit induced by okadaic acid in rats[J].Alzheimer's and Dementia,2009,5(4):395-396.
[5]Baig S,van Helmond Z,Love S.Tau hyperphosphory lation affects Smad 2/3 translocation[J].Neuroscience,2009,163(2):561-570.
[6]Iqbal K,Grundke-Iqbal I.Pharmacological approaches of neurofibrillary degeneration[J].Curr Alzheimer Res,2005,2(3):335-341.
[7]Kins S,Crameri A,Evans DR,et al.Reduced protein phos-phatase 2A activity induces hyperphosphorylation and altered compartmentalization of tau in transgenic mice[J].J Biol Chem,2001,276(41):38193-38200.
[8]Yoon S,Choi J,Haam J,et al.Reduction of mint-1,mint-2,and APP over expression in Okadaic acid-treated neurons[J].Neuroreport,2007,18(18):1879-1883.
[9]Yoon S,Choi J,Huh JW,et al.Calpain activation in Okadaic acid induced neurodegeneration[J].Neuroreport,2006,17(7):689-692.
[10]Kim D,Koh WK,Kim JU,et al.Okadaic acid-induced upregulation of nitrotyrosine and heme oxygenase-1 in rat cortical neuron cultures[J].Neurosci Lett,2001,297(1):33-36.
[11]Chen LQ,Wei JS,Lei ZN,et al.Induction of Bcl-2 and Bax was related to hyperphos phory lation of tau and neuronal death induced by okadaic acid in rat brain[J].Anat Rec A Discov M ol Cell Evol Biol,2005,287(2):1236-1245.
[12]Furukawa K,D'souza I,Crudder CH,et al.Proapoptotic effects of tau mutations in chromosome 17 frontotemporal dementia and Parkinsonism[J].Neuroreport,2000,11(1):57-60.
[13]Furukawa K,Mattson MP.Taxol stabilizes[Ca2+]i and protects hippocampal neurons against ex citotoxicity[J].Brain Res,1995,689(1):141-146.
