黄芪多糖对兔动脉粥样硬化内皮细胞功能的影响
2010-09-13曾国安陈玉燕吴清华
曾国安,陈玉燕,李 博,吴清华
血管内皮细胞功能紊乱、内皮细胞损伤是动脉粥样硬化(atherosclerosis,AS)的显著特点,急性冠脉综合征及脑卒中患者体内均有不同程度的血管内皮细胞功能紊乱和损伤。在引起动脉粥样硬化的众多因素中,高胆固醇血症、氧化应激反应过强、免疫调节功能异常是三个不可缺少的重要危险因素。AS是以动脉内皮细胞功能障碍、脂质沉积、炎症反应、平滑肌细胞迁移与增殖为主的病理改变,是导致冠脉事件、脑卒中事件等心脑血管疾病的直接原因[1]。黄芪多糖(Astragaluspolysaccharids,APS)是从中药黄芪中提取的有效活性成分,具有多种生物活性,以往的研究证实APS对心血管疾病有良好的预防作用,但其确切机制尚不完全清楚。本实验依据APS抗氧化、免疫调节等作用[2],探讨其对冠心病血管内皮功能及炎症反应的影响。
1 材料与方法
1.1 动物 新西兰雄性兔40只,体重2.4 kg±0.3 kg,以普通饲料或高胆固醇饲料分笼喂养,室温18℃~22℃,自由摄食、饮水。
1.2 试剂与药品 三酰甘油(TG)测定试剂盒(GPO-PAP法)、总胆固醇(TC)测定试剂盒(CHOD-PAP法)、高密度脂蛋白胆固醇(HDL-C)测定试剂盒(磷钨酸-镁沉淀法):中生北控生物科技股份有限公司生产;丙二醛(M DA)测定试剂盒(硫代巴比妥酸法)、超氧化物歧化酶(SOD)测定试剂盒(黄嘌呤氧化酶法)、一氧化氮(NO)测定试剂盒(硝酸还原酶法):南京建成生物工程研究所生产;内皮素-1(ET-1)测定试剂盒(放射免疫法):北京东亚免疫技术研究所生产;C-反应蛋白(CRP)测定试剂盒(胶乳比浊法):上海捷门生物技术合作公司生产;卡托普利由上海华氏制药有限公司生产;黄芪多糖由美国泛华医药公司北京代表处提供。
1.3 模型制备 随机将40只新西兰雄性兔分为4组,每组各10只。空白组:正常颗粒饲料;其余3组从实验第1天起给予高脂饲料,牛血清1 mL/kg从耳缘静脉注射1次;黄芪多糖(APS)组:普通饲料加质量分数为1.5%的胆固醇喂养,每天同时腹腔注射APS(500 mg/kg);卡托普利组:同时灌喂卡托普利(5 mg/kg),相当于临床剂量的5倍;空白组、模型对照组给予等体积的生理盐水4 mL/kg;实验周期10周。测血清TG、TC、HDL-C、NO、MDA和CRP浓度以及SOD活性,并测血浆ET-1浓度,计算斑块面积。并作形态学分析。
1.4 统计学处理 用SPSS 12.0软件处理数据,计量资料以均数±标准差(±s)表示,采用t检验比较两组均数间的差异。
2 结 果
2.1 各组新西兰兔空腹 TG、TC、HDL-C、斑场面积比较(见表1) 模型对照组、APS组与空白组相比,空腹TG、TC均明显升高(P<0.05);APS组与模型对照组相比,TG明显下降(P<0.01),而 TC无明显变化(P>0.05),说明APS能降低 TG,但对TC无降低作用。模型对照组、APS组与空白组相比,HDL-C均因TC的升高而代偿性地升高(P<0.05),但模型对照组、卡托普利组的HDL-C/TC显著低于空白组(P<0.05),说明此时HDL-C不能充分运输外周 TC回肝脏代谢,而 APS组的HDL-C/TC的比值与空白组较为接近(P>0.05);模型对照组与卡托普利组各项指标无差异。APS组斑块面积明显低于模型对照组和卡托普利组(P<0.01)。
表1 各组新西兰兔空腹TG、TC、HDL-C比较(±s)
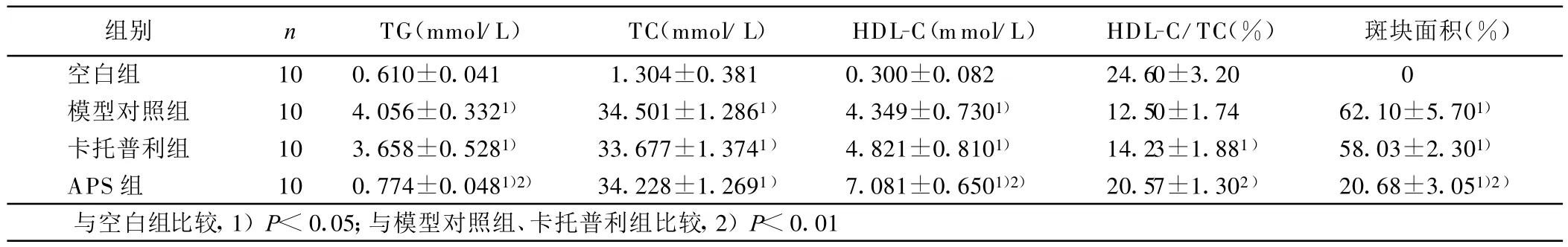
表1 各组新西兰兔空腹TG、TC、HDL-C比较(±s)
组别 n TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) HDL-C/TC(%) 斑块面积(%)空白组 10 0.610±0.041 1.304±0.381 0.300±0.082 24.60±3.20 0模型对照组 10 4.056±0.3321) 34.501±1.2861) 4.349±0.7301) 12.50±1.74 62.10±5.701)卡托普利组 10 3.658±0.5281) 33.677±1.3741) 4.821±0.8101) 14.23±1.881) 58.03±2.301)APS组 10 0.774±0.0481)2) 34.228±1.2691) 7.081±0.6501)2) 20.57±1.302) 20.68±3.051)2)与空白组比较,1)P<0.05;与模型对照组、卡托普利组比较,2)P<0.01
2.2 各组新西兰兔空腹血清MDA、NO、CRP、ET-1浓度及SOD活性(见表2) 模型对照组与空白组相比,空腹MDA、NO、CRP均明显升高(P<0.01);APS组与模型对照组相比,MDA、NO、CRP明显下降(P<0.05或 P<0.01);同时,模型对照组SOD活性显著下降(P<0.01),但APS组SOD活性明显高于模型对照组(P<0.01)。模型对照组与空白组、APS组比较,ET-1浓度明显升高;空白组与APS组比较,ET-1浓度无差异;模型对照组与卡托普利组各项指标无差异。
表2 各组新西兰兔空腹血清MDA、NO、CRP、ET-1浓度及SOD活性比较(±s)

表2 各组新西兰兔空腹血清MDA、NO、CRP、ET-1浓度及SOD活性比较(±s)
组别 n SOD(U/mL) MDA(nmol/mL) NO(μ mol/L) CRP(mg/L) ET-1(pg/mL)空白组 10 1.228±0.081 2.430±0.200 2.828±0.505 2.703±1.303 472.00±26.01模型对照组 10 0.915±0.0801) 49.821±11.5031) 8.655±1.0611) 9.244±3.3511) 511.16±21.541)卡托普利组 10 0.954±0.0711) 36.150±17.1041) 7.617±1.2491) 6.451±2.7031) 505.23±25.091)APS组 10 1.167±0.0792) 4.851±0.7381)2) 5.729±0.4911)2) 4.705±2.2341)3) 478.21±28.983)与空白组比较,1)P<0.01;与模型对照组、卡托普利组比较,2)P<0.01;与模型对照组比较,3)P<0.05
2.3 主动脉AS病理学观察 对照组家兔主动脉内膜光滑,未见斑块形成。苏丹IV染色后,模型对照组、卡托普利、APS组主动脉内膜均有肉眼可以观察到的不同程度的红色斑块,呈点、斑、条状,有些融合成片,边界清晰,突出于内膜表面,但表面无明显破溃,病变以主动脉弓处最为严重。光学显微镜下,正常主动脉壁内皮完整无损伤;模型对照组血管内粥样硬化斑块明显向内膜凸起,纤维帽下可见大量泡沫细胞和少量细胞碎片,斑块处中膜平滑肌细胞受压萎缩,可见平滑肌细胞增生;卡托普利组与模型对照组类似;APS组与模型对照组比较病变明显减轻,出现少量的泡沫细胞。
3 讨 论
AS的发病过程十分复杂,血浆中ET-1升高是AS快速进展的危险标志[3]。本组实验结果显示,高脂饲料喂养新西兰兔10周,血清 TG、TC、ET-1明显升高,HDL-C/TC 明显降低,说明HDL对胆固醇的清除能力降低,可引发类似人类AS的病变。病理学观察,主动脉均形成明显的脂质斑块和粥样斑块,证明了高脂血症及 AS模型成功,APS组 TG、ET-1明显降低,HDL-C/TC明显升高,提示APS可干预AS的形成和发展。卡托普利为血管紧张素转换酶抑制剂,可通过减少血管紧张素Ⅱ的生成和缓激肽的降解,增加NO的合成,保护血管内皮细胞,已广泛应用于高血压和心力衰竭的治疗。高剂量卡托普利能防止高脂喂养的动物形成明显的AS[4],而本组实验使用15.0 mg/(kg◦d),是人用剂量的6倍,结果显示对AS的形成无防治作用,进一步证实卡托普利对AS形成的抑制作用与剂量有关。大量研究表明,脂质过氧化是AS发生的重要环节,高脂血症时,体内自由基的产生和清除之间的平衡遭到破坏[5],许多自由基清除剂如SOD活性降低,产生大量脂质过氧化物(LPO)及其终产物MDA,LPO可直接损伤内皮细胞,导致内皮细胞退行性变化和通透性增强,氧化修饰的低密度脂蛋白(ox-LDL)可促进单核细胞和平滑肌细胞对 LDL的吞噬,减少胆固醇的清除,加速泡沫细胞的形成[6,7]。Bjorkerucl等的研究证明,ox-LDL能诱导血管平滑肌细胞(vascular smoooeh musclecells,VSMC)凋亡、增殖与凋亡失衡,与AS及其并发症的形成有关。本实验观察到,APS能明显降低血清LPO,升高SOD活性,增强抗氧化能力,以及保护内皮细胞的功能,从AS形态学进一步证实,APS能明显减轻或减少粥样斑块的程度和面积,HE染色后光镜观察,内膜下泡沫细胞层数减少,平滑肌细胞增生减轻。炎症学说与细胞凋亡是AS研究的新领域,相关文献报道,AS病变中不仅含有大量的脂质,而且有大量炎症细胞浸润,且在AS发展的不同时期均有慢性炎症反应。有人发现急性冠脉综合征患者的外周血中含有炎性介质,如白介素-6(IL-6)、CRP,以及促炎性细胞因子白介素-1 β(L-1 β)、肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)等浓度明显升高,同时,ox-LDL能刺激T细胞,激活炎症反应,诱导巨噬细胞和血管壁细胞多种炎症介质的表达,这些因子将AS灶内各种细胞间通过自分泌、旁分泌相互联系、相互影响,使病变得以发展[1],而炎症过程最具有标志的因子是 CRP[8]。本组实验结果显示,AS模型组中 NO、CRP浓度升高,APS组NO、CRP浓度明显降低。NO是血管内皮舒张因子,具有扩张血管、抗血小板黏附聚集、抑制VSMC增殖等保护血管的作用,是生理状态下对抗AS发生发展的重要因素。本组实验中的AS模型为粥样斑块期,可见淋巴细胞和单核细胞浸润,提示炎症反应的存在,在炎性介质和细胞因子IL-1β、TNF-α等刺激下,诱导血管平滑肌细胞、巨噬细胞等诱生型一氧化氮合酶(iNOS)表达,产生大量NO,NO又与反应产生ONOO-,后者释放NO2、◦OH,加重内皮细胞的损伤,诱导内皮细胞凋亡,促使AS发展[9,10],最近发现在正常血管和AS各阶段的VSMC中都存在细胞凋亡,尤其在晚期则有大量细胞凋亡[11]。同时,ox-LDL、TNF-α等也能诱导细胞凋亡。总之,黄芪多糖可明显降低血清中总胆固醇、三酰甘油、丙二醛和内皮缩血管肽的含量,从而减轻内皮缩血管肽对血管的损伤作用;同时升高一氧化氮、超氧化物歧化酶及总抗氧化活力。应用黄芪多糖家兔光镜下可见腹主动脉内膜表面基本光滑,内皮细胞形态基本完好,提示其具有较好的对抗氧化损伤和保护血管内皮细胞的功能。本组实验结果支持上述观点,APS具有免疫调节作用,抑制促炎性细胞因子的产生和释放,具有抗AS的作用,但详细机制有待进一步证实[12]。
[1]许文亮,郭新贵,徐延路,等.冠心病患者血浆胆固醇与内皮素-1、C-反应蛋白及血小板可溶性P选择素相关性研究[J].新医学,2006,35(6):330-332.
[2]徐军,黄向娟,齐发联.黄芪注射液对冠心病患者血管内皮功能的影响[J].中国临床康复,2007,8(9):1762-1763.
[3]Hughes GC,Annex BH.A ngiogenic therapy for coronary artery and peripheral arterial disease[J].Ex pert Rev Cardiovasc Ther,2008,3(3):521-535.
[4]董晓燕,张桂清,方向明,等.卡托普利对动脉粥样硬化家兔内皮素和血管紧张素Ⅱ的影响及其与原癌基因 c-myc和c-fos的相关关系[J].中国动脉硬化杂志,2006,10(3):221-223.
[5]张红珍,李丽.黄芪、三七对动脉粥样硬化模型C反应蛋白的影响[J].中西医结合心脑血管病杂志,2004,2(10):589-560.
[6]吴勇,欧阳静萍,涂淑珍,等.黄芪多糖对动脉粥样硬化内皮细胞损伤的影响[J].湖北中医学院学报,2006,4(1):21-22.
[7]律颖,贾敏江.黄芪治疗心绞痛的药理研究与临床应用[J].心脏杂志,2009,13(1):65-66.
[8]胡炯宇,黄跃生,宋华培,等.槲皮素和黄芪甲苷对大鼠缺氧心肌细胞的保护作用[J].中国烧伤杂志,2007,23(3):175-177.
[9]Steffens GC,Yao C,Prével P,et al.M odulation of angiogenic potential of collagen matrices by covalent incorporation of heparin and loading with vascular endothelial growth factor[J].Tissue Eng,2006,10(9):1502-1509.
[10]付华,陈焕春,王东升.黄芪注射液对冠心病患者血液流变学及血脂的影响[J].现代中西医结合杂志,2006,15(2):165-166.
[11]Rakhit R D,Seiler C,Wustmann K,et al.Tumour necrosis factoralpha and interleukin-6 release during primary percutaneous coronary intervention for acute myocardial infarction is related to coronary collateral flow[J].Coron Artery Dis,2005,16(3):147-152.
[12]王静,吴时达,闫亚飞,等.复方丹参注射液对冠心病患者血管内皮功能及内皮素和一氧化氮合酶基因表达的影响[J].中国动脉粥样硬化杂志,2009,12(5):585-588.
