针刺对高脂大鼠主动脉脂联素受体基因表达的影响1)
2010-09-13袁爱红
袁爱红,蔡 辉
脂联素(adiponectin,APN)是白色脂肪组织分泌的细胞因子,对脉管系统有良性作用[1,2]。研究显示,APN具有直接的抗动脉粥样硬化的作用[3-8],对细胞间黏附分子-1、血管细胞间黏附分子-1和E选择素等黏附分子的表达具有很强的抑制作用;能够抑制巨噬细胞清道夫受体CA-1的表达,导致巨噬细胞氧化低密度脂蛋白(ox-LDL)吸收明显降低、抑制泡沫细胞的形成[6];能够削弱平滑肌细胞中生长因子诱导的DNA合成[7],造成通过ERK信号转导的抑制;APN的高聚体(HMW)形式通过激活AMPK能够选择性地抑制内皮细胞的凋亡[8]。APN与脂联素受体(AdipoR)结合后发挥各项生理功能。研究发现,AdipoR1和AdipoR2在同组织同影响条件下表达有不同。为了探讨AdipoR不同亚型在高脂饮食机体主动脉表达的变化以及针刺对该变化的影响,本研究采用实时荧光RT-PCR技术检测了高脂饮食诱导的高脂血症大鼠主动脉AdipoR1和AdipoR2的基因表达情况。
1 材料与方法
1.1 实验动物 为刚断乳的SD雄性大鼠26只,体重54 g~69 g,由南京军区南京总医院动物实验中心提供[许可证号SYXK(苏)2003-0032]。
1.2 实验方法 所有SD大鼠均适应性喂养1周,根据体重随机分为自配方高脂饲料组(17只)和普通饲料组(对照组,9只),喂养12周后,空腹过夜,球后静脉取血 3 mL,室温静置1 h后,3 000 r/min离心5 min,分离血清置-20℃冰箱保存,测血脂四项、一氧化氮(NO)和髓过氧化物酶(M PO)。然后根据体重将高脂饲料组大鼠随机分为模型组(8只)和针刺组(9只),干预 4周。针刺组:选取后三里、内庭、心俞三穴,进针后,每穴快速行针1 min,后三里和内庭接通G6805Ⅱ型电针仪连续波15 min,强度1 mA,频率10 Hz。每次选取一侧肢体,两侧轮流,周一到周六治疗,周日休息,连续4周。实验期间所有大鼠均自由摄食饮水,每周测1次身长、体重。
1.3 观察指标和方法 实验结束后,禁食24 h,于次日8:00用20%氯胺酮,以1 mL/100 g剂量麻醉后,剪开胸腹腔,暴露心脏,心脏取血5 mL,血液样品处理同上,然后于冰盘中分离主动脉,置液氮中保存待测各项指标。三酰甘油(TG)用TPO-PAP法,总胆固醇(TC)用CHOD-PAP法,高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)用选择性沉淀法,NO用硝酸还原法,MPO用邻连茴香胺法,主动脉AdipoR1和AdipoR2基因检测用实时荧光RT-PCR法。
1.4 实时荧光RT-PCR步骤
1.4.1 RNA的提取 取主动脉组织100 mg,加入1 mLTrizol
1.5 统计学处理 干预前后比较用配对样本t检验,多组资料组间比较用单因素方差分析,方差齐性用 LSD,方差不齐用Games-Howell。统计软件用SPSS 15.0,计量资料以均数±标准差±s)表示。
2 结 果
2.1 针刺对高脂大鼠血脂的影响(见表1) 干预前,针刺组、模型组 TG、TC明显高于对照组(P<0.01),LDL-C高于对照组但无统计学意义(P>0.05);模型组和针刺组TG、TC差异无统 计学意义(P>0.05)。干预后,针刺组TG和TC明显降低(P<0.01),模型组、对照组干预前后TG和TC的差异无统计学意义(P>0.05)。试剂,室温下形成Trizol与细胞的混合液。将细胞裂解液转至离心管中,室温下放置5 min;12 000 r/min 4℃离心10 min,将上清液移入新离心管。加入氯仿,上下振荡15 s,溶液呈乳白状,室温静置3 min;12 000 r/min 4℃离心15 min;将无色上清水相移至另一离心管;上清水相中加入等体积的异丙醇,轻轻混匀,室温静置10 min;12 000 r/min 4℃离心10 min;去上清,沿管壁加入1 mL 75%的乙醇(用DEPC处理过的水配制),轻轻混匀。12 000 r/min 4℃离心10 min;吸尽上清;室温干燥沉淀2 min~ 5 min,加入 30 μ L~ 50 μL的无 RNase水溶解 RNA 沉淀。测定样品在260 nm/280 nm的吸收值确定RNA的质量。
1.4.2 反转录 每组份轻轻混匀,2 000 r/min离心20 s;取灭菌无核酸酶 0.2 mL PCR 管,依次加 入 2 μ g~ 5 μ g RNA 、Oligo dT(18)(10 μ mol/L)1 μ L、dNTPs(10 mmol/L)1 μ L 、无核 酸酶的双蒸水至总体积 15.5 μ L;65℃保温5 min,冰浴5 min;依次加入 RNase抑制剂 0.5 μ L、10×逆转录酶(AMV)Reaction Buffer 2 μ L、DTT 1μ L、AMV 1μ L,轻轻混匀后,2 000 r/min 离心20 s;37℃保温1 h,70℃保温15 min。
1.4.3 实时荧光PCR过程 一个样本做3个复孔,用Eppendorf移液器移至AXygen96孔板中;反应体系为2X的RTmix 12.5μ L,模板(cDNA 稀释 10 倍)1 μ L,引物 F 和 R 5 pmol/μ L mix 1 μ L,18.2 mΩ水 10.5 μ L,Total 25 μ L;PCR 程序为 95 ℃5 min,45cycle,94℃15 s,60℃30 s,95℃1 min,55℃1 min。
1.4.4 引物序列 AdipoR1:5'TGGGGAAAAAATTATGAACTGG 3',3'ACCCCTTT TTTAATACTTGACC 5';AdipoR2:5'AGTGATCCCTCATGATGTGCTG 3',3'TCACTAGGGAGTACTACACGAC5';内 参:5'GCAGAAGGAGATCACAGCCCT 3',3'CGTCTTCCTCTAGTGACGGGA 5'。
表1 各组干预前后大鼠血脂水平(±s) mmol/L
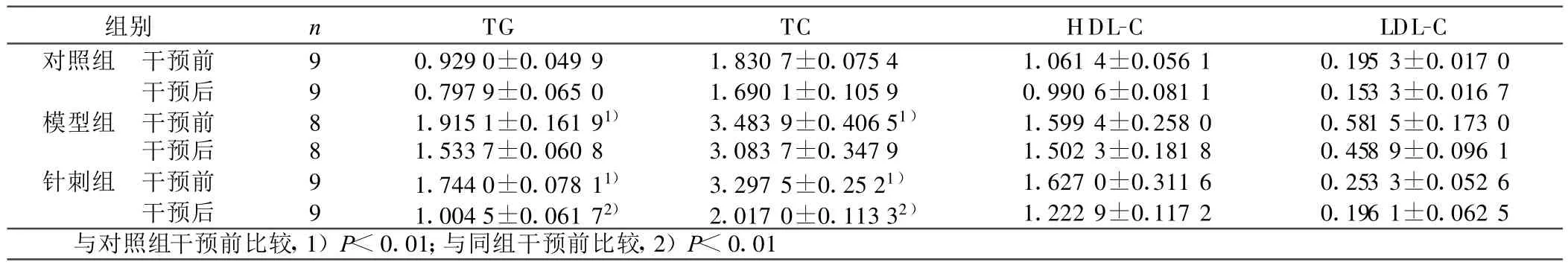
表1 各组干预前后大鼠血脂水平(±s) mmol/L
组别 n TG TC HDL-C LDL-C对照组 干预前 9 0.929 0±0.049 9 1.830 7±0.075 4 1.061 4±0.056 1 0.195 3±0.017 0干预后 9 0.797 9±0.065 0 1.690 1±0.105 9 0.990 6±0.081 1 0.153 3±0.016 7模型组 干预前 8 1.915 1±0.161 91) 3.483 9±0.406 51) 1.599 4±0.258 0 0.581 5±0.173 0干预后 8 1.533 7±0.060 8 3.083 7±0.347 9 1.502 3±0.181 8 0.458 9±0.096 1针刺组 干预前 9 1.744 0±0.078 11) 3.297 5±0.25 21) 1.627 0±0.311 6 0.253 3±0.052 6干预后 9 1.004 5±0.061 72) 2.017 0±0.113 32) 1.222 9±0.117 2 0.196 1±0.062 5与对照组干预前比较,1)P<0.01;与同组干预前比较,2)P<0.01
2.2 针刺对血清NO和MPO的影响(见表2) 干预前,模型组和针刺组NO明显低于对照组(P<0.01),M PO明显高于对照组(P<0.05或P<0.01),模型组和针刺组之间差异无统计学意义(P>0.05)。针刺后NO较前明显增加,M PO较前明显下降(P<0.01),模型组干预前后比较差异无统计学意义(P>0.05)。
表2 干预前后各组大鼠血清NO和MPO活力(±s)
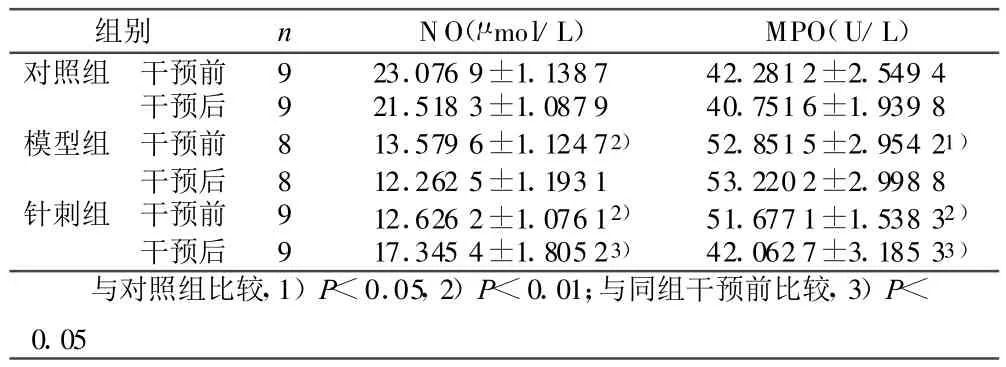
表2 干预前后各组大鼠血清NO和MPO活力(±s)
组别 n NO(μ mol/L) MPO(U/L)对照组 干预前 9 23.076 9±1.138 7 42.281 2±2.549 4干预后 9 21.518 3±1.087 9 40.751 6±1.939 8模型组 干预前 8 13.579 6±1.124 72) 52.851 5±2.954 21)干预后 8 12.262 5±1.193 1 53.220 2±2.998 8针刺组 干预前 9 12.626 2±1.076 12) 51.677 1±1.538 32)干预后 9 17.345 4±1.805 23) 42.062 7±3.185 33)与对照组比较,1)P<0.05,2)P<0.01;与同组干预前比较,3)P<0.05
2.3 针刺对主动脉AdipoR1和AdipoR2基因表达的影响(见表3) 针刺组、模型组AdipoR1、AdipoR2相对值低于对照组(P<0.05或P<0.01);针刺组AdipoR2相对值高于模型组(P<0.05)。
表3 干预后各组大鼠主动脉AdipoR1和Adipo R2基因表达(±s)

表3 干预后各组大鼠主动脉AdipoR1和Adipo R2基因表达(±s)
组别 AdipoR1 mRNA AdipoR2 mRNA对照组 0.238 9±0.015 0 0.309 0±0.010 9模型组 0.060 8±0.001 31) 0.114 8±0.015 82)针刺组 0.088 6±0.014 52) 0.238 5±0.029 21)3)与对照组比较,1)P<0.05,2)P<0.01;与模型组比较,3)P<0.05
3 讨 论
APN是联系腹内肥胖、代谢综合征和心血管疾病的枢纽,同时也是脂肪细胞-血管调节轴上起关键作用的激素,与心血管疾病的发生发展密切相关。APN能够抗血管生成[9]、抑制内皮炎症反应和平滑肌细胞增殖[6],具有直接抗动脉硬化作用。目前对APN信号的研究是个热点问题。AdipoR有AdipoR1和AdipoR2两个亚型[10],两者均为有7个跨膜区域的膜蛋白,有着相似的分子结构。AdipoR1是球形APN的高亲和力受体,对于骨骼肌的长形APN亲和力低,AdipoR2是肝脏球形和长形高分子量APN的中等亲和力受体。在结扎冠状动脉左前降支所致心肌缺血的小鼠模型中,梗死区和梗死边缘区左心室肌AdipoR1 mRNA和蛋白表达均明显降低[11],AdipoR2表达无明显变化。PPAR α和 PPARγ激动剂可上调 3T3-L1脂肪细胞和参与动脉粥样硬化形成的单核巨噬细胞的AdipoR2表达,对AdipoR 1表达无影响[12,13]。在非酒精性脂肪肝患者肝脏AdipoR2 mRNA水平显著下调,AdipoR1 mRNA表达无明显变化[14]。
疾病过程中AdipoR含量上调或下调及其活化状态改变均可以引起细胞对APN的敏感性变化,从而影响细胞的代谢及功能,成为促进疾病发生与发展的重要机制之一。本研究显示,高脂饮食饲养12周后,SD大鼠TG和TC明显升高,发生了高脂血症,血清中NO明显降低,MPO明显升高,血中NO浓度通常作为血管NO水平的标志[15],本实验结果说明高脂大鼠机体氧化应激增强,血管功能受损;氧化应激是高脂造成血管内皮损伤的一个重要机制,APN对氧化应激具有抑制作用[16],反之,氧化应激亦可抑制APN表达。干预4周后,模型组大鼠主动脉AdipoR1和AdipoR2的基因表达明显低于对照组,说明高脂饮食诱导的高脂血症大鼠主动脉APN信号受损,APN对主动脉的良性作用减弱;与模型组比较,针刺组大鼠TG、TC和MPO明显降低,血清NO增加,主动脉AdipoR2基因表达明显上调,AdipoR1基因表达无明显变化,说明针刺具有一定的降血脂作用,与众多文献报道相符,同时针刺对于高脂机体血管功能的改善有一定的影响。此作用可能是通过针刺增加了主动脉的APN信号实现的,针刺对主动脉APN作用的改善可能是通过AdipoR2介导的。
[1]Scherer PE.Adipose tissue:From lipid sto rage compartment to endocrine organ[J].Diabetes,2006,55(6):1537-1545.
[2]Goldstein BJ,Scalia R.Adipokines and vascular disease in diabetes[J].Curr Diab Rep,2007,7(1):25-33.
[3]Chen H,M ontagnani M,Funahashi T,etal.Adiponectin stimulates production of nitric oxide in vascular endothelial cells[J].J Biol Chem,2003,278(4):45021-45026.
[4]Kumada M,Kihara S,Ouchi N,et al.Adiponectin specifically increased tissue inhibitor of metalloproteinase-1 through interleukin-10 expression in human macrophages[J].Circulation,2004,109(17):2046-2049.
[5]Funahashi T,Nakamura T,Shimomura I,et al.Role of adipocytokines on the pathogenesis of atherosclerosis in visceral obesity[J].Intern Med,1999,38(2):202-206.
[6]Ouchi N,Kihara S,Arita Y,et al.Adipocyte-derived plasma protein,adiponectin,suppresses lipid accumulation and class:A scavenger receptor expression in human monocyte-derived macrophages[J].Circulation,2001,103(8):1057-1063.
[7]Arita Y,Kihara S,Ouchi N,etal.Adipocyte-derived plasma protein adiponectin acts as a platelet-derived g rowth facto r-BB-binding protein and regulates g rowth factor-induced common postreceptor signal in vascular smooth muscle cell[J].Circulation,2002,105(24):2893-2898.
[8]Kobayashi H,Ouchi N,Kihara S,et al.Selective suppression of endothelial cell apoptosis by the high molecular weight form of adiponectin[J].Circ Res,2004,94(4):e27-e31.
[9]Brakenhielm E,Veitonmaki N,Cao R,et al.Adiponectin-induced antiangiogenesis and antitumor activity involve caspase-mediated endothelial cell apoptosis[J].P roc Natl A cad Sci USA,2004,101(8):2476-2481.
[10]Yamauchi T,Kamon J,Ito Y,et al.Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J].Nature,2003,423(6941):762-769.
[11]Saito Y,Fujioka D,Kawabata K,et al.Statin reverses reduction of adiponectin receptor expression in infarcted heart and in T NF-alpha-treated cardiomyocytes in association with improved g lucose uptake[J].Am J Phy siol Heart Circ Physiol,2007,293(6):3490-3497.
[12]T suchida A,Yamauchi T,T akekawa S,et al.Peroxisome proliferator-activated receptor(PPAR)alpha activation increases adiponectin receptors and reduces obesity-related inflammation in adipose tissue:comparison of activation of PPARalpha,PPARgamma,and their combination[J].Diabetes,2005,54(12):3358-3370.
[13]Chinetti G,Zawadski C,F ruchart JC,et al.Expression of adiponectin recepto rs in human macrophages and regulation by agonists of the nuclear receptors PPARalpha,PPA Rgamma,and LXR[J].Biochem Biophys Res Commun,2004,314(1):151-158.
[14]Kaser S,Moschen A,Cayon A,et al.Adiponectin and its receptors in non-alcoholic steatohepatitis[J].Gut,2005,54(1):117-121.
[15]Le Melledo JM,Mahil N,Baker GB,et al.Nitric oxide:A key player in the relation between cardiovascular disease and major depressive disorder[J].J Psychiatry Neurosci,2004,29(6):414-416.
[16]Lee CC,Kasa Vubu JZ,Supiano M A.Androgenicity and obesity are independently associated with insulin sensitivity in postmenopausal women[J].Metabolism,2004,53(4):507-512.
