淫羊藿总黄酮对高脂血症大鼠血清NO、MPO的影响1)
2010-09-13郭郡浩董晓蕾蔡佳宇赵智明
蔡 辉,郭郡浩,董晓蕾,蔡佳宇,赵智明
高胆固醇血症和高三酰甘油血症诱导内皮损伤,最终导致动脉粥样硬化(AS)形成,其高三酰甘油血症引起血管损伤主要由于一氧化氮(NO)的生物利用度下降,出现氧化应激[1],损伤内皮细胞,加剧AS的炎性反应,激活转录因子κ B。髓过氧化物酶(MPO)水平与中性粒细胞激活程度之间存在极显著的相关性,是中性粒细胞的活化标志物,调节NO对血管信号传递和舒张的作用,直接改变血管的炎症反应性[2]。淫羊藿总黄酮为黄铜类化合物,其主要生物活性成分可改善内皮细胞、抗氧化等功能[3],对心血管系统存在潜在保护作用。本文就淫羊藿总黄酮减轻主动脉内皮氧化应激、炎症损伤的作用进行研究。
1 材料与方法
1.1 实验动物和分组 实验动物为刚断乳的SD雄性大鼠35只,平均体重60 g左右,由南京军区南京总医院动物实验中心提供,实验动物使用许可证号SYXK(苏)2003-0032;淫羊藿总黄酮由南京泽朗医药公司合成。
所有大鼠适应喂养1周,根据体重随机分为配方高脂饲料(鱼粉3%、猪油12%、白蔗糖 5%、鸡蛋 10%、胆固醇 2%、胆酸盐0.5%、甲基硫氧嘧啶0.2%和67.3%基础饲料)组(26只)和普通饲料组(对照组,9只),高脂饮食组进食量控制在15 g/100(g◦d),第12周末从大鼠眶后静脉抽血检测血脂以确定模型是否复制成功。再将高脂饮食组大鼠根据体重随机分为模型组(8只)和高脂饮食加100 mg/kg淫羊藿总黄酮组(低剂量淫羊藿总黄酮组,9只)、高脂饮食+200 mg/kg淫羊藿总黄酮组(高剂量淫羊藿总黄酮组,9只)。12周后给予连续灌胃,干预4周。对照组和模型组予相应溶剂灌胃,均灌胃4周。药物干预4周后处死大鼠。实验结束后,禁食24 h,于次日08:00时,用20%氯胺酮,以1 mL/100 g剂量麻醉后,剪开胸腹腔,暴露心脏,左心室穿刺取血5 mL,室温静置1 h后,3 000 r/min离心5 min,分离血清置-20℃冰箱保存,待测血清指标;于冰盘中分离主动脉,置液氮中保存待测其他指标。
1.2 检测指标和方法
1.2.1 血脂和生化指标检测 三酰甘油(TG)用TPO-PAP法,总胆固醇(TC)用CHOD-PAP法,高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)用选择性沉淀法,NO用硝酸还原法,MPO用邻连茴香胺法,严格按试剂盒说明进行操作,试剂盒均由南京建成生物工程研究所提供。
1.2.2 主动脉病理检测 大鼠主动脉弓与胸主动脉交界处取材,10%中性甲醛固定,石蜡包埋,水平横切面制备石蜡切片,厚度4 μ m,苏木素伊红(HE)染色,100倍光镜下观察。
1.3 统计学处理 多组资料组间比较用单因素方差分析,方差齐性用LSD,方差不齐用Dunnett T3。并统计正态性,统计软件用SPSS13.0。统计变量以均数±标准差±s)表示。
2 结 果
2.1 主动脉病理 组织病理学改变光镜下,对照组血管壁结构清晰、内皮细胞完整无脱落,内膜薄,中层平滑肌层均匀、厚度正常,外层为疏松结缔组织;高脂饮食组血管内皮细胞部分脱落,内膜增厚,血管壁向管腔内突出,可见中膜平滑肌增生、排列紊乱。而淫羊藿总黄酮小剂量组可见内膜轻度增厚,未见明显平滑肌增生。淫羊藿总黄酮大剂量组干预组没有明显的病理改变。
2.2 各组血脂水平 造模后12周后高脂饮食组 TG、TC、LDL-C较对照组明显升高(P<0.05)。经淫羊藿总黄酮干预后16周末,模型组TG、TC较对照组明显升高(P<0.01),淫羊藿总黄酮组 TG、TC较模型组显著下降(P<0.05或P<0.01),淫羊藿总黄酮大剂量组较小剂量组有明显升高趋势;HDL-C各组未见明显差异(P>0.05),但淫羊藿总黄酮干预组有升高趋势;LDLC各组比较差异无统计学意义。详见表1、表2。
表1 干预前第12周各组血脂比较(±s) mmol/L
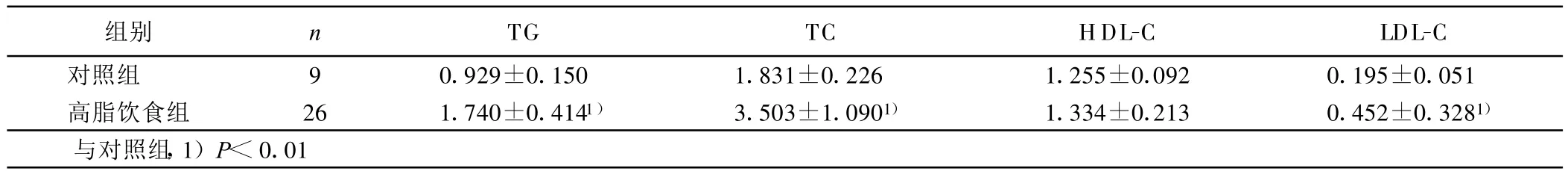
表1 干预前第12周各组血脂比较(±s) mmol/L
组别 n TG TC HDL-C LDL-C对照组 9 0.929±0.150 1.831±0.226 1.255±0.092 0.195±0.051高脂饮食组 26 1.740±0.4141) 3.503±1.0901) 1.334±0.213 0.452±0.3281)与对照组,1)P<0.01
表2 各组干预后各组血脂比较(±s)mmol/L
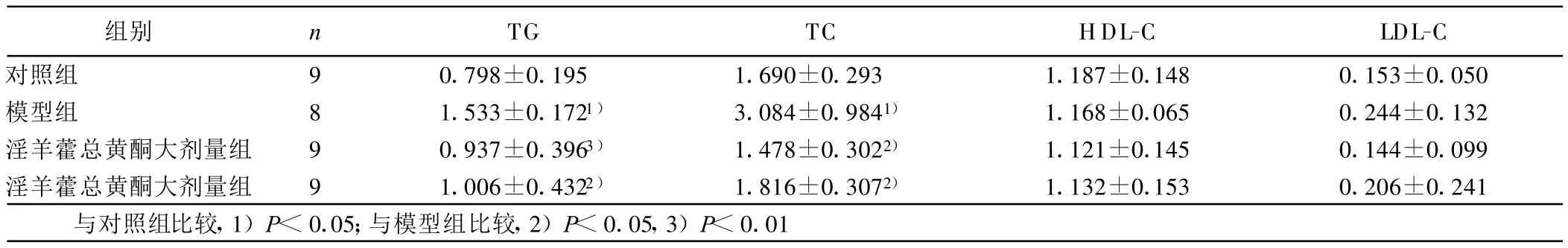
表2 各组干预后各组血脂比较(±s)mmol/L
组别 n TG TC HDL-C LDL-C对照组 9 0.798±0.195 1.690±0.293 1.187±0.148 0.153±0.050模型组 8 1.533±0.1721) 3.084±0.9841) 1.168±0.065 0.244±0.132淫羊藿总黄酮大剂量组 9 0.937±0.3963) 1.478±0.3022) 1.121±0.145 0.144±0.099淫羊藿总黄酮大剂量组 9 1.006±0.4322) 1.816±0.3072) 1.132±0.153 0.206±0.241与对照组比较,1)P<0.05;与模型组比较,2)P<0.05,3)P<0.01
2.3 血清NO和MPO 模型组血清NO显著低于对照组和淫羊藿总黄酮组(P<0.05或P<0.01),淫羊藿总黄酮大剂量组较小剂量组有升高趋势;模型组血清M PO明显高于对照组(P<0.01),淫羊藿总黄酮组较模型组明显下降(P<0.01),其中大剂量组下降趋势明显(P<0.05)。详见表3。
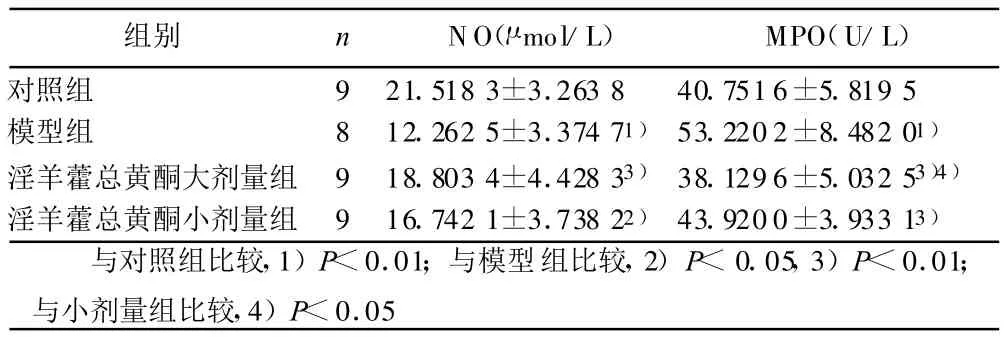
表3 干预后第16周各组血清NO含量和MPO活力
3 讨 论
动脉粥样硬化性疾病是一个全球范围内的严重健康问题。高脂饮食为动脉粥样硬化独立危险因素,高脂饮食可增加的血浆胆固醇及低密度脂蛋白,对血管内膜进行功能性损伤,并加速动脉粥样硬化形成[4]。高脂血症不仅是动脉粥样硬化的促发因素,而且贯穿其发生、发展的过程当中[5]。本研究通过高脂饮食造成高脂血症大鼠,模型组TG、TC、LDL较对照组明显升高,主动脉内膜HE染色显示内皮细胞脱落、断裂,平滑肌层增生。通过高脂饮食可诱导高脂血脂大鼠并出现主动脉内皮损伤。给予淫羊藿总黄酮干预后 TG、TC较模型组下降,HDL有所升高,可降低LDL,但无统计学意义。与文献报道相符[6]。长期高脂饮食情况下增加的脂蛋白特别是氧化低密度脂蛋白(ox-LDL)和胆固醇对动脉内膜造成功能性损伤,亦包括氧化应激损伤,氧化应激参与脂质氧化损伤动脉内膜[7]。高脂血症状态下,血管内皮中的巨噬细胞、炎性细胞聚集所释放的超氧阴离子可加速 NO降解,影响 L-精氨酸转化为 L-胍氨酸,使 NO生成减少,内皮依赖性舒张功能调节失衡,血管张力增加,结构重建,内皮损伤。增加血管内皮NO合成能力,提高NO介导的血管内皮依赖性舒张功能,来达到改善高脂血症之血管内皮舒张功能障碍。在高胆固醇血症大鼠L-精氨酸可抑制内皮细胞凋亡,可改善内皮细胞功能,抵抗动脉粥样硬化进展[8]。本研究发现,模型组NO水平较对照组明显下降,并且病理同时提示内皮损伤较明显,说明NO在维持内皮细胞完整性有着重要作用。本实验进一步证明通过提高血清NO水平可改善内皮功能。
MPO为血红素过氧化物酶超家族成员之一,是氧化应激的一个主要标志物。M PO水平与中性粒细胞激活程度之间存在极显著的相关性,是中性粒细胞的活化标志物,MPO还可以通过细胞信号通路将活化信号由胞浆传递至胞核内,诱导炎症相关基因的表达,上调机体炎症反应,促进炎症效应细胞的增殖与活化,使效应细胞更易于穿越内皮屏障到达局部炎症组织[2,9],易损斑块形成的各个阶段均与MPO有关,是预测斑块易损性的炎性标志物。MPO催化过氧化氢和氯离子生成次氯酸,使LDL-C氧化成为ox-LDL,启动 AS的发生,同时,M PO促进HDL-C的氧化,影响其胆固醇的逆向转运作用,参与AS的发生、发展。当白细胞激活及脱颗粒时,M PO被分泌到血管腔,结合到内皮细胞,随后跨细胞运动到内皮下基质,浸润血管组织,直接消耗NO,从而影响NO信号传导,使血管内皮舒张功能受损[10]。本研究中发现,模型组MPO较正常组明显增高,NO明显下降,说明MPO可能存在通过消耗NO,加重血管内皮细胞损伤。吡格列酮组干预4周后相比模型组M PO明显下降,其内皮相对高脂未见明显损伤,内皮比较完整,淫羊藿总黄酮改善内皮细胞功能,抗氧化应激,可能与升高NO,降低MPO有关,其详细机制尚不明确有待进一步研究。
动脉粥样硬化形成早期与血脂、炎症、氧化应激、血小板活化、血栓形成密切相关。淫羊藿总黄酮抗炎、抗氧化应激可能与TG、TC降低、NO升高、MPO降低有关。
[1]Bartus M,Lomnicka M,Lorkowska B,et al.Hypertriglyceridemia but not hypercholesterolemia induces endothelial dy sfunction in the rat[J].Pharmacol Rep,2005,57:127-137.
[2]Eiserich JP,Baldus S,Brennan M L,et al.Myeloperoxidase,a leukocyte-derived vascular NO oxidase[J].Science,2002,296(5577):2391-2394.
[3]Xu HB,Huang ZQ.Vasorelaxant effects of icariin on isolated canine coronary artery[J].J Cardiovasc Pharmacol,2007,49(4):207-213.
[4]Hanefeld M.The role of pioglitazone in modifying the atherogenic lipoprotein profile[J].Diabetes Obes Metab,2009,11(8):742-756.
[5]Blann AD,Seigneur M,Steiner M,et al.Circulating ICAM-1 and VCAM-1 in peripheral artery disease and hy percholesterolaemia relationship to the location of atherosclerotic disease,smoking,and in the prediction of adverse events[J].Thromb Haemost,1998,79(6):1080-1085.
[6]王茜,林焕冰,程玉芳,等.淫羊藿苷对高脂血症大鼠粘附分子基因表达的影响[J].中国动脉硬化杂志,2008,16(1):4-6.
[7]Victor VM,Rocha M,Sola E,et al.Oxidative stress,endothelial dysfunction and atherosclerosis[J].Curr Pharm Des,2009,15(26):2988-3002.
[8]Nematbakhsh M,Haghjooyjavanmard S,Mahmoodi F,et al.The prevention of endothelial dysfunction through endothelial cell apoptosis inhibition in a hy percholesterolemic rabbit model:The effect of L-arginine supplementation[J].Lipids Health Dis,2008,7:27.
[9]Wong ND,G ransar H,Narula J,et al.Myeloperoxidase,subclinical atherosclerosis,and cardiovascular disease events[J].JACC Cardiovasc Imaging,2009,2(9):1093-1099.
[10]Lau D,Baldus S.Myeloperoxidase and its contributory role in inflammatory vascular disease[J].Pharmacol T her,2006,111(1):16-26.
