2种佐米曲普坦制剂的人体生物等效性研究
2010-09-11韩中刚贵州遵义市人民医院药剂科遵义市563000
韩中刚(贵州遵义市人民医院药剂科,遵义市 563000)
佐米曲普坦(Zolmitriptan)系一种选择性5-HTIB/ID受体激动药,通过激动颅内血管和三叉神经系统交感神经上的5-HTIB/ID受体,引起颅内血管收缩并抑制前炎症神经肽的释放,临床上适用于成人伴或不伴先兆症状的急性偏头痛的治疗。为评价重庆凯林制药有限公司研制的佐米曲普坦分散片在健康男性受试者的药动学特征及其与市售佐米曲普坦片是否等效,笔者建立了可靠的血药浓度测定方法,并对国产分散片和市售普通片的药动学及生物等效性进行了研究。
1 材料
1.1 仪器
高效液相色谱仪,包括LC-10泵系统、SPD-10A型可调波长紫外检测器和C-R7Ae plus积分仪(日本岛津公司);电子天平(1/10万)(德国Sartorius公司);VXH-3微型旋涡混合器(上海跃进医疗器械厂);KDC型电子可控沉淀器(广东合诚无线电厂)。
1.2 试药
受试制剂:佐米曲普坦分散片(重庆凯林制药有限公司,规格:每片2.5 mg,批号:20051101,含量:97.6%);参比制剂:佐米曲普坦片(成都天台山制药有限公司,规格:每片2.5 mg,批号:050601,批准文号:国药准字H20050072);佐米曲普坦对照品(重庆凯林制药有限公司,纯度:99.8%);内标:替硝唑对照品(重庆华邦制药股份有限公司,纯度:99.61%,批号:020304);甲醇、磷酸二氢钠、磷酸等均为分析纯,乙腈、二氯甲烷为色谱纯,水为三重蒸馏水。
2 方法与结果
2.1 色谱条件[1]
色谱柱:Hypersil C18(200 mm×5.0 mm,5 μm),预柱;固定进样环:50 µL;流动相:乙腈∶磷酸盐缓冲液(0.05 moL·L-1磷酸二氢纳,用磷酸调节pH值至5.0)=15∶85;流速:1.2 mL·min-1;紫外检测波长:223 nm;柱温:室温;内标:替硝唑。
2.2 受试者选择
18例中国健康男性志愿者,汉族,年龄(22.1±3.0)岁,体质量(59.2±6.6)kg,身高(171.0±5.1)cm。试验前全面体格检查证实为健康者,无药物过敏史。受试前2周内未服过任何药物。受试者了解受试须知后,签署知情同意书。本试验方案经贵州遵义市人民医院医学伦理委员会批准通过。
2.3 给药方法及血样采集
采用随机交叉试验设计,单剂量口服给药。将18名受试者随机分为A、B组,每组9名,在Ⅰ、Ⅱ阶段分别交叉服药,交叉服药前经1周清洗期。试验前禁食12 h后,于次日晨8∶00时空腹吞服受试制剂或参比制剂10 mg(200 mL温开水送服)。服药当日统一进标准餐。受试期间禁止剧烈活动、吸烟、饮酒及含酒精、咖啡因类饮料,且禁止使用一切非试验药物,并由医护人员进行健康监护。采集服药后0.17、0.33、0.67、1.0、1.5、2.0、2.5、3.0、4.0、6.0、8.0、10.0 h静脉血3.0 mL,分离血浆,低温保存(-20℃),及时测定。间隔1周后交换口服另一种制剂,同法采取静脉血。
2.4 标准溶液的制备
准确称取佐米曲普坦对照品9.2 mg,用适量甲醇溶解,置于25 mL容量瓶中,加甲醇至刻度,混匀,即为368 µg·mL-1的佐米曲普坦标准贮备液,使用时用甲醇将该标准贮备液稀释为736 ng·mL-1的工作浓度。精密量取替硝唑对照品29.3 mg,用适量甲醇溶解,置于50 mL容量瓶中,加甲醇至刻度,混匀,即为586µg·mL-1的替硝唑标准贮备液,使用时用甲醇将该标准贮备液稀释为1 172 ng·mL-1的工作浓度。
2.5 血浆样品处理[1]
取受试者血浆1.0 mL,加内标溶液(1 172 ng·mL-1替硝唑溶液)100µL,加0.2 mol·L-1碳酸钠 0.1 mL,加二氯甲烷4 mL,涡旋振摇1 min,3 000 r·min-1离心2 min,取有机层置于40℃水浴用氮气吹干,用流动相100µL复溶,进样50µL,记录色谱。
2.6 色谱行为
在本试验所采用的色谱条件下,血浆中佐米曲普坦、替硝唑的相对保留时间分别约为4.5、6.5 min。佐米曲普坦与内标峰形良好,且不受血浆中内源性物质的干扰。高效液相色谱图见图1。
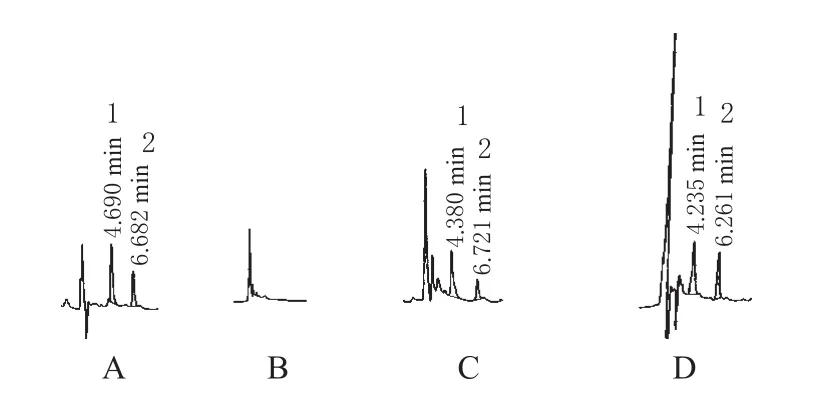
图1 高效液相色谱图Fig 1HPLC Chromatogram
2.7 标准曲线的制备与最低检测浓度
在空白血浆中分别添加佐米曲普坦对照品,使血药浓度相当于73.6、36.8、18.4、9.2、4.6、2.3、1.15 µg·L-1,按“2.5”项下方法进行处理并测定,记录色谱。以佐米曲普坦峰面积/替硝唑峰面积(Y)对佐米曲普坦血药浓度(X)进行线性回归,得标准曲线方程为Y=0.090 48X-0.029 42(r=0.999 8)。结果表明,佐米曲普坦血药浓度在1.15~73.6 ng·mL-1范围内线性关系良好。最低检测浓度1.15 ng·mL-1(n=5,RSD=10.83%)[2]。
2.8 回收率及精密度试验
于空白血浆中加入高、中、低(73.60、18.40、1.15 ng·mL-1)3种浓度的佐米曲普坦标准溶液,以评价本法测定血浆中佐米曲普坦含量的回收率及日内、日间RSD。回收率及精密度试验结果见表1。
表1 回收率及精密度试验结果(±s,n=5)Tab 1Results of recovery and precision tes(t±s,n=5)

表1 回收率及精密度试验结果(±s,n=5)Tab 1Results of recovery and precision tes(t±s,n=5)
加入浓度/ng·mL-1 1.15 18.40 73.60测得浓度/ng·mL-1回收率/%±s/%94.61±8.00 102.99±2.29 98.94±1.82 x 23452345 1 1.22 19.35 72.51 1.11 18.68 73.62 1.00 19.24 73.40 1.00 19.13 70.63 1.11 18.35 73.95 1 106.09 105.16 98.52 96.52 101.52 100.03 86.96 104.56 99.73 86.96 103.97 95.96 96.52 99.73 100.48日内测得量/ng·mL-1 1.00±0.17 18.60±0.32 71.78±1.14日内RSD/%17.00 1.72 1.59日间测得量/ng·mL-1 1.02±0.14 18.83±0.39 72.67±1.35日间RSD/%13.72 2.07 1.86
2.9 稳定性试验
2.9.1 常温稳定性:将佐米曲普坦和替硝唑混合标准溶液室温放置,于0、18、36、52、72 h时进行测定,测得佐米曲普坦浓度分别为11.72、11.06、11.39、11.06、11.06 ng·mL-1,测定结果为(11.26±0.30)ng·mL-1,RSD=2.67%,表明混合标准溶液室温放置72 h稳定性良好。
2.9.2 冻融稳定性:将含药血浆反复冷冻(-20℃)、融化,按“2.5”项下方法处理后测定,4 d内测定5次,测得佐米曲普坦浓度分别为6.97、6.86、6.64、6.75、7.19 ng·mL-1,测定结果为(6.88±0.21)ng·mL-1,RSD=3.05%,表明血浆样品4 d内反复冻融稳定性良好。
2.10 单剂量相对生物利用度
2.10.1 药-时曲线:18名健康受试者单剂量口服2种佐米曲普坦制剂10 mg后的平均药-时曲线见图2。
2.10.2 药动学参数:采用3p97计算机软件(中国数学药理学会),计算各个体的药动学参数,Cmax、tmax以实测值计算,AUC按梯形面积法计算。采用各受试者的佐米曲普坦受试制剂与参比制剂的AUC0~t分别计算相对生物利用度(F),结果表明,
一室血管外给药模型较佳。有关药动学参数见表2。
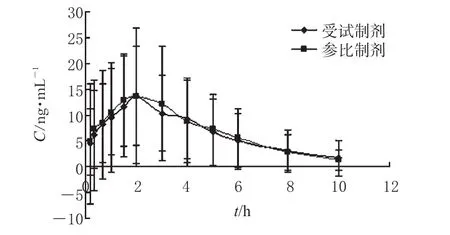
图2 18名健康受试者单剂量口服2种佐米曲普坦制剂10 mg后的平均药-时曲线Fig 2 Mean plasma concentration-time curves of zolmitriptan in 18 volunteers after a single oral administration of 10 mg zolmitriptan agents
2.11 生物等效性评价
用双单侧t检验分析2种制剂的Cmax和AUC0~10,高、低侧t检验均有显著性差异(P<0.05),(1-2α)置信区间分别为86.7%~116.2%和96.7%~108.0%,表明2种制剂的Cmax和AUC0~10均生物等效(α=0.05)。tmax用非参数(Wilcoxon法)进行统计分析,2种制剂间无显著性差异(P>0.05)。以上结果表明2种制剂具有生物等效性。
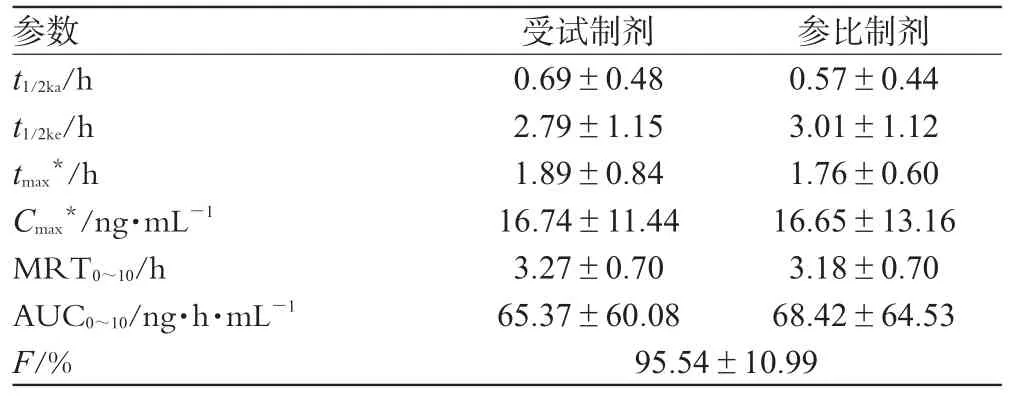
表2 18名健康受试者单剂量口服2种佐米曲普坦制剂10 mg后的药动学参数比较(n=18)Tab 2 Comparison of pharmacokinetic parameters of zolmitriptan in 18 volunteers after a single oral administration of 10 mg zolmitriptan agents(n=18)
2.12 不良反应监测结果
在临床试验中,第Ⅰ周期口服受试制剂或参比制剂后0.5~1 h,多数受试者有头痛症状(15人);此外有极少部分受试者自感乏力、颈肩部酸痛、发热、口干、恶心、头昏等症状(各种症状分别为1~3人),但均能耐受,平卧休息后即好转。
在第Ⅱ周期口服受试制剂或参比制剂后,同样是以头痛(13人)及颈肩部酸痛、口干、发热等症状(各种症状分别为1~3人)为主,但均能耐受,自觉较第Ⅰ周期为轻,未予任何处理,休息后自行好转。
3 讨论
文献报道[3],本品长期服用耐受性好,24 h内最大用药量可达10 mg。虽然试验中大多数受试者均出现了不同程度的不良反应,但均能耐受,未经处理,峰浓度过后不良反应逐渐减轻或消失。
双单侧t检验是国际上判断生物等效性通用的一种统计学方法[4]。双单侧t检验是使用小概率原理,无效假设(H0)为2种药物不等效,备择假设(H1)为2种药物等效。在H0成立时,t1、t2服从自由度为n-2的t分布。查t临界值表,得到tα(n-2),如果t1、t2均大于相应的t临界值时(P<0.05),拒绝H0,接受H1,认为2种药物等效。
本研究中健康志愿者空腹口服佐米曲普坦受试制剂或参比制剂10 mg后,血浆中2种制剂的平均药物浓度与变化趋势相似,属一室药动学模型,于1.8 h左右达到血药浓度峰值,t1/2β分别为(2.79±1.15)和(3.01±1.13)h,在体内滞留时间较短。由图2和表2亦可见,2种佐米曲普坦制剂在人体内吸收、分布、消除较为接近,佐米曲普坦分散片的相对生物利用度为(95.54±10.99)%,可认为2种制剂生物等效。
[1]何海霞,蒙 华,周远大,等.液-液萃取RP-HPLC法测定人血浆中佐米曲普坦的浓度[J].药物分析杂志,2005,25(3):323.
[2]曾经泽.生物药物分析[M].第2版.北京:北京医科大学中国协和医科大学联合出版社,1998:230.
[3]Spencer CM,Gunasekara NS,Hills C.Zolmitriptan-a review of its use in migraine[J].Drugs,1999,58(2):347.
[4]余松林主编.医学统计学[M].北京:人民卫生出版社,2003:330.
