2种盐酸非索非那定制剂的人体生物等效性研究
2010-09-11王界永高署李见春董海军姜威石和鹏合肥合源医药科技有限公司合肥市0088北京福瑞康正医药技术研究所北京市0009扬子江药业集团北京海燕药业有限公司北京市006
王界永,高署,李见春,董海军,姜威,石和鹏(.合肥合源医药科技有限公司,合肥市0088;.北京福瑞康正医药技术研究所,北京市 0009;.扬子江药业集团北京海燕药业有限公司,北京市 006)
盐酸非索非那定是特非那定在人体的活性代谢产物,是组胺H1-受体拮抗药,无抗胆碱和抗肾上腺素受体作用,属于无镇静作用的第2代抗组胺药[1],用于治疗季节性过敏性鼻炎及慢性特发性荨麻疹,具有很好的临床治疗效果,且无催眠等中枢神经不良反应[2]。本研究建立了高效液相色谱-电喷雾串联质谱(LC-MS/MS)法测定健康人体内非索非那定的血药浓度,并以江苏恒瑞医药股份有限公司生产的盐酸非索非那定片为参比制剂,研究扬子江药业集团北京海燕药业有限公司生产的盐酸非索非那定口腔崩解片的人体相对生物利用度并评价其生物等效性。
1 材料
1.1 仪器
Finnigan TSQ Quantum Discovery Max型LC-MS/MS联用仪,包括ESI离子源、Xcalibur1.4数据处理系统(美国菲尼根质谱公司);XS105分析天平(瑞士梅特勒-托利多仪器有限公司);XW-80A微型旋涡混合仪(上海沪西分析仪器有限公司);TGL-16H平衡离心机(珠海黑马医学仪器有限公司);DZG-303A纯水机(台湾艾柯仪器厂)。
1.2 试药
盐酸非索非那定对照品(北京福瑞康正医药技术研究所,含量:99.8%);磷酸可待因对照品(中国药品生物制品检定所,批号:171203-200303);受试制剂:盐酸非索非那定口腔崩解片(扬子江药业集团北京海燕药业有限公司,规格:60 mg,批号:2007051501);参比制剂:盐酸非索非那定片(江苏恒瑞医药股份有限公司,规格:60 mg,批号:060905);甲醇、甲酸均为色谱纯;水为超纯水。
2 方法与结果
2.1 试验方案
选取20名健康男性志愿者,年龄19~24岁,体质量55~69 kg。无烟、酒嗜好,无神经系统、精神异常及代谢异常等病史,血尿常规、肝肾功能及心电图等检查均正常,身体状况良好。受试前2周至整个试验期间禁烟、酒和禁服其它任何药物。受试者均志愿签署知情同意书,试验方案经医学伦理委员会批准通过。采用按体质量随机交叉试验设计。受试者按随机原则分成2组,洗脱期为1周。20名受试者于清晨7∶00分别空腹口服受试制剂或参比制剂60 mg。受试制剂在受试者饮用200 mL温开水后置于舌上,溶解或崩解后借吞咽动作入胃;参比制剂用200 mL温开水送服。服药2 h后方可再饮水,4 h后统一进食清淡饮食。服药及取血期间均留在Ⅰ期临床病房观察。
2.2 血样采集
服药前取空白血,服药后分别于0.08、0.17、0.33、0.5、0.75、1、2、3、4、6、12、24、48、72 h时从志愿者肘静脉取血3 mL置抗凝管中,静置30 min,4 000 r·min-1离心,取血浆1 mL,-20 ℃冰箱贮存,用于血药浓度检测。
2.3 血样处理
精确量取血浆100 μL,加入740 ng·mL-1可待因内标液10 μL,涡旋30 s,加入甲醇300 μL,涡旋3 min,14 000 r·min-1离心10 min,取上清液,再次离心5 min,进样10 μL分析。
2.4 色谱及质谱条件
色谱柱:Synergi POLAR-80R(250 mm×4.6 mm,5 μm);流动相:甲醇∶水(含0.1%甲酸)=85∶15;流速:50 μL·min-1;柱温:30℃。
ESI离子源;喷雾电压:4.7 kV;毛细管温度:320℃;Skimmer offset:-8 V;鞘气压:35;辅助气压:4;正离子方式检测;扫描方式:选择反应监测(SRM);用于定量的非索非那定m/z:母离子502.5,子离子170.9,碰撞能40 V;内标可待因m/z:母离子300.1,子离子165.1,碰撞能38 V;扫描时间:0.5 s。
2.5 方法专属性
量取混合空白血浆100 μL,按“2.3”项下方法自“涡旋30 s”起操作,得色谱图1A;取688 ng·mL-1的盐酸非索非那定对照品溶液10 μL,加入空白血浆100 μL中,按“2.3”项下方法操作,得色谱图1B;取20号受试者第2周期口服受试制剂0.5 h后的血浆样品,按“2.3”项下方法操作,得色谱图1C。结果表明,非索非那定和内标可待因的保留时间分别约为4.4、3.3 min,空白血浆中内源性物质不干扰非索非那定和内标可待因的测定。
2.6 标准曲线的制备与定量下限考察
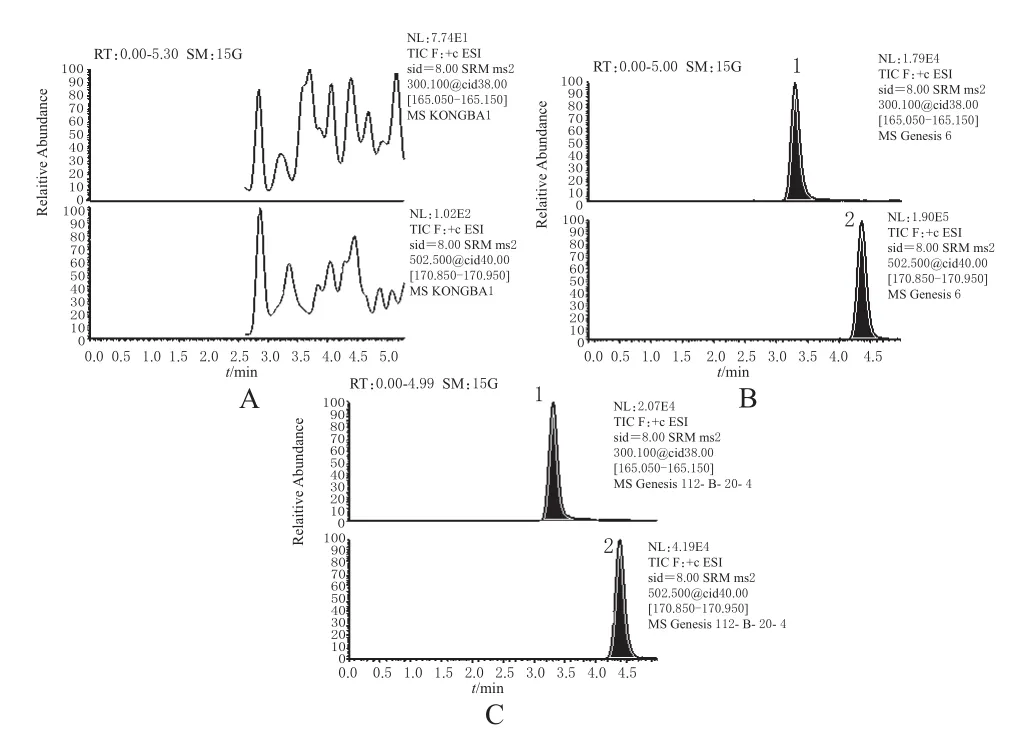
图1 液-质色谱图Fig 1HPLC-MS/MS chromatogram
精密量取不同浓度的非索非那定对照品溶液各10 μL,加入空白血浆100 μL,配制成非索非那定血药浓度分别为0.688、1.72、6.88、18、68.80、180、258 ng·mL-1的血浆样品,按“2.3”项下方法操作,记录待测物与内标的峰面积,以待测物浓度(Y)为纵坐标,待测物与内标的峰面积比值(X)为横坐标,用加权法(W=1/X2)进行回归运算,求得的直线回归方程为:Y=23.278X+0.246(r=0.998 0,n=3)。结果表明,非索非那定血药浓度在0.688~258 ng·mL-1范围内线性关系良好。血浆中非索非那定定量下限为0.688 ng·mL-1(S/N>10)。
2.7 提取回收率试验
取空白离心管,精密加入不同浓度的非索非那定对照品溶液各10 μL,再加入空白血浆100 μL,配制成非索非那定低、中、高(1.72、18、180 ng·mL-1)3种浓度的血浆样品各3份,按“2.3”项下方法操作,记录非索非那定药物峰面积As(H)与内标可待因峰面积Ai(H);另取离心管加入空白血浆100 μL,加入甲醇300 μL,涡旋3 min,14 000 r·min-1离心10 min,取上清液,加入不同浓度的非索非那定对照品溶液及内标溶液(740 ng·mL-1可待因)各10 μL,配制成相同浓度样品,进样10 μL分析,记录非索非那定药物峰面积As(D)和内标可待因峰面积Ai(D),每一浓度进行3样本分析,计算提取回收率(%)=As(H)/As(D)×100%,结果见表1。
表1 提取回收率及精密度试验结果(±s,n=3)Tab1The results of extraction recovery and precision tes(t±s,n=3)
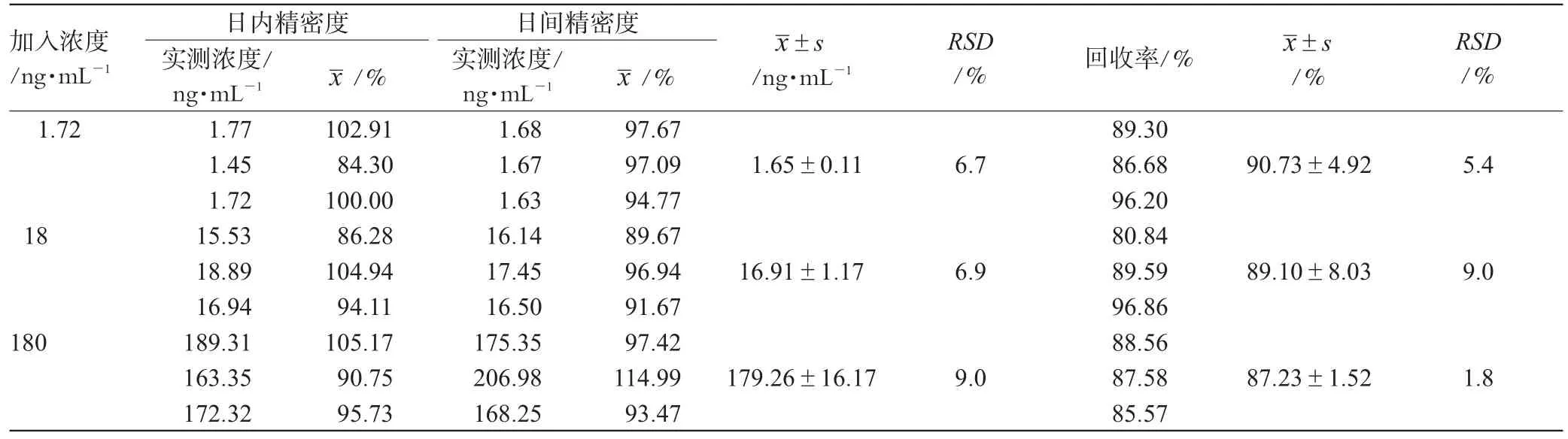
表1 提取回收率及精密度试验结果(±s,n=3)Tab1The results of extraction recovery and precision tes(t±s,n=3)
加入浓度/ng·mL-1 1.72±s/ng·mL-1日内精密度实测浓度/ng·mL-1 1.77 1.45 1.72 15.53 18.89 16.94 189.31 163.35 172.32 x/%102.91 84.30 100.00 86.28 104.94 94.11 105.17 90.75 95.73 x日间精密度实测浓度/ng·mL-1 1.68 1.67 1.63 16.14 17.45 16.50 175.35 206.98 168.25 x RSD/%回收率/%±s/%RSD/%1.65±0.11 18 6.790.73±4.925.4 16.91±1.17 180/%97.67 97.09 94.77 89.67 96.94 91.67 97.42 114.99 93.47 6.989.10±8.039.0 179.26±16.179.0 89.30 86.68 96.20 80.84 89.59 96.86 88.56 87.58 85.57 87.23±1.521.8
2.8 精密度试验
按“2.7”项下方法配制非索非那定低、中、高3种浓度的血浆样品,按“2.3”项下方法操作,每一浓度进行3样本分析,连续测定2 d,根据当日的标准曲线,计算血浆样品的浓度。结果日内和日间的RSD均小于15%,符合生物样本测定的要求,详见表1。
2.9 稳定性试验
按“2.7”项下方法配制非索非那定低、中、高3种浓度的血浆样品,共7份,每一份样品进行3样本分析。4份按“2.3”项下方法操作,在室温下放置0、4、8、23 h后进样分析,考察处理后的血浆样品在室温条件下的稳定性;1份在室温下放置9 h后,按“2.3”项下方法操作,考察药物在血浆中的室温稳定性;1份在-20℃冰箱反复冻融3次后,再按“2.3”项下方法操作,考察血浆样品反复冻融稳定性;1份在-20℃冰箱冷冻21 d后,按“2.3”项下方法操作,考察血浆样品长期冷冻稳定性。结果各稳定性RSD均小于15%,表明处理后的血浆样品中非索非那定及含药血浆样品在室温、反复冻融以及长期冷冻条件下的稳定性均较好。
2.10 药-时曲线
20名健康志愿者随机交叉口服60 mg盐酸非索非那定口腔崩解片和盐酸非索非那定片后,用LC-MS/MS法测得不同时间的非索非那定平均药-时曲线。20名受试者口服受试制剂与参比制剂60 mg后平均药-时曲线见图2。
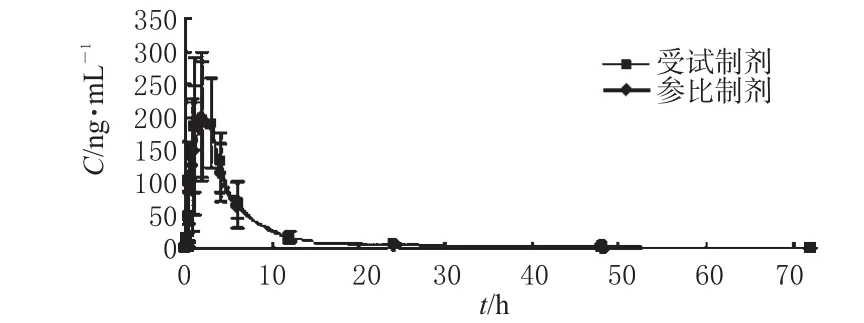
图2 20名受试者口服受试制剂与参比制剂60 mg后平均药-时曲线Fig 2 Mean concentration-time curves of fexofenadine in 20 healthy volunteers after oral administration of 60 mg test and reference tablets
2.11 药动学参数及生物等效性评价
本试验采用DAS ver 2.1软件计算单剂量给药后药动学参数AUC0~72、AUC0~∞和Cmax等。20名受试者口服受试制剂与参比制剂60 mg后药动学参数见表2。经对数转换后进行药物间、周期间、个体间的三因素方差分析,再以双向单侧t检验进行等效性判断。结果,盐酸非索非那定口腔崩解片AUC0~72和AUC0~∞的90%置信区间分别为93.2%~121.1%和93.2%~120.9%,均在80%~125%范围内;Cmax的90%置信区间为94.5%~113.0%,在70%~143%范围内。药物间、周期间、个体间方差分析结果显示,2种制剂在药物间和周期间差异无统计学意义(P>0.05),2种制剂在个体间差异有统计学意义(P<0.05)。tmax采用非参数检验进行统计,结果P>0.05,表明2种制剂在吸收程度和吸收速度上具有生物等效性。另根据公式:相对生物利用度(F)%=AUC0~t(受试制剂)/AUC0~t(参比制剂)×100%计算盐酸非索非那定口腔崩解片的相对生物利用度。结果F值为(112±36)%,在80%~125%内,符合相对生物利用度的要求。
3 讨论
本试验经过摸索确定了直接用甲醇沉淀去蛋白的LC-MS/MS法测定血浆中非索非那定的含量,表明该血样处理方法相对文献报道[3,4]具有操作更简便、重复性好、应用性更强的优势。

表2 20名受试者口服受试制剂与参比制剂60 mg后药动学参数Tab2 Pharmacokinetic parameters of fexofenadine in 20 healthy volunteers after oral administration of 60 mg test and reference tablets
口腔崩解片是根据口腔的生理解剖特点设计的一种特殊片剂,不用水或用极少量水就能在口腔内迅速崩解吸收,因而具有起效快、可以避免首关效应等很多优点,最主要的是服用方便,适用于有吞咽困难和老、幼年患者[5]。从本试验结果看,试验用盐酸非索非那定口腔崩解片在口腔内崩解时间短,仅(51.8±6.5)s,口感微甜。tmax差异虽然无统计学意义,但盐酸非索非那定口腔崩解片的tmax比普通片小,表明盐酸非索非那定口腔崩解片具有吸收快的优势。盐酸非索非那定口腔崩解片相对普通片的生物利用度为(112±36)%,可能与盐酸非索非那定口腔崩解片相对普通片具有无肝脏首关效应的优势有关,但这仍有待进一步试验确定。
本试验健康成人口服60 mg受试制剂或参比制剂后,主要药动学参数与文献[4,6]报道接近。试验统计结果表明,盐酸非索非那定口腔崩解片与普通片具有生物等效性。
[1]Borade PS,Ballary CC,Currie GP,et al.Modern H1-antihistamines in asthma[J].Drug Discovery Today,2006,3(3):253.
[2]Sun J,Lu R,Fan XW,et al.The important roles of transpoter protein in drug delivery[J].Chin Pharm J,2007,42(3):164.
[3]Ma L,Yin LL,Sun J,et al.A sensitive high performance liquid chromatography coupled with solid phase extraction for determination of fexofenadine in beagle plasma[J].Journal of Chinese Pharmaceutical Sciences,2005,14(4):246.
[4]Naoe Y,Zenzaburou T,Yuichi S,et al.Microdose clinical trial:Quantitative determination of fexofenadine in human plasma using liquid chromatography/electrospray ionization tandem mass spectrometry[J].Journal of Chromatography B,2007,858(1):118.
[5]Hu XL,Huang H,Li YB,et al.The research development of orally disintergrating tablet[J].Chin J Hospital Pharm,2005,25(2):167.
[6]Hofmann U,Seiler M,Drescher S,et al.Determination of fexofenadine in human plasma and urine by liquid chromatography-mass spectrometry[J].Journal of Chromatography B,2002,766(2):227.
