工程菌β-胡萝卜素累积及提取条件优化的研究
2010-09-10冯亦平王健梅
冯亦平,李 珍,王健梅
(1.山西农业大学,山西太谷030801;2.长治职业技术学院园艺系,山西长治046000)
类胡萝卜素(carotenoids)是一类呈现黄色、橙色或红色的植物色素,广泛存在于各种动植物和微生物中。许多类胡萝卜素是VA的重要来源,同时又是强抗氧化剂,具有一定的防癌功效[1~3]。其中,β-胡萝卜素是类胡萝卜素家族中的典型代表。它的分子式为C40H56,分子质量为536.85[4],易溶于二硫化碳(0.02 g/mL)、沸腾乙醚(0.33 g/L)、正己烷(0.07 g/L),溶于氯仿和苯,微溶于乙醇和甲醇,不溶于水,无毒[5]。β-胡萝卜素是一种比较昂贵的天然色素[6],是目前国际市场上颇受欢迎的产品,具有广阔的市场前景。
传统提取β-胡萝卜素的方法是将新鲜胡萝卜绞汁以后,倒入高压均质机中均质,然后加入沉淀剂CaCl2·2H2O和稳定剂氨水/乙醇,离心,弃上清液,得到橙红色沉淀[7];然后将沉淀冷冻干燥,得到粉末状干燥沉淀,并在沉淀中加入有机溶剂石油醚萃取β-胡萝卜素[8],之后旋转蒸发浓缩,回收有机溶剂后得到β-胡萝卜素油状物。但是该法产量低,不易操作。噬夏孢欧文氏菌(Erwinia uredovora)是种植物病原菌,可合成番茄红素、β-胡萝卜素、玉米黄素、玉米黄素二糖苷等多种类胡萝卜素,其合成途径最早被Masaki等阐明[9],且参与代谢的多个相关酶的编码基因也被克隆。李丽[10]研究了无机盐和碳氮源对噬夏孢欧文氏菌中类胡萝卜素积累的影响,确定了该菌累积类胡萝卜素的最佳培养条件;刘敏等[11]也将噬夏孢欧文氏菌的crtE,crtB,crtI及crtY基因置于T7启动子的控制之下,构建了2个重组质粒,两重组质粒共转化大肠杆菌,获得了累积β-胡萝卜素的工程菌。
本试验总结了国内外学者的试验方法和经验,使β-胡萝卜素于原核生物(E coli DH5α)中进行表达,优化β-胡萝卜素累积及提取方法,使其表达量和提取量达到最佳,旨在解决人们对它与日俱增的需求问题。
1 材料和方法
1.1 菌种
菌株(E coli DH5α,含 pACCAR16△crtX),由山西农业大学生命科学学院实验室保存。
1.2 方法
挑取大肠杆菌工程菌单菌落,接种于5 mL LB液体培养基中,37℃振荡培养过夜。取2 mL菌液加入100 mL培养基中,扩大培养约3~4 h。然后将菌液分成若干份,保存于4℃冰箱中待用。将培养好的菌液分别编号并加入诱导剂IPTG,放入摇床进行诱导,取出后3 000 r/min离心收集菌体。称重加入4 mol/L的HCl水浴破壁,然后直接加入丙酮进行抽提,4 000 r/min离心15 min(上清液于4℃暗处保存),沉淀用少量丙酮再抽提2次,合并3次的上清液,加入1 mL氯仿,3 000 r/min离心8 min,弃上清液,最后测定下层液体的OD值。
2 结果与分析
2.1 诱导时间对工程菌累积β-胡萝卜素的影响
取培养好的5份菌液分别编号,并加入等量的诱导剂IPTG使其终浓度为0.5 mmol/L,放入摇床,分别诱导 1.25,2.25,3.25,4.25 h,按 1.2 提取方法进行β-胡萝卜素的提取,再用分光光度计对以上样品测定其在446,475,508 nm波长下的吸光度值,同时以不加IPTG的菌液作为对照。
从表1可以看出,随着诱导时间的延长,样品在不同波长时的吸光度值总体上呈先增加后减少的趋势,即β-胡萝卜素的积累量先增加后减少,诱导时间为1.25 h时,3种波长下所得到的OD值均为最大,其平均值分别是2.25 h的6倍和3.25 h的2倍,即在IPTG诱导1.25 h时,工程菌的β-胡萝卜素积累量达最大。这是因为随着诱导时间的增加,细菌密度增大,生活活力降低,甚至死亡,致使β-胡萝卜素不能合成进而积累;而诱导2.25 h时,β-胡萝卜素积累量最少,与对照(不加诱导剂IPTG)相当,这可能是由于在试验过程中光照、温度等因素使其降解所致。综上所述,IPTG诱导1.25 h时,最有利于β-胡萝卜素的积累。
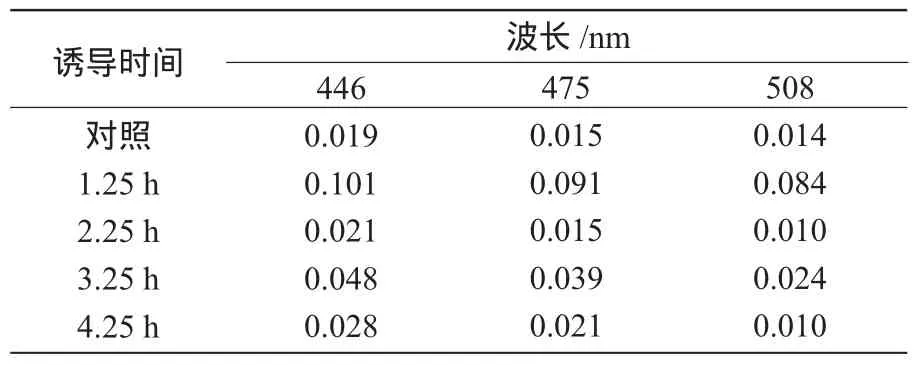
表1 不同诱导时间下样品在波长446,475,508 nm时的吸光度值
2.2 不同浓度诱导剂IPTG在相同诱导时间下对工程菌积累β-胡萝卜素的影响
取培养好的5份菌液分别编号,并加入IPTG 使 其 终 浓 度 分 别 为 0.2,0.5,0.8,1.0,2.0 mmol/L,诱导1.25 h后取出,按1.2方法提取β-胡萝卜素,并用分光光度计对以上样品进行吸光度值的测定。
从表2可以看出,随着IPTG终浓度的增加,样品在不同波长下的吸光度值呈先增加后减少的趋势,即β-胡萝卜素的积累量呈现出先增加后减少的趋势(OD值先增加后减少);IPTG终浓度为0.8 mmol/L时,所得氯仿抽提液的OD值达最大,也就是说,此时工程菌的β-胡萝卜素积累量达最大。这说明低浓度IPTG诱导可促进β-胡萝卜素的大量、高效积累,而高浓度的IPTG可能对细胞具有一定的毒害作用,致使工程菌死亡,无法大量表达目的产物β-胡萝卜素。因此可以得出,工程菌在0.8 mmol/LIPTG诱导下,最有利于β-胡萝卜素的积累。
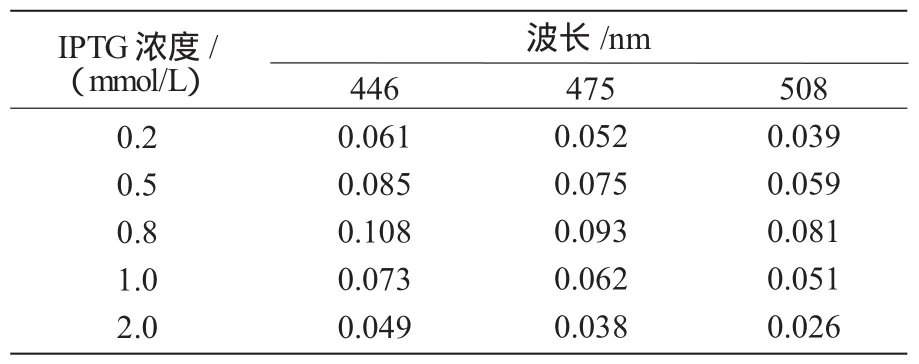
表2 不同诱导剂IPTG量的样品在波长446,475,508 nm下的吸光度值
2.3 菌液不同OD值对工程菌积累β-胡萝卜素的影响
由于IPTG高效启动重组菌外源基因的表达时需要消耗能量,而菌体本身的生长也需要吸收能源物质,二者之间存在一定的竞争作用,这就要求把握好IPTG诱导的时机。
表3显示,随着菌液OD600值的增加,样品在不同波长下的吸光度值总体上呈先增加后减少的趋势,即β-胡萝卜素的积累量整体上呈现出先增加后减少的趋势,当菌液OD600值为0.6时,所得到的氯仿抽提液的OD值达最大,即此时工程菌的β-胡萝卜素积累量达最大。这可能是由于菌液OD600值较低时,工程菌可能正处于迟缓期,此时加入IPTG,结果会导致菌体的生长繁殖大受影响;而菌液OD600值较高时,工程菌处于稳定期或衰亡期,有害代谢产物积聚,细菌繁殖开始变慢,死亡数增加,不利于β-胡萝卜素积累。综上所述,OD600值为0.6的菌液最适合β-胡萝卜素的积累。

表3 不同OD值的菌液经实验后样品在446,475,508 nm的吸光度值
2.4 盐酸量对β-胡萝卜素提取量的影响
把收集到的β-胡萝卜素按1.2试验方法提取(其中,HCl和丙酮分别按 5,10,15,20 mL/g(湿菌体)加入),并用紫外分光光度计法测定其中的β-胡萝卜素含量(表4)。

表4 盐酸量对β-胡萝卜素提取量的影响
由表4可知,随着HCl量的增加,最后测得的OD值即β-胡萝卜素的提取量也逐渐增大。当HCl量为2.6 mL时,β-胡萝卜素的提取量达到最大,再增大HCl量会使β-胡萝卜素的提取量逐渐降低。因此,HCl量为2.6 mL即15 mL/g(湿菌体)时,最后测得的OD值最大,即β-胡萝卜素提取效果最好。
2.5 HCl处理时间对β-胡萝卜素提取量的影响
把收集的β-胡萝卜素按1.2试验方法提取 (HCl处理时间为 10,20,30,40,50,60 min,HCl破壁温度为35℃,丙酮抽提时间为1.5 h),用紫外分光光度计法测其中的β-胡萝卜素含量。
由表5可知,随HCl处理时间的逐渐延长,最后测得的OD值即β-胡萝卜素提取量也逐渐增大。当HCl处理时间为40min时,β-胡萝卜素提取量达到最大;继续延长破壁时间到60 min,β-胡萝卜素提取量反而降低。因此,HCl处理时间为40 min时,β-胡萝卜素提取效果最好。
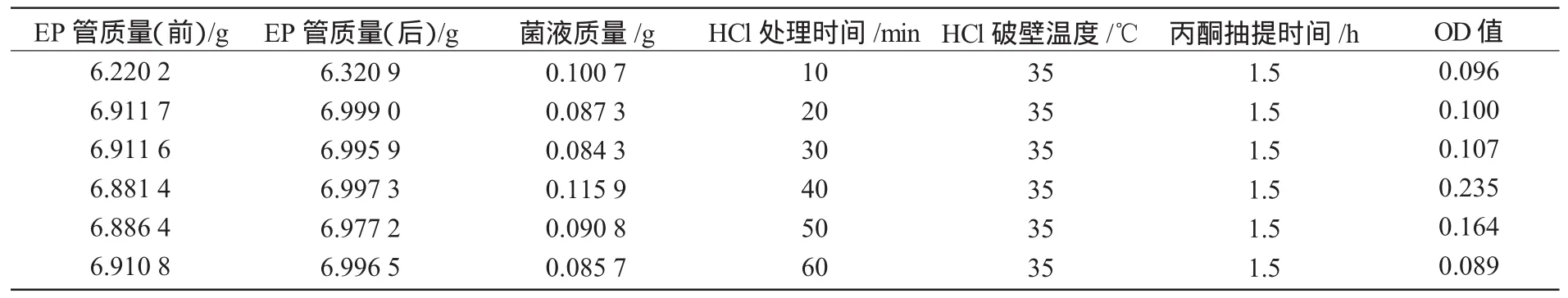
表5 HCl处理时间对β-胡萝卜素提取量的影响
2.6 HCl破壁温度对β-胡萝卜素提取量的影响
把收集的β-胡萝卜素按1.2试验方法提取(HCl破壁温度为 30,35,40,45,50,55 ℃,HCl处理时间为20 min,丙酮抽提时间为1.5 h),用紫外分光光度计法测其中的β-胡萝卜素含量。
由表6可知,随着HCl破壁温度的逐渐升高,最后测得的OD值即β-胡萝卜素的提取量也逐渐增大,当HCl破壁温度为40℃时,β-胡萝卜素的提取量达到最大;再升高温度可能会使β-胡萝卜素受热分解,从而致使提取量逐渐降低。因此,HCl处理温度为40℃时,最后测得的OD值最大,即β-胡萝卜素提取效果最好。
2.7 丙酮量对β-胡萝卜素提取量的影响
把收集的β-胡萝卜素按1.2试验方法提取(其中,HCl和丙酮分别按 10,20,30,40 mL/g(湿菌体)加入),用紫外分光光度计法测其中的β-胡萝卜素含量。
由表7可知,随着丙酮量的增加,最后测得的OD值即β-胡萝卜素的提取量也逐渐增大,当丙酮量为2.40 mL时,β-胡萝卜素的提取量达到最大,再增大丙酮量则会使β-胡萝卜素的提取量逐渐降低。因此,可以得知丙酮量为2.40mL即20 mL/g(湿菌体)时,最后测得的OD值最大, β-胡萝卜素提取效果最好。

表6 HCl破壁温度对β-胡萝卜素提取量的影响

表7 丙酮量对β-胡萝卜素提取量的影响
2.8 丙酮抽提时间对β-胡萝卜素提取量的影响
把收集的β-胡萝卜素按1.2试验方法提取(其中,丙酮抽提时间为 0.5,1.0,1.5,2.0 h 的时间梯度,HCl处理时间为20 min,HCl破壁温度为35℃),并用紫外分光光度计法测其中的β-胡萝卜素含量。
由表8可知,随着丙酮抽提时间的逐渐延长,最后测得的OD值即β-胡萝卜素的提取量却逐渐较少。在丙酮抽提时间为0.5 h时,β-胡萝卜素的提取量达到最大,而升高温度会使β-胡萝卜素遭受高温破坏,从而致使提取量逐渐降低。因此,可以得知丙酮抽提时间为0.5 h时,最后测得的OD值最大,即β-胡萝卜素的提取效果最好。

表8 丙酮抽提时间对β-胡萝卜素提取量的影响
3 结论与讨论
虽然β-胡萝卜素在很多植物和微生物中均有分布,但由于其所含色素的成分复杂,且很多β-胡萝卜素与天然脂肪酸会形成酯,致使提取单一组分的成本较高。随着β-胡萝卜素合成途径的阐明和相关基因的相继克隆,通过基因工程的办法使原本不产生β-胡萝卜素的生物可大量积累这类色素成为可能。
本试验将在大肠杆菌上表达的β-胡萝卜素用丙酮抽提法提取出来,并使用变量法对传统的提取方法作了改进,试图对提取条件进行优化。试验得出,用大肠杆菌作工程菌积累β-胡萝卜素的最佳条件是:诱导时间1.25 h,IPTG浓度0.8 mmol/L,菌液 OD值 0.6,HCl量 15 mL/g(湿菌体),破壁时间40 min,破壁温度40℃,丙酮量20 mL/g(湿菌体),抽提时间0.5 h。
[1] Omoni A,Rotimi E A.The anticarcinogenie and anti-atherogenic effects of lycopene:a review[J].Trends in Food Science&Technology,2005,16(8):344-350.
[2] Giovannueci E L,Ascherio A.Intake of carotenoids and retinol in relation to risk of prostate Cancer[J].J Natl Cancer Inst,1995,87(23):1767-1776.
[3] 张平,吴增茹,王永健.胡萝卜栽培过程中β-胡萝卜素含量的动态研究[J].华北农学报,2000,15(1):120-124.
[4] 杜桂彩.不同培养条件对大肠杆菌工程菌产β-胡萝卜素的影响[J].食品科学,2008,29(7):272-276.
[5] 许培雅,郑裕国,沈寅初.分光光度法测定红发夫酵母中虾青素含量[J].浙江工业大学学报,2001,29(2):120-123.
[6] 周立国.食用天然色素及其提取应用[M].济南:山东科学技术出版社,1993.
[7] 王海云,冯北元.实用生物化学原理及技术[M].北京:科学出版社,1979:51-52.
[8] 李建武,余瑞元,袁明秀,等.生物化学实验原理和方法[M].北京:北京大学出版社,1994.
[9] 刘福岭.食品物理与化学分析方法[M].北京:中国轻工业出版社,1987:12-14.
[10] 李丽.无机盐和碳氮源对噬夏孢欧文氏菌积累类胡萝卜素的影响[J].食品科学,2007,28(4):183-186.
[11] 刘敏,李荣贵,杜桂彩,等.生产β-胡萝卜素大肠杆菌工程菌的构建[J].药物生物技术,2006,14(1):1-4.
