隐孢子虫鼠基因型卵囊壁蛋白CP41基因的原核表达及抗血清的制备
2010-09-10于慧珠陈兆国米荣升夏延富
于慧珠,岳 城,陈兆国, 米荣升,夏延富
(1.中国农业科学院上海兽医研究所农业部动物寄生虫学重点开放实验室/上海动物生物技术研究中心,上海 200232;2.新疆农业大学动物医学院,新疆乌鲁木齐 830052;3.湖南农业大学动物医学院,湖南长沙 410128)
隐孢子虫鼠基因型卵囊壁蛋白CP41基因的原核表达及抗血清的制备
于慧珠1,2,岳 城2,陈兆国1*, 米荣升1,夏延富3
(1.中国农业科学院上海兽医研究所农业部动物寄生虫学重点开放实验室/上海动物生物技术研究中心,上海 200232;2.新疆农业大学动物医学院,新疆乌鲁木齐 830052;3.湖南农业大学动物医学院,湖南长沙 410128)
为克隆和表达编码隐孢子虫鼠基因型卵囊壁蛋白CP41基因,以隐孢子虫鼠基因型卵囊总RNA作为模板,RT-PCR扩增CP41基因,克隆到pMD18-T载体并进行序列测定,构建重组质粒pGEX-5x-3-CP41,转化BL21(DE3)感受态细胞进行诱导,表达产物SDS-PAGE检测目的蛋白,western blot分析该重组蛋白的免疫活性。结果显示,克隆的目的基因核苷酸序列与GenBank登录中的序列比较,同源性为90.5%,氨基酸序列同源性为87.57%。重组质粒转化菌在IPTG诱导下以包涵体形式高效表达,表达的融合蛋白大小约为46 ku,western blot分析显示,纯化复性后的重组蛋白可被辣根过氧化物酶标记的抗谷胱甘肽巯基转移酶(GST)单克隆抗体、隐孢子虫兔基因型感染兔血清特异性识别。ELISA检测结果表明,该蛋白3次免疫无特征病原体新西兰白兔后,兔血清特异性抗体达到较高水平,表明表达的重组蛋白具有较好的反应原性和免疫原性。
隐孢子虫鼠基因型;卵囊壁蛋白;CP 41;克隆;原核表达
隐孢子虫病(Cryptosporidiosis)是隐孢子虫寄生于人和其它脊椎动物的胃肠道和呼吸道粘膜上皮细胞内引起的一种以腹泻为主的人兽共患寄生性原虫病。该病在全球广泛分布,人畜感染率高危害严重。目前,多数学者公认的隐孢子虫有效种有19种,此外,还有超过44个隐孢子虫基因型[1]。隐孢子虫鼠基因型(Cryptosporidiummouse genotype)过去称微小隐孢子虫鼠基因型(Cryptosporidium parvummouse genotype),是其中一个重要的、跨地域保守的基因型,广泛存在于鼠类、蝙蝠以及牛等动物中[2]。在我国曾有报道发现存在于人[3]。
血清学方法是检测人和动物是否感染隐孢子虫的重要方法之一[4],目前有多种隐孢子虫抗原已经得到鉴定和克隆[5-6]。Jenkins等从微小隐孢子虫(Cryptosporidium parvum)牛基因型AUCP-1株基因组DNA文库中鉴定了一个种特异性卵囊壁蛋白CP41。尽管该基因序列出现在多种隐孢子虫卵囊基因组中,但免疫斑点试验显示CP41蛋白免疫后制备的血清仅与C.parvum卵囊裂解物反应,而与贝氏隐孢子虫(C.baileyi)、火鸡隐孢子虫(C.meleagridis)和蛇隐孢子虫(C.serpentis)均不反应。对C.parvum和C.baileyi卵囊总RNA进行RT-PCR扩增,发现仅有C.parvum能够扩增出CP41基因,而C.baileyi无法扩增,表明抗原CP41可能在隐孢子虫免疫诊断上有种特异性[7]。但基因阅读框不完整,3'端没有终止密码子。Kjobs等对上述牛源C.parvumCP41基因原核表达的重组抗原与卵囊可溶性粗抗原对人血清的诊断效果进行了评估,通过ELISA方法检测192份健康成人血清中的抗隐孢子虫IgG抗体,发现两种抗原检测结果一致率达88%,结果显示应用重组抗原CP41可以提供标准、可靠的检测方法[4]。
本研究首次对隐孢子虫鼠基因型CP41基因进行了克隆和原核表达,并对获得的重组抗原进行了初步的抗原性分析,为进一步利用该重组抗原进行隐孢子虫病免疫诊断奠定基础。
1 材料和方法
1.1 虫种 隐孢子虫鼠基因型卵囊由中国农业科学院上海兽医研究所保存,接种昆明系小鼠进行大量繁殖。用饱和盐水漂浮法收集卵囊,采用蔗糖密度梯度法[8]纯化卵囊。
1.2 实验材料 TRIzol购自美国Invitrogen公司;AMV反转录酶、LATaq酶、T4 DNA连接酶、pMD18-T载体、Oligo d(T)18、EcoRⅠ、SalⅠ和HindⅢ 购自TaKaRa公司;DNA Marker、蛋白质MarkerⅡ购自北京天为时代科技有限公司;DNA胶回收试剂盒购自Bay Gene Inc;辣根过氧化物酶(HRP)标记GST的单克隆抗体(MAb)购自美国Invitrogen公司;HRP标记山羊抗兔IgG(H+L)多克隆抗体购自上海普飞生物技术有限公司;HRP标记山羊抗鼠IgG(H+L)多克隆抗体购自美国Gaithersburg,MD公司;弗氏完全佐剂、弗氏不完全佐剂购自美国Sigma公司;Montanide ISA 206佐剂购自法国Seppic公司;大肠杆菌 DH5 α、BL21(DE3)和pGEX-5x-3由本实验室保存;兔抗隐孢子虫兔基因型阳性血清为本实验室制备。
1.3 引物的设计和合成及目的基因克隆 根据文献报道从奶牛分离的C.parvum的CP41基因序列[7],利用DNAStar设计1对PCR引物。F:5'-GAGATG GACTATTCTAGG-3'; R: 5'-AGCATTAGTAGCAA CAGTAG-3',引物由上海英俊生物有限公司合成。采用TRIzol试剂提取隐孢子虫鼠基因型卵囊的总RNA,以Oligod(T)18为引物,用AMV反转录酶制备cDNA。以cDNA为模板进行PCR扩增,扩增体积为 50 μL,反应参数为:94℃ 5 min;94℃30 s、50℃ 30 s、72℃ 1 min,30个循环。将PCR扩增产物克隆于pMD18-T中,经酶切鉴定,命名为pMD-CP41。
1.4 原核表达质粒的构建及鉴定 将pMD-CP41和原核表达载体pGEX-5x-3均用EcoRⅠ和SalⅠ进行双酶切,回收目的片段,连接、转化大肠杆菌DH5α感受态细胞,用EcoRⅠ和SalⅠ对提取的重组质粒进行双酶切鉴定并对目的基因进行测序鉴定,命名为pGEX-CP41。
1.5 重组质粒在大肠杆菌中的诱导表达 将鉴定正确的重组菌37℃培养至OD600nm约0.5时,加入IPTG至终浓度为1.0 mmol/L,诱导7 h。每隔1 h取样进行SDS-PAGE分析。另取IPTG诱导5 h表达菌,经液氮冻融、超声裂解后用SDS-PAGE分析重组蛋白的存在形式。
1.6 重组蛋白的复性纯化 超声裂解表达菌体,沉淀用8 mol/L尿素溶解,裂解菌体经梯度透析复性后进行SDS-PAGE电泳。复性后的蛋白经GST亲合柱分离纯化,BandScan软件分析蛋白的纯度。
1.7 重组蛋白的免疫原性检测
1.7.1 重组蛋白的western blot分析复性的重组蛋白经SDS-PAGE电转移至硝酸纤维素(NC)膜上,经5 g/L脱脂奶粉室温封闭2 h,分别与1 μg/mL鼠抗GST MAb和1∶200稀释的兔抗隐孢子虫兔基因型阳性血清各温育1 h,并设正常兔血清作对照,洗涤后再分别与HRP标记的山羊抗鼠IgG和HRP标记的山羊抗兔IgG(1∶1 000)2个二抗各温育1 h,用二氨基联苯胺(DAB)显色。
1.7.2 重组蛋白免疫兔血清的制备采用颈背部及脚掌多点注射免疫法,将复性纯化后的重组蛋白分别与弗氏和Montanide ISA 206佐剂充分乳化后,免疫雄性SPF新西兰白兔,免疫3次,每次间隔2周。3次免后第2周采血分离血清。
1.7.3 ELISA检测抗体效价以2 μg/mL的重组蛋白4℃包被过夜,50 g/L脱脂奶粉37℃封闭2 h。与不同稀释度的重组蛋白免疫兔血清37℃温育1 h,与1∶1 000稀释的HRP标记山羊抗兔IgG于37℃温育1 h,四甲基联苯胺底物缓冲液37℃反应10 min,2 mol/L H2SO4终止反应,测定吸光度(OD450nm),检测重组蛋白免疫SPF兔血清中特异性抗体水平,评估免疫血清的抗体效价。
2 结果
2.1 CP41基因的RT-PCR扩增 应用CP41引物序列,以隐孢子虫鼠基因型cDNA为模板,扩增出约550 bp的片段,与预期大小相符(图1)。重组质粒pMD-CP41经EcoRⅠ和HindⅢ双酶切,结果与预期大小相符。

2.2 CP41基因核苷酸序列分析 将测序的CP41基因片段序列与GenBank中登录的奶牛源AUCP-1分离株核苷酸序列(AF144621)进行比对,结果隐孢子虫鼠基因型序列有53个核甘酸差异,同源性为90.50%,特别是在序列的357 bp处,新插入30 bp的序列,而在509 bp处,缺失了9 bp,但没有导致读码框的改变。预测的编码氨基酸序列有23个氨基酸差异,氨基酸序列的同源性为87.57%。
生物信息学分析显示,CP41蛋白N端不具有信号肽,也无跨膜结构。疏水性分析显示该蛋白疏水性基团仅占总数的26.92%。预计编码的蛋白大小为19.47 ku。克隆的隐孢子虫鼠基因型CP41基因序列已录入GenBank,登录号为EU532138。
2.3 重组表达质粒pGEX-CP41的双酶切鉴定 将重组质粒pGEX-CP41用EcoRⅠ和SalⅠ双酶切,得到两条带,与预计片段大小相符。序列测定结果表明插入方向与蛋白读码框均正确,可利用载体上的终止子TGA终止表达。
2.4 重组质粒的表达及表达产物的可溶性分析pGEX-CP41转化菌经IPTG诱导5 h表达量增高。诱导表达的重组蛋白在上清中未发现,但能够溶解在8 mol/L尿素中,为包涵体形式表达,重组蛋白的分子量约为46 ku,与预测的大小一致。BanScan软件分析显示表达的重组蛋白为菌体总蛋白的44.2%;复性的表达产物经GST亲和层析纯化,获得了较纯的目的蛋白,BanScan软件分析显示纯化后的重组蛋白约占纯化后总蛋白的71.7%(图2)。

2.5 表达产物的免疫活性分析 Western blot结果显示,重组CP41与兔抗隐孢子虫兔基因型阳性血清及鼠抗GST MAb出现特异性反应,反应条带同预期的大小一致,而与正常兔血清没有反应(图3)。
ELSIA检测结果表明,纯化复性的重组蛋白经3次免疫后,产生了较高效价的血清抗体,血清经51 200倍稀释后,抗体效价仍远高于对照组。2种佐剂免疫效果均较好,其中弗氏佐剂的免疫效价更高(表 1)。
3 讨论
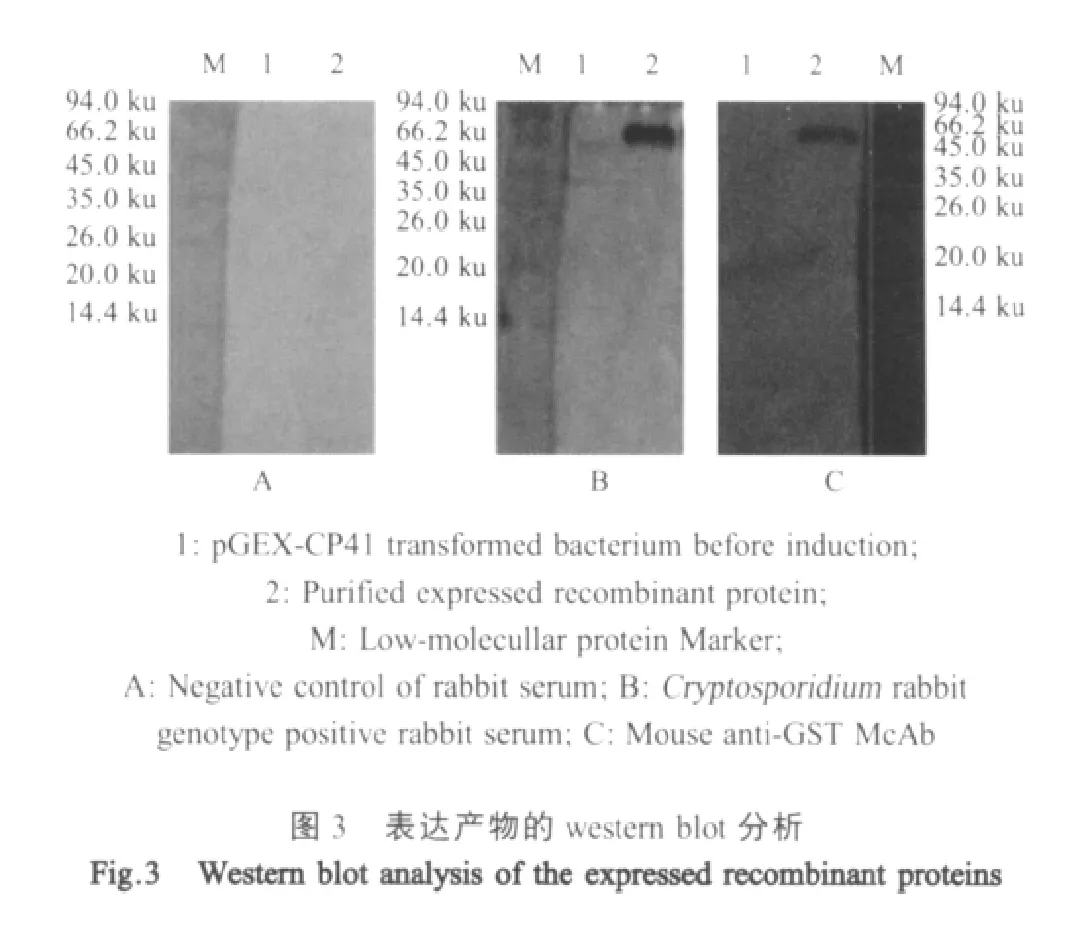
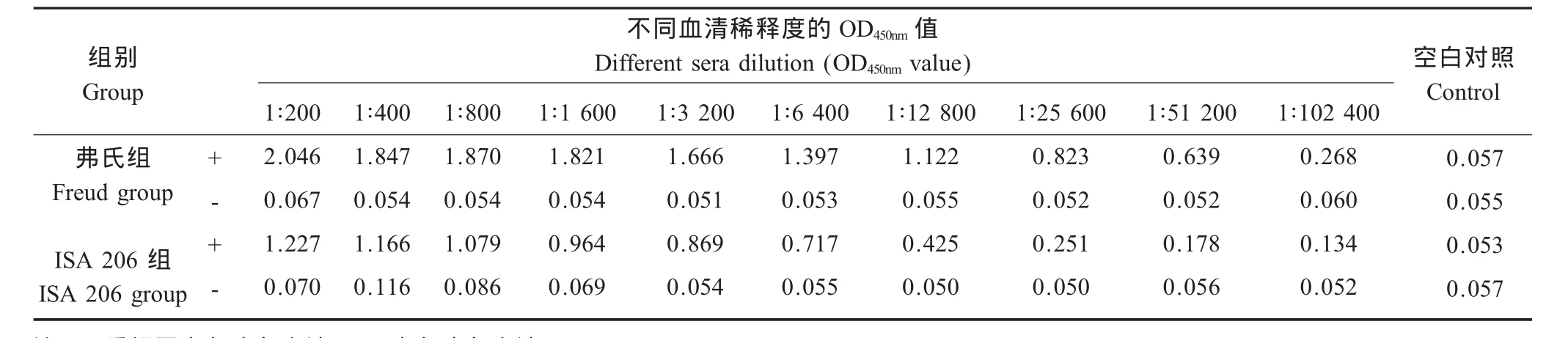
表1 免疫兔血清抗体效价ELISA检测结果Table 1 Rabbit serum antibody titer detected by ELISA
卵囊壁蛋白CP41是具有较高免疫原性的隐孢子虫种特异性蛋白,由Jenkins等鉴定提出CP41可能在隐孢子虫病的免疫诊断中具有种特异性[7]。本研究提取了隐孢子虫鼠基因型卵囊的总RNA,经RT-PCR扩增出了549 bp的片段,表明隐孢子虫鼠基因型卵囊总RNA中也存在该蛋白的mRNA。对该片段的核苷酸序列分析显示,同源性为90.50%,特别是在357 bp处,新插入30 bp的序列,导致预计的氨基酸序列有23个残基的差异,同源性为87.57%。由于隐孢子虫基因组中很少含有内含子,而且Jenkins等是利用天然CP41蛋白免疫血清从C.parvum基因组DNA文库中通过免疫筛选获得的[7]。因此,该插入的序列不可能是内含子。本研究克隆的CP41基因来源于分离自中国的隐孢子虫鼠基因型,而Jenkins等研究时采用了来自美国的牛源微小隐孢子虫(AUCP-1株)[7]。笔者推测这可能是由于隐孢子虫的种型特异性造成的,也可能是不同地理间隔造成的,具体原因还有待于进一步研究。克隆的目的基因经大肠杆菌表达,重组蛋白分子量约为46ku,大部分以包涵体的形式存在。联合运用稀释和透析的方法复性包涵体蛋白,经western blot检测,复性的重组蛋白可分别可与鼠抗GST MAb、隐孢子虫兔基因型阳性兔血清识别,表明复性的重组蛋白具有较好的免疫反应性。将复性的蛋白免疫SPF兔,经2次加强免疫后,诱导了很高效价的抗体,表明该蛋白具有良好的免疫原性。
此外,本研究利用CP41特异性引物,对C.baileyi、猪基因型Ⅱ (pig genotypeⅡ)卵囊总RNA进行RT-PCR扩增,但均未扩增出CP41基因,证实了Jenkins等关于该基因的转录具有种特异性的推测,也证实该基因的转录存在型特异性。但这还需要通过检测更多隐孢子虫种、型,以及进一步的研究来验证。
本研究曾先后试用过 pET-28b(+)、pET-40b(+)、pET-41b(+)作为表达载体,但表达效果都不理想。这表明在进行抗原基因的原核表达时,选择合适的表达载体相当重要。
本实验在进行重组CP41蛋白的免疫时,分别选用206佐剂和弗氏完全、不完全佐剂协同进行免疫,结果两种佐剂混合免疫均产生了较高效价的血清抗体,其中弗氏佐剂的免疫效价更高,表明该佐剂与重组蛋白的协同免疫效果更理想。
本研究利用原核表达系统,获得了具有较好免疫活性的CP41重组蛋白,为进一步利用该重组蛋白进行隐孢子虫病免疫诊断研究,建立灵敏、特异、标准的免疫学诊断方法奠定了基础。
[1]Smith H V,Nichols R A B.Cryptosporidium:detection in water and food[J],Exp Parasitol,2009,Jun 3.[Epub ahead of print].
[2]Morgan U M,Sturdee A P,Singleton G,et al.The Cryptosporidium"mouse"genotype is conserved across geographic areas[J].J Clin Microbiol,1999,37(5):1302-1305.
[3]王进产,张龙现,宁长申,等.人源隐孢子虫分离株种类鉴定与种系发育关系分析[J].中国人兽共患病学报,2007,23(10):997-1000.
[4]Kjos S A,Jenkins M,Okhuysen P C,et al.Evaluation of recombinant Oocyst protein CP41 for detection ofCryptosporidium-specific antibodies[J].Clin Diagn Lab Immunol,2005,12(2):268-272.
[5]Watts A M,Kennedy R C.DNA vaccination strategies against infectious diseases[J].Int J Parasitol,1999,29(8):1149-1163.
[6]De Graaf D C,Spano F,Petry F,et al.Speculation on whether a vaccine against cryptosporidiosis is a reality or fantasy[J].Int J Parasitol,1999,29(8):1289-1306.
[7]Jenkins M C,Trout J,Murphy C,et al.Cloning and Expression of a DNA Sequence Encoding a 41-KilodaltonCryptosporidiumparvum Oocyst wall protein[J].Clin Diagn Lab Immunol,1999,6(6):912-920.
[8]Arrowood M J,Sterling C R.Isolation ofCryptosporidiumoocysts and sporozoites using discontinuous sucrose and isopycnic Percoll gradients[J].J Parasitol,1987,73(2):314-319.
Cloning and prokaryotic expression ofCryptosporidiummouse genotype oocyst wall protein CP41 gene
YU Hui-zhu1,2,YUE Cheng2,CHEN Zhao-guo1*,MI Rong-sheng1,XIA Yan-fu3
(1.Shanghai Research Center of Animal Biotechnique,Key Laboratory of Animal Parasitology of Ministry of Agricultural,Shanghai Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Shanghai 200232,China;2.College of Veterinary Medicine,Xinjiang Agricultural University,Urumchi 830052,China;3.College of Veterinary Medicine,Hunan Agricultural University,Changsha 410128,China)
The oocyst wall protein CP41 gene ofCryptosporidiummouse genotype was amplified from total RNA by RT-PCR,sequenced and compared with that fromC.parvumin GenBank.The sequences shared 90.5%nucleotide and 87.57%amino acid identities with the published sequences.The gene fragment was subcloned into pGEX-5x-3 vector and transformed intoE.coliBL21(DE3).Recombinant protein was expressed after IPTG induction and identified by SDS-PAGE and western blot.The expressed proteins were used to immunize rabbit,specific antibodies were detected by ELISA.The recombinant protein was about 46 ku and mainly existed in the form of inclusion body.The protein could be recognized the positive sera againstCryptosporidiumrabbit genotype.High level antibodies againstCryptosporidiumin rabbits could be produced after 3 times immunization with the protein,indicating that the fusion protein had high reactogenicity and immunogenicity.
Cryptosporidiummouse genotype;oocyst wall protein;CP41;cloning;prokaryotic expression
S852. 72;Q786
A
1008-0589(2010)08-0622-05
10.3969/j.issn.1008-0589.2010.08.11
*Correspondingauthor
2009-06-24
国家高技术研究发展计划(2006AA10A207);国家“十一五”科技支撑计划(2007BAD40B05);上海市科技兴农重点攻关项目[沪农科攻字(2005)第3-4号]
于慧珠(1981-),女,山东潍坊人,硕士研究生,主要从事隐孢子虫分子生物学研究.
*通信作者:E-mail:zhaoguochen@shvri.ac.cn
(本文编辑:陈立群)
