辅酶依赖型和不依赖型甘油脱水酶的比较
2010-09-07杨仲丽方柏山余劲聪王庆花李梓君
杨仲丽,方柏山,余劲聪,王庆花,李梓君
(华侨大学工业生物技术福建省高等学校重点实验室,福建泉州362021)
辅酶依赖型和不依赖型甘油脱水酶的比较
杨仲丽,方柏山,余劲聪,王庆花,李梓君
(华侨大学工业生物技术福建省高等学校重点实验室,福建泉州362021)
实验比较源自肺炎克氏杆菌(K.pneumoniae)和丁酸梭状芽孢杆菌(C.butyricum)中的甘油脱水酶(GDHt)的辅酶依赖特性.采用生物信息学的方法,对两种酶的异同点进行分析,发现两种酶结构上相似性较低、亲缘性较远、分属于两个不同的家族.SMART数据库搜索结果表明,C.butyricum中不依赖辅酶的甘油脱水酶及其再激活酶,分别属于gly-Radical和Radical-SAM家族,多序列比对得到的一段富含半胱氨酸残基C**C**C的保守序列正是其共同特征.
肺炎克氏杆菌;丁酸梭状芽孢杆菌;辅酶;甘油脱水酶;维生素B12;依赖性
甘油脱水酶(GDH t)是微生物发酵法生产3-羟基丙醛(3-HPA),进而生产1,3-丙二醇(1,3-PD)过程中的重要限速酶之一.在已发现能发酵甘油,产生1,3-丙二醇(1,3-PD)的微生物中[1],克氏肺炎杆菌(K.pneum oniae)和丁酸梭状芽孢杆菌(C.butyricum)具有较高的1,3-PD转化率及生产强度,是研究得比较多的两种菌[2].K.pneumoniae以甘油为底物发酵生产(3-HPA)的一个关键的限制点,是编码一种依赖辅酶B12的甘油脱水酶,即需要在培养基中额外地加入维生素B12.C.butyricum具有良好的1,3-PD耐受力,且其发酵过程具备对辅酶B12的不依赖性.该菌属于严格厌氧菌,在实验室培养条件苛刻,而在工业培养中方便.对于C.butyricum中甘油脱水酶不依赖辅酶的报道[3-5],使得该种甘油脱水酶催化机制的研究成为新的热点.本文比较源自K.pneumoniae和C.butyricum中GDHt对辅酶B12的依赖性,并从生物信息学角度找出辅酶依赖型和不依赖型甘油脱水酶的异同点.
1 材料与方法
1.1 材料
(1)菌株.肺炎克氏杆菌(K.pneumoniae,DSM 2026),丁酸梭状芽孢杆菌(C.butyricum, VPI1718),由德国生物技术研究中心惠赠.(2)试剂.辅酶B12,盐酸3-甲基-2-苯并咪唑酮腙(MBTH),购自美国Sigma公司;其余试剂均为国产分析纯.(3)生物学数据库.NCB I,PDB,SM ART等.(4)应用软件.Cluster X,Molsoft ICM-Pro,Phylip等.
1.2 方法
1.2.1 GDH t的酶活测定方法 (1)预处理.将保存于-20℃的K.pneumoniae和C.butyricum经过活化、扩大培养和发酵后,离心收集菌体,并采用超声波细胞破碎法(1 s内超声0.6 s,间歇0.4 s)破碎;然后,将离心悬浮液,上清液即为无细胞抽提液,用于酶活性分析.其中,C.butyricum培养的整个过程都在严格厌氧条件下进行.
(2)测定方法.GDHt催化甘油脱水生成的醛类,其与MBTH反应形成的复合物可用紫外分光光度法进行测定.采用Toraya等建立的MBTH(3-甲基-2-苯并噻唑腙烟酸盐)法测定GDHt的活性.
(3)反应体系.适量无细胞抽提液,0.12 mol·L-1甘油,0.035 mol·L-1磷酸钾缓冲液,0.05 mol·L-1KCl,选择性地添加15μmol·L-1辅酶B12,总体积为1 m L.在37℃下反应一定时间后,加入1 m L的0.1 mol·L-1柠檬酸钾缓冲液(p H=3.6)以终止反应;然后,加入0.5 mL的0.1%MBTH,于37℃下保温15 m in,加入1 m L水,于305 nm下测定其吸光度值.
1.2.2 生物信息学比较 (1)一级结构比较.从生物数据库NCBI上搜索得到辅酶依赖型和不依赖型GDH t的氨基酸序列,K.pneum oniae中GDHt氨基酸序列的NCB I登陆号为U 60992,C.butyricum中GDHt的NCBI登陆号为A Y112989.利用NCBI数据库的BLAST(两条序列对齐)功能(http://www.ncbi.nlm.nih.gov/),提交辅酶依赖型GDH t的α,β,γ亚基和不依赖型GDH t及其再激活酶基因序列;搜索其相似序列和区域,并对辅酶不依赖型GDHt的整个数据库进行相似性分析.在此基础上,选取相似性较高的几条序列,利用Cluster X软件进行多序列比对,以寻找保守区域.
(2)蛋白质结构域搜索.利用SMART数据库搜索GDHt及其再激活酶结构域,所得结构域同时提供相关连接,如结构域功能、分布范围,以及是否具有已知空间结构.
(3)酶分子空间结构的重叠分析.从PDB数据库上搜索并下载辅酶依赖型和不依赖型GDHt的晶体结构,K.pneumoniae中GDH t晶体结构的PDB登陆号为1MM F,C.butyricum中GDH t晶体结构的PDB登陆号为1R9D.利用Molsoft ICM-Pro软件对其3级结构进行空间位置的重叠,以衡量其空间构象的相似性.
(4)酶的亲缘性分析.利用软件Phylip,建立包括K.pneumoniae和C.butyricum的GDH t在内的进化树,分析两者亲缘性.
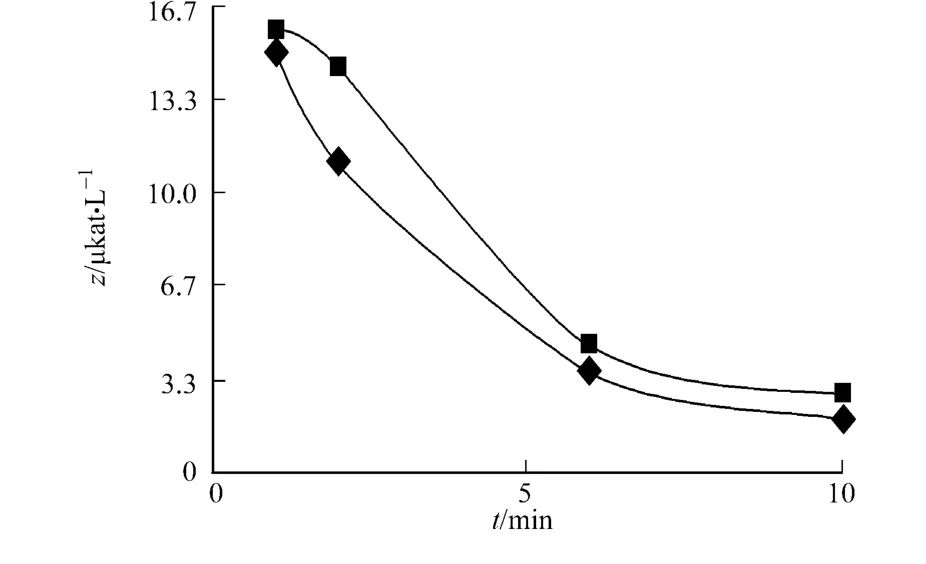
图1 氧气对C.butyricum中GDH t酶活的影响Fig.1 Effect of oxygen on the activity of GDHt from C.butyricum
2 结果与讨论
2.1 GDHt辅酶依赖性的比较
在有氧条件下,分别测定添加与不添加辅酶的GDHt酶活,结果如图1所示.实验发现,K.pneum oniae中GDH t在辅酶B12存在下,表现出的酶活为13.70 μkat·L-1,而不添加辅酶则没有活性,反应10 min后终止.由于C.butyricum中GDH t对氧气较敏感,所以在有氧条件下测量其酶活时需通入去氧剂.
在不同的反应终止时间,发现随着GDH t在氧气中暴露时间越长,酶活丧失越多(终止时间为1 min时,可近似看作厌氧).从图1可看出,C.butyricum的GDHt在添加与不添加辅酶B12时,酶活相差较小.
2.2 一级结构的序列分析
在NCB I服务器上使用BLAST程序中的BLOSUM 62矩阵,空位开放罚分和空位扩展罚分分别为11和1,对两序列进行对齐分析,结果如图2所示.图2显示,此两条序列间没有相似的序列及区域.
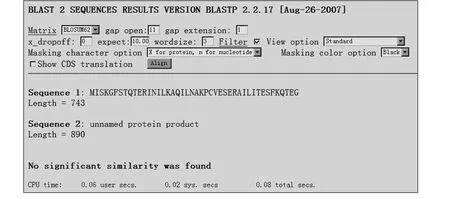
图2 两条序列对齐结果Fig.2 Alignment of the two sequences
利用综合性软件Molsoft ICM-Pro计算辅酶依赖型GDHt的α亚基和不依赖型GDHt完全对齐时相同碱基仅为19%,结果如图3所示.由于两序列同源性较小,而辅酶依赖型GDH t的催化机制已得到较透彻的研究,在此,以不依赖型GDHt为探索的重点.

图3 Molsoft ICM-Pro计算两序列的同源性结果Fig.3 Calculation of homology between the two sequences by Molsoft ICM-Pro
在NCBI服务器上使用BLAST程序,从SW ISS-PORT蛋白质序列数据库中搜索辅酶不依赖型GDHt的相似序列,结果如图4所示.图4中列出的最高分值的击中项,每一行显示一条蛋白质序列.从左到右依次是数据库编号、序列名称、序列长度,然后是两个仅与技术有关的分值,末尾行是阀值E, E值由高到低.搜索使用的是BLOSUM 62矩阵,空位开放罚分和空位扩展罚分分别为8和2,其中设定阀值E为0.1.

图4 辅酶不依赖型GDHt对库检索结果Fig.4 Retrieval of B12-independent GDHt in the NCB Idatabase
由图4可看出,来自不同菌种的PFL序列联配分值较高.选取几种同源性较高的酶,利用ClusterX软件进行多序列比对.找出图5所示的保守区域,其中富含半胱氨酸残基.活性中心的半胱氨酸残基遇氧容易形成S-S键,失去转移电子的能力.这可能是该酶对氧气较敏感.
K.pneumoniae中的GDHt是6个亚基α2,β2,γ2,通过非共价键的疏水相互作用缔合成的异六聚体,其中两个α,β,γ异型三聚体组成了一个对二聚体.α亚基含一个丙糖磷酸异构酶(TIM)桶状结构,把活性中心围在中间.B12位于TIM桶状结构和β亚基之间,如图6所示[6].
C.butyricum中的GDH t是一个由单亚基通过非共价键的疏水相互作用缔合成的二聚体,它的两个单体呈几乎完美的中心对称,其单体由10个β/α桶状结构组成,氨基酸C端(黄色标记)作为高度保守区,是与再激活酶结合的位点,如图7所示[7].从图6,7可看出,辅酶不依赖型GDH t在氧气中暴露时间越长,酶活丧失越多.其中,DhaB为辅酶不依赖型GDH t基因,PflC,TutE,N rdG的NCB I登陆号分别为Ec(P32675),T1(AAC38452),Ec(P39329).
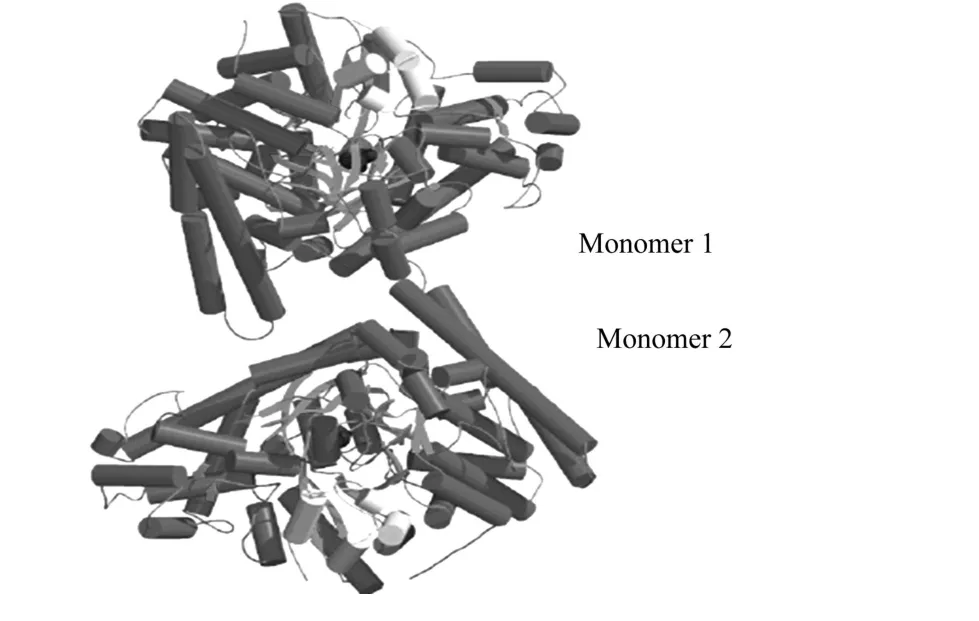
图7 C.butyricum甘油脱水酶的晶体结构 Fig.7 Crystal structure of GDHt from C.butyricum
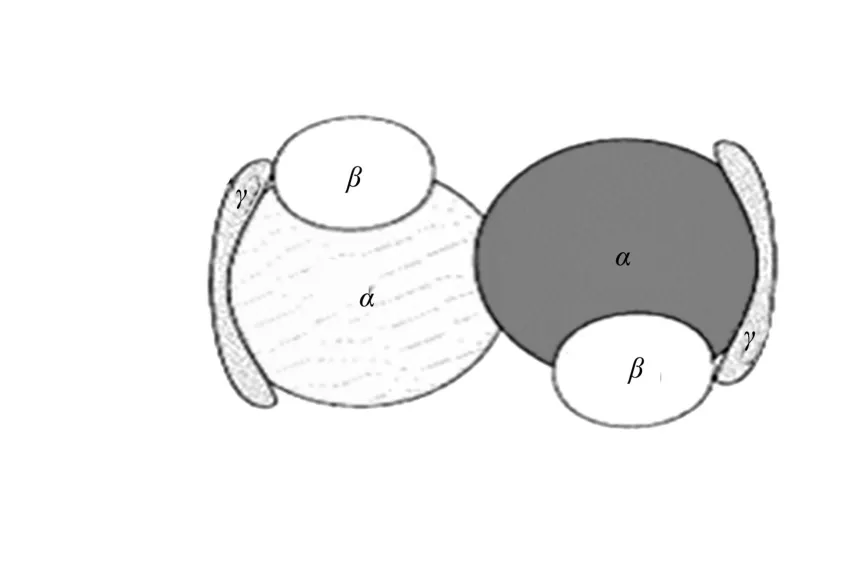
图6 K.pneumoniae甘油脱水酶的拓扑结构图Fig.6 Opology of GDHt from K.pneumoniae

图5 ClusterX多序列比对搜索到的保守区域Fig.5 Conserved region found by multip le sequence alignments
2.3 蛋白质结构域的搜索结果分析
在SMART搜索到的辅酶不依赖型GDH t的结构域,如表1所示.从表1可知,该蛋白有一段相似于PFL家族的结构域和一段gly-Radical结构域.搜索辅酶不依赖型GDHt的再激活酶(GDH t-AE)时,发现其属于“Radical-SAM”家族,如表1所示.
Heidi等[8]指出,这一家族的成员均可催化一系列不依赖辅酶的化学反应,但是每一种酶根据底物不同而需要不同的辅因子,并有着相同的催化机理.在搜索辅酶依赖型GDHt时,未发现有显著的结构域.
2.4 三级结构重叠分析
利用Molsoft ICM-Pro软件,对辅酶依赖型和不依赖型GDH t的3级结构进行最大限度重叠,结果如图8(a)所示.虽然两者都为二聚体,但是空间结构相差较大,重叠部分较少.
引入均方根偏差DRMS作为衡量重叠效果的参数,DRMS越大,重叠部分越少.两者重叠的DRMS值为27.104 749.作为比较,同时重叠来自Clostridium novyi的PFL与不依赖型GDHt,两者相似性为78%,DRMS为9.607 466,如图8(b)所示.
2.5 进化树的建立
选择两种酶对库检索时产生的序列,利用Phylip软件生成进化树,如图9所示.图9中,黑框标记为K.pneum oniae和C.butyricum中GDHt.从图9可看出,辅酶不依赖型GDHt与一类PFL及同样不依赖辅酶的GDHt有较近的亲缘性,同属于Radical-SAM家族[4,9].
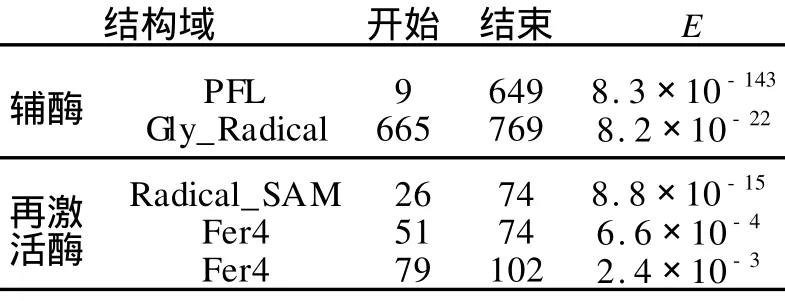
表1 SMART的结构域搜索结果Tab.1 Domains of GDHt found by SMART
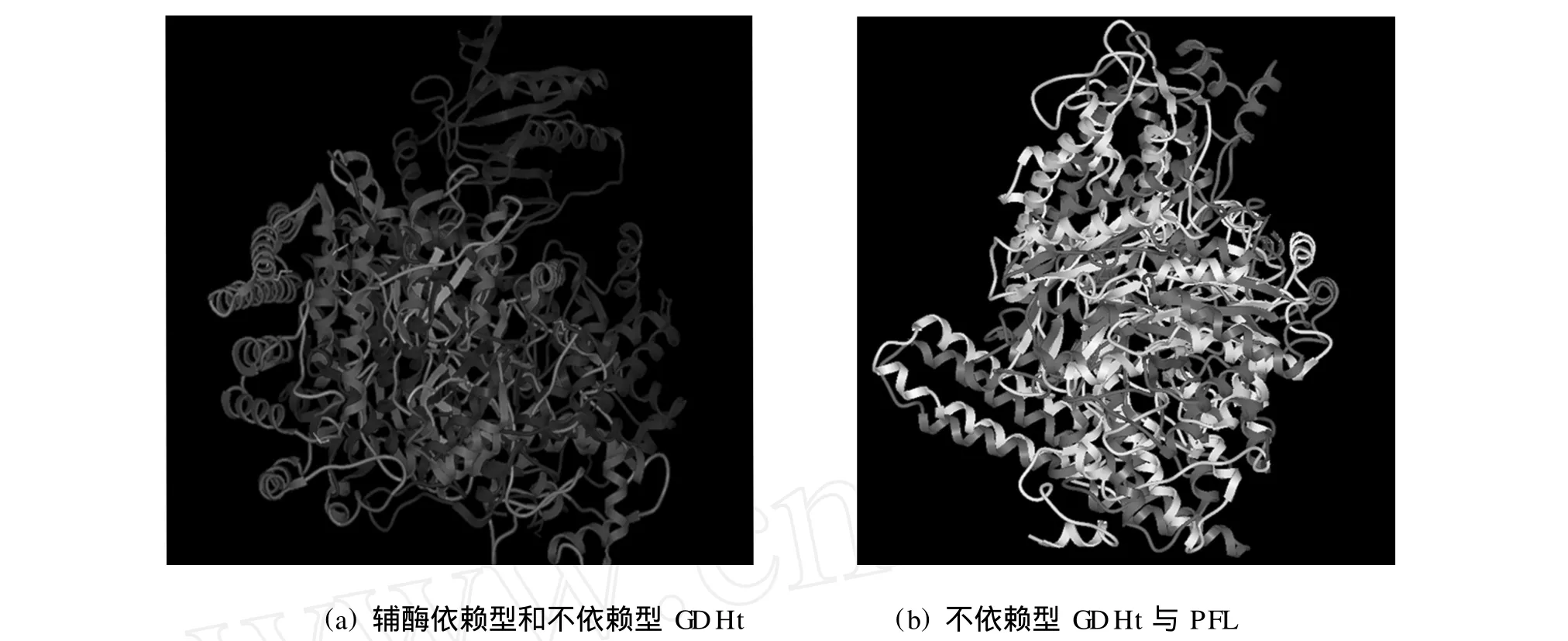
图8 三级结构重叠结果Fig.8 Overlapping of tertiary structures
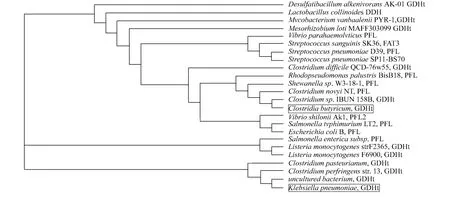
图9 两种GDH t的进化树分析Fig.9 Analysis of the phylogenetic tree of the two enzymes
从多序列比对得到的一段C**C**C看出,此结构域与Layer等[10]报道的Coproporphyrinogen-Ⅲoxidase中与[4Fe-4S]簇匹配的3~4个彼此间隔的半胱氨酸残基基团C**C**C匹配.因此,推测辅酶不依赖型GDH t借助SAM断裂所产生的活性5’-脱氧腺苷自由基替代B12起作用;而辅酶依赖型GDHt与一类同样依赖辅酶B12的GDHt亲缘性较近.当辅酶B12与GDHt结合时,其Co-C键发生均裂,产生一个5’-脱氧腺苷自由基团,引发一系列电子转移催化反应[11],而两者之间亲缘性较远.
综上所述,来自K.pneumoniae中依赖辅酶B12和C.butyricum中不依赖辅酶,其甘油脱水酶相似性较低.从两序列的对齐结果看,两条序列同源性较低.从SMART搜索结果可看出,C.butyricum中不依赖辅酶的甘油脱水酶及其再激活酶分别属于gly-Radical和Radical-SAM家族,多序列比对得到的一段富含半胱氨酸残基C**C**C的保守序列正是其共同特征.
因此,B12-independent GDH t的催化机制同于Radical-SAM家族其他成员,即借助S-adenosylmethionine代替辅酶B12起作用.
3 结束语
研究结果可为C.butyricum中的甘油脱水酶基因工程改造,得到兼性厌氧,产不依赖辅酶的GDHt提供理论依据.下一步研究是,通过定点突变等技术,改造此保守区域的半胱氨酸残基,使其在具备稳定酶活的同时对氧气有一定的抵御能力.
参考文献:
[1] BIEBL H,M ENZEL K,ZENGA P,et al.M icrobial p roduction of 1,3-p ropanediol[J].M icrobiology And Biotechnology,1999,52(3):289-297.
[2] 王剑锋,刘海军,修志龙,等.生物转化生产1,3-丙二醇的研究进展[J].化学通报,2001,64(10):621-625.
[3] STUBBE J,VAN DER DONKW A.Protein radicals in enzyme catalysis[J].Chemical Review s,1998,98(7):705-762.
[4] GUNH ILD L,DIRKW H,D IETER J,et al.Structure and function of radical SAM enzymes[J].Chemical Biology, 2004,8(5):468-476.
[5] CHEEK J,BRODERICK JB.Adenosylmethionine-dependent ironsulfur enzymes:Versatile clusters in a radical new role[J].Journal of Biological Inorganic Chemistry,2001,6(3):209-226.
[6] L IAO D I,DOTSON G,TURNER Jr I,et al.Crystal structureof substrate free form of glycerol dehydratase[J].Ino rg Biochem,2003,93(1/2):84-91.
[7] O’BRIEN J R,RA YNAUD C,CROUX C,et al.Insight into the mechanism of the B12-independent glycerol dehydratase from Clostridium butyricum:Preliminary biochemical and structural characterization[J].Biochemistry, 2004,43(16):4635-4645.
[8] SOFIA H J,CHEN G,HETZLER B G,et al.Rdiacal SAM,a novel p rotein superfamily linking unresolved steps in familiar biosynthetic pathways w ith radical mechanism s:Functional characterization using new analysis and info rmation visualization methods[J].Nucleic Acid Research,2001,29(5):1097-1106.
[9] HENSHAW T F,CHEEK J,BRODERICK JB.The[4Fe-4S]1+cluster of pyruvate formate-lyase activating enzyme generates the glycyl radical on pyruvate fo rmate-lyase:EPR-detected single turnover[J].Journal of the American Chemical Society,2000,122(34):8331-8332.
[10] LA YER G,VERFURTH K,MAHL ITZ,et al.Oxygen-independent cop roporphyrinogen-Ⅲoxidase HemN from Escherichia coli[J].Journal of Biological Chemistry,2002,277(37):34136-34142.
[11] TORA YA T.Radical catalysis of B12enzymes:Structure,mechanism,inactivation,and reactivation of diol and glycerol dehydratase[J].Journal of Cell and Molecular Life Science,2000,57(1):106-127.
Com parison between the B12-Dependen t and Independen t Glycerol Dehydratase
YANG Zhong-li,FANGBai-shan,YU Jin-cong, WANG Qing-hua,L IZi-jun
(Key Laboratory of Industrial Biotechnology Fujian Province,Huaqiao University,Quanzhou 362021,China)
In this paper,the coenzyme B12dependence of glycerol dehydratase between Klebsiella pneumoniae and Clostridia butyricum was compared.Their differences and similaritieswere analyzed w ith bioinfo rmatics.Results showed that these two enzymes belonged to two different familiesw ith low similarities.Searching the SMART database and the result also show s that the B12-independent glycerol dehydratase from Clostridia butyricum and its reactivate enzyme belong to gyl-Radical family and Radical-SAM family respectively,and the conserved sequence w hich is rich in half-cysteine obtained by multip le alignments is their common feature.
Klebsiella pneumoniae;Clostridia butyricum;coenzyme;glycerol dehydratase;vitamin B12;dependence
Q 55
A
(责任编辑:黄晓楠 英文审校:刘源岗)
1000-5013(2010)05-0542-06
2009-02-11
方柏山(1957-),男,教授,主要从事合成生物学的研究.E-mail:fangbs@hqu.edu.cn.
国家高技术研究发展(863)计划项目(2006AA 020103);国家自然科学基金资助项目(20676048, 30770059)
