高住低练对游泳运动员红细胞免疫分子表达及功能的影响
2010-09-06赵永才高炳宏丁树哲
赵永才,高炳宏,丁树哲
高住低练对游泳运动员红细胞免疫分子表达及功能的影响
赵永才1,高炳宏2,丁树哲3
目的:研究高住低练(HiLo)及恢复期女游泳运动员红细胞免疫功能的变化;方法:2周HiLo开始前、训练中及恢复1周后检测6名运动员红细胞免疫功能的变化,研究内容涉及红细胞CR1黏附功能和CR1、CD55、CD59分子表达;结果:2周HiLo期间RBC-C3bRR明显下降,RBC-ICR升高(P<0.05),恢复1周后,两个指标已恢复到训练前水平,红细胞CR1数量无明显降低,但恢复1周后CR1数量显著性升高(P<0.05);HiLo期间红细胞CD55、CD59数量相比训练前明显增加(P<0.05),而恢复1周后CD55、CD59表达继续增加并明显高于训练前和训练期间的水平(P<0.05);结论:2周HiLo明显抑制了运动员红细胞CR1免疫黏附功能,恢复1周后CR1黏附功能及数量已经恢复,CD55、CD59高表达有利于红细胞抵御补体的攻击,防止溶血。
游泳;女子;优秀运动员;红细胞CR1;高住低练;红细胞C3b受体花环率;红细胞免疫复合物花环率
红细胞不仅具有携带和运输O2和CO2的功能,在天然免疫系统与一些特异性免疫反应中发挥重要作用。红细胞免疫在运动医学领域也受到广泛关注,研究认为,适量的运动能够促进个体的红细胞免疫功能;过于强烈的应激则可抑制个体红细胞免疫功能[3]。
低氧训练是目前体育研究的热点,由于低氧加上训练所形成的双重刺激对运动员是一种较大的负荷,因此,这种刺激可能对红细胞免疫功能产生影响,针对高水平运动员低氧训练下红细胞免疫机能有何变化未见报道。运动员由于常年训练和参加比赛,各种应激刺激较多,在多重心理和生理的应激影响下,个体免疫系统就可能出现紊乱,因此,研究运动员的红细胞非特异性免疫功能有重要现实意义。本文以专业游泳运动员为研究对象,考察高住低练对红细胞免疫分子及其功能的影响,从红细胞免疫角度观察运动员对2周高住低练的适应情况,为运动训练提供信息。
1 研究对象与方法
1.1 研究对象
上海市游泳队高水平女运动员6名,运动训练年限3~4年,均出生于华东地区,身体健康并且无世居高原经历(表1)。

表1 研究对象基本情况一览表Table 1 Characteristics of Research Subjects
1.2 研究方法
1.2.1 实验安排
低氧环境采用上海体育科学研究所低氧训练实验室,可模拟出海平面到海拔6 000 m高度的大气氧分压。6名受试者进行连续2周的高住低练(HiLo),下午6:30进入低氧实验室,晚间8点低氧区开始达到预定模拟高度,早上6点起床,每天晚上低氧睡眠区暴露10 h,模拟高度为海拔2 500 m,白天在正常氧浓度下训练。
周一到周六训练,周日休息,白天训练按照计划进行,运动员作为一个游泳组在相同环境下进行训练,训练负荷相同,每天上午和下午分别进行1次训练,每次训练时间大约为2.5 h左右,以有氧训练强度为主。第1周每次训练完成5~6 km的运动量,第2周每次训练运动量调整为4~5 km,每周三、周五下午训练前进行大约1 h的瑞士球练习。游泳方式根据训练计划调整安排,以自由泳、蝶泳为主。
1.2.2 测试指标
前后总共取血4次,分别是HiLo前1次,HiLo每周结束后共2次,HiLo结束1周后1次。每次抽取2 ml血样并分为两部分,1 ml血液用于检测红细胞CR1(CD35)、CD55、CD59,另1ml血液用于检测红细胞C3b受体花环率(RBC-C3bRR)以及红细胞免疫复合物花环率(RBC-ICR)。
1.2.3 测试方法
RBC-C3bRR和RBC-ICR的检测参考郭峰[3]等人建立的方法,酵母菌等试剂由上海长海医院输血科提供。
红细胞CR1数量测试采用间接免疫荧光染色法流式细胞仪测定技术,用鼠抗人红细胞CR1单抗与一定量待测红细胞反应并洗涤,加入羊抗鼠荧光标记二抗后上流式细胞仪测定,计算出红细胞荧光染色平均强度,鼠抗人红细胞CR1 (CD35)单克隆抗体由丹麦DAKO公司提供,FITC标记羊抗鼠IgG荧光二抗由上海华美生物公司提供。
采用直接荧光标记流式细胞仪技术测定红细胞CD55、CD59数量,不同试管中分别加入鼠抗人CD55-FITC单克隆抗体和CD59-PE单克隆抗体,各管再加入PBS液,肝素抗凝新鲜血,充分混匀洗涤后,上机检测。每份标本检测至少10 000个红细胞,分析CD55、CD59在红细胞表面的相对表达量。
1.2.4 统计学方法
所有数据均输入SPSS 11.0统计软件,采用方差分析统计方法分析数据,所有数据以平均数±标准差表示,P< 0.05表示有显著性差异,P<0.01表示有非常显著性差异。
2 结果
2.1 HiLo不同时期运动员红细胞免疫黏附功能的变化
研究发现,HiLo对运动员红细胞CR1免疫黏附功能产生了明显影响,HiLo影响最大的是RBC-C3bRR,即CR1黏附免疫复合物的活性。
HiLo 1周后RBC-C3bRR从12.13%下降到7.84%,与训练前比较具有非常显著性差异(P<0.01);HiLo 2周后RBC-C3bRR依然处于比较低水平,与训练前相比较具有显著性差异(P<0.05),但与HiLo 1周后比较已经有了开始恢复的趋势;HiLo结束后1周RBC-C3bRR已经回升到11.22%,与训练前比较无显著性差异(P>0.05),与HiLo 1周后比较有显著性差异,这表明经过1周的恢复,运动员红细胞CR1黏附能力已经得到恢复。
与RBC-C3bRR不同,反映红细胞黏附免疫复合物状态的RBC-ICR呈现相反的变化规律,HiLo 1周后就开始升高,但还无显著性差异;HiLo 2周后RBC-ICR已经进一步升高到10.99%,与训练前比较具有显著性差异(P< 0.05);恢复期1周后RBC-ICR已经下降到8.09%,虽然还是高于训练前,但与之比较已无显著性差异(P>0.05), (表2与图1)。

表2 运动员HiLo不同时间RBC-C3bRR和RBC-ICR变化情况一览表Table 2 Changes of RBC-C3bRRand RBC-ICR during Different Time in HiLo
2.2 HiLo不同时期运动员红细胞CR1数量变化
红细胞CR1(Erythrocyte Complement Receptor 1)是红细胞免疫黏附功能的物质基础,红细胞主要通过CR1黏附被补体调理后的免疫复合物(IC),红细胞CR1数量和活性的变化直接影响到红细胞免疫黏附和转运功能。通过流式细胞仪来检测CR1在红细胞上的荧光表达强度,研究发现,在2周HiLo中,运动员红细胞上的CR1比较稳定,不论是HiLo第1周,还是HiLo 2周后,红细胞CR1表达与HiLo前比较均无显著性差异(P>0.05),但是具有数量减少的趋势;恢复1周后红细胞CR1数量明显升高,无论与HiLo前比较还是与HiLo 1周、2周比较都具有显著性差异(P<0.05),这表明,2周HiLo期间对运动员红细胞CR1影响不大,而恢复期内存在某种机制并使CR1表达明显增加(表3和图2)。

表3 运动员HiLo不同时间CR1变化一览表Table 3 . Changes of CR1 during Different Time in HiLo
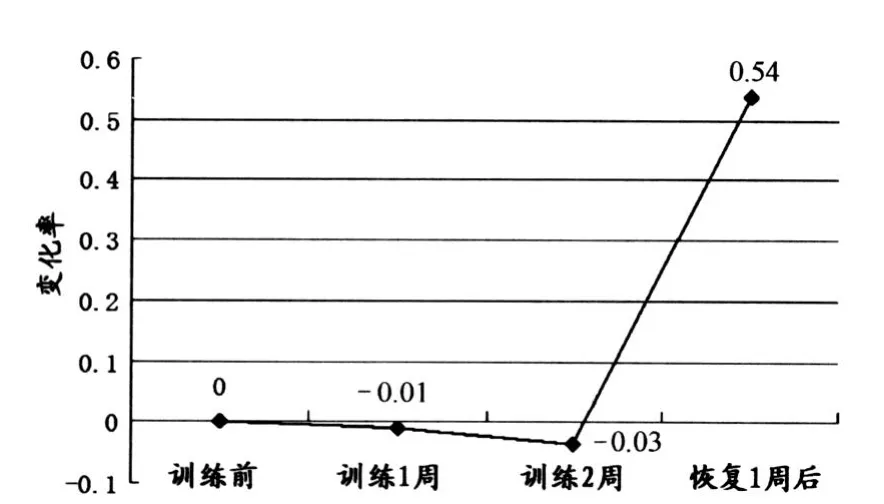
图2 HiLo过程中CR1相对于训练前的变化率示意图Figure 2. Change R ate of CR1 in HiLo Comparing to before T raining
2.3 HiLo不同时期运动员红细胞CD55、CD59数量变化
HiLo训练模式能够明显提高红细胞CD55和CD59两种补体活化抑制因子的表达水平,但是,这两种蛋白的变化规律稍有不同。CD55在训练不同阶段变化明显,在整个训练过程中不断升高,到了训练2周后,CD55表达含量已经远高于训练前水平,与之比较具有非常显著性差异(P <0.01);而且,恢复期内依然延续这种趋势,此时,与训练前比较CD55表达含量提高了56.83%(表4),不但与训练前比较具有非常显著性差异(P<0.01),而且与训练1周和训练2周后比较也具有非常显著性差异(P<0.01)。
CD59在HiLo 1周后迅速升高,并且与训练前比较具有显著性差异(P<0.05);但在训练2周后有所降低,且与训练前比较无显著性差异(P>0.05);恢复1周后CD59表达又重新升高并提高了37.25%,与训练前比较具有非常显著性差异(P<0.01),CD59表达总体上呈上升趋势。
总体上看,CD55和CD59两种免疫分子对低氧训练比较敏感,训练过程中上升比较明显,尤其是恢复期内上升更加明显(表4)。

表4 HiLo过程中CD55和CD59的变化一览表Table 4 . Changes of CD55 and CD59 in HiLo
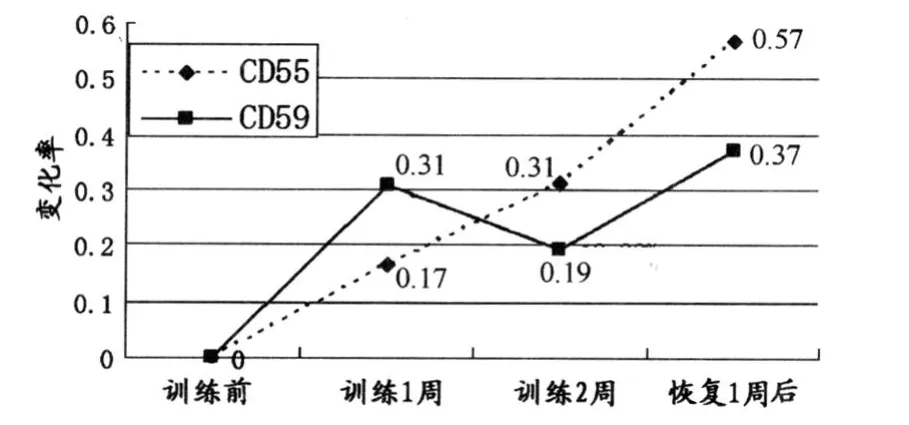
图3 HiLo过程中CD55、CD59相对于训练前的变化率示意图Figure 3. Change R ate of CD55,CD59 in HiLo Comparing to before T raining
3 讨论
3.1 HiLo对红细胞CR1黏附功能的影响
酵母菌被血浆补体调理后,酵母菌上的C3b能够与红细胞I型补体受体(CR1)结合,若干个酵母菌结合在红细胞上从而形成RBC-C3bRR。没有经过补体调理的酵母菌同样可以与红细胞CR1上IC中的C3b结合,从而形成RBC-ICR。目前认为,RBC-C3bRR降低同时,RBC-ICR也降低为原发性红细胞免疫功能低下;如果RBC-C3bRR降低,而RBC-ICR升高,为继发性红细胞免疫功能低下;两项指标都升高,为红细胞免疫功能亢进与紊乱[1]。
研究表明,HiLo抑制了运动员红细胞免疫黏附能力, HiLo 1周后RBC-C3bRR明显低于HiLo前水平,表明Hi-Lo刺激对红细胞CR1活性产生了明显的抑制作用,使得红细胞黏附酵母菌能力显著降低,仅1周时间就出现这样情况,说明红细胞的免疫黏附功能对HiLo训练模式比较敏感;恢复1周后再检测红细胞免疫功能,此时RBCC3bRR已经迅速恢复,与HiLo前比较已经无显著性差异且明显高于HiLo 1周后的水平,表明红细胞黏附能力恢复较快;总体上讲,本次HiLo过程中运动员红细胞免疫黏附能力呈现的特点是降低较快,而训练结束后恢复也较快。
RBC-ICR反映的是红细胞上黏附的IC状态,花环率越高说明红细胞承载的IC越多,即红细胞上IC结合位点被占用也越多。HiLo期间RBC-ICR不断升高并在HiLo 2周后达到最高,说明此时机体产生的IC也比较多,大量的IC与红细胞CR1上结合位点结合,引起红细胞黏附能力的下降。本次研究对象进行HiLo期间,RBC-ICR在训练期不断上升说明IC不断累积,恢复1周后红细胞上的IC数量回归正常水平。
本研究发现,RBC-C3bRR和与RBC-ICR的变化相反,即受体花环率下降的同时免疫复合物花环率上升,表明本次受试者在HiLo过程中红细胞免疫能力下降属于继发性免疫功能低下,即大量IC占据过多的CR1结合位点,使得CR1活性下降。
张缨[12]等人发现,4周HiLo后,大学生足球运动员RBC-C3bRR明显下降,而RBC-ICR显著性上升,表明较长时间的HiLo能引起红细胞继发性免疫下降,本次研究结果也发现这样的变化趋势,说明长短不一的HiLo都可引起人体红细胞免疫出现继发性功能下降。张利朝[11]等人发现,一次中小强度的运动能引起RBC-C3bRR和RBCICR同时升高。胡琪琛[5]等发现,安静状态下运动员与大学生RBC-C3bRR比较无明显差异,45%˙VO2max强度及85%˙VO2max强度运动后两个群体的RBC-C3bRR都下降,但在无氧运动时大学生RBC-C3bRR较运动员下降更为明显。
以上研究显示,有氧运动或一次中、小强度运动增强红细胞免疫,和本次研究不同可能是众多因素而致。本实验受试者是高水平女子游泳运动员,训练负荷不是有氧健身运动所能比拟,运动和低氧双重刺激较大,可能是较大的训练负荷引起IC增多,加重了红细胞承载IC的负担并引起了RBC-ICR持续升高,抑制了红细胞免疫黏附功能。不同运动负荷、不同受试者是引起红细胞免疫变化研究结果不同的因素。
HiLo抑制红细胞免疫的原因比较复杂,研究证实,低浓度β-内啡肽(β-EP)促进红细胞免疫黏附功能,而高浓度的β-EP则起抑制作用,还发现促肾上腺皮质激素等一些激素也能抑制红细胞免疫[9]。而β-EP和促肾上腺皮质激素在一般中小强度运动变化并不明显,一次性急性运动,尤其是强度达60%˙VO2max以上,外周血的β-EP水平才能显著性提高[14]。HiLo的双重负荷可能引起这些免疫抑制类激素的升高并抑制了红细胞免疫功能。大负荷运动氧化应激可能也是抑制因素,Pialoux V[20]等人最近研究表明,18天的HiLo明显增加了运动员血清AOPP含量,血细胞氧化应激水平增加。Heinicke I[16]的研究也表明,中等高原低氧环境是运动员血液氧化应激水平升高的主因,以上低氧和运动负荷可能抑制了红细胞CR1免疫黏附能力。
3.2 HiLo对红细胞CR1的影响
本研究发现,HiLo 2周内,运动员红细胞上CR1具有下降趋势,但还不具显著性,即红细胞CR1表达对2周的HiLo并不敏感,2周HiLo没有对运动员红细胞上这种关键免疫分子的数量产生明显影响。本研究中,红细胞CR1黏附能力下降,但CR1数量并没有显著性下降,因此,笔者认为,HiLo中CR1的结构功能发生了变化,引起了CR1黏附活性的降低。可认为本次HiLo所引起的免疫抑制是红细胞CR1结构功能变化而引起的抑制,与CR1数量变化关系不大,红细胞上大量IC积累也是引起红细胞免疫黏附功能下降的另一个因素。
本次研究和近年几项研究结果不太一致。有研究[7]发现,足球专项大学生在高住高练低训4周过程中CR1发生明显改变,低氧暴露10 h后CR1明显下降,2周后已经恢复到训练前水平,HiLo 3周后CR1又明显低于训练前水平。本研究发现2周HiLo后,CR1与训练前比较没有明显降低,和大学生高住高练低训2周后CR1情况一致。可能红细胞CR1的调节能力较强,2周HiLo还不能影响到红细胞上CR1的数量,低氧训练3周或4周可能发生变化。
Thomsen BS[21]等人发现,短时间大负荷运动后,普通人群和高水平运动员红细胞CR1都不能明显改变。从一次性运动对红细胞CR1影响结果来看,红细胞CR1比较稳定,中、小负荷的运动不能明显改变其数量,可能3周以上低氧训练才明显改变其数量,而本研究的HiLo只是影响到CR1黏附活性。
以往的研究未涉及到HiLo结束以后恢复期CR1的变化,本研究发现,恢复1周后红细胞CR1数量显著性增加,具体机制还无法明确解释,成熟红细胞没有DNA,不能翻译合成蛋白质,因此,红细胞上CR1增加只能根据现有报道进行推测。HiLo中低氧因素能促进促红细胞生成素(EPO)的生成,加快红细胞的生成。国外[17]发现,EPO治疗后可以明显增加人体红细胞CR1数量,提高人的红细胞黏附功能,新生成熟红细胞可能具有更多的CR1,这是EPO提高红细胞CR1的一种机制。EPO促红细胞生成需要一个过程,因而红细胞数量在HiLo期间一般要2周以后才能达到峰值[4],运动训练中血液流速加快,细胞摩擦损伤较多,红细胞更容易被破坏,网织红细胞不断转化为新生的红细胞,而新生红细胞增加可引起更多CR1表达。另外,红细胞内部储存有大量蛋白质,包括未表达在细胞膜上的CR1,红细胞膜上具有内啡肽等各种受体,HiLo后红细胞也有可能接受外来信号,加快CR1的转运表达,这也可能是CR1升高的另一个原因。总之,恢复1周后CR1的高表达有利于恢复期内进一步清除IC,加快机能恢复,但机制还不清楚,有待进一步研究。
3.3 HiLo对红细胞CD55、CD59的影响
3.3.1 红细胞CD55、CD59的免疫功能
正常人体细胞上具有多种多样的补体调控蛋白,可抑制补体的激活免受损伤。CD55既可阻止C3、C5转化酶的装配,又能使已形成的C3、C5转化酶失去稳定性,抑制补体攻击单位的活化。阵发性血红蛋白尿病人及敲除CD55实验鼠的红细胞因缺乏CD55,对补体介导的溶血作用高度敏感,从而导致自身溶血性贫血[10,18]。CD59通过与补体攻膜复合物装配过程中的C8和C9结合,干扰C9插入细胞膜内或C9的多聚化来保护宿主细胞免受补体攻击;目前研究发现,CD59还是淋巴细胞上CD2的天然配体,能扩大免疫突触的信号转导[15,22],能够有效维持淋巴细胞的特异性免疫功能。
CD55、CD59发挥防御作用时间不同,CD55在补体激活前段,CD59在补体激活末段,二者前后呼应并调节补体介导的溶细胞反应,故二者任一方面缺失或平衡紊乱都可能对机体的红细胞免疫产生影响。
3.3.2 HiLo引起运动员红细胞CD55、CD59升高
本研究发现,2周HiLo过程中,红细胞CD55训练期和恢复期表达明显增加(表4和图3),运动员在训练1周后CD55数量增加,说明红细胞的自我防护机制已经启动;到了训练2周后,当RBC-ICR达到最大时,即红细胞黏附IC数量达到最高时,CD55数量已明显高于训练前水平(P<0.01)。IC在红细胞上的积累容易导致红细胞膜更加频繁地成为补体系统攻击的对象,红细胞被破坏将对运动能力产生负面影响,因此,CD55数量的上升有利于红细胞维持自身的稳定性,防止大量细胞溶血。HiLo期间及恢复期CD55的上升是机体对身体环境变化的一种适应。关于常氧下运动对CD55的影响未见报道,本次研究中CD55上升是低氧因素所致,还是运动所引起,以后有必要进一步考察。
CD59变化总体趋势同CD55相似,HiLo有提高CD59的效应(表4和图3)。但第2周末CD59下降同CD55的变化不同。CD59的主要功能就是抑制补体活化后期攻膜复合体在红细胞上形成,因此,训练期CD59数量的上升是机体对环境变化的适应性调节,通过这种效应,减少红细胞遭受攻击的强度,有效维持红细胞运输氧,转运IC的功能。目前仅一篇报道[14]发现,大学生在高住高练低训初期10 h低氧暴露后CD59显著性下降,而训练2周和3周后和训练前比较无明显变化,而训练4周后CD59又明显下降。大学生HiHiLo 2周后CD59与训练前比较无显著性差异和本次研究相似,至于HiLo早期暴露是否像高住高练低训出现CD59下降还不知道,有待进一步研究。
HiLo引起红细胞CD55、CD59增加原因复杂,CD55、CD59属于锚定蛋白,环境变化时,红细胞可以释放一些CD55、CD59,或者能结合可溶性的CD55、CD59。而本次训练总体上引起红细胞膜上CD55、CD59的上升,训练初期红细胞还不能立即大量生成的情况下,CD55、CD59的上升极有可能是由于环境的变化引起糖基磷脂酰肌醇(GPI)结合可溶性CD55、CD59的能力增强,大量血浆里的CD55、CD59被结合到红细胞上。红细胞在HiLo刺激后胞质中的一些蛋白质可能更多被转运表达在细胞膜上,从而引起CD55、CD59含量上升。也有报道发现,红细胞CR1和CD55、CD59具有相互抑制的负相关关系[2,6],认为CR1的减少改变了红细胞膜的结构,红细胞更容易结合CD55、CD59,HiLo期间CR1有减少趋势,可能这个机制引起了CD55、CD59在初期的增加,而恢复期内CD55、CD59和CR1同时升高可能存在另外一种机制。
研究发现,重组EPO可以增加红细胞CD55和CD59表达并可用于治疗溶血引起的贫血,病人使用重组EPO后红细胞膜CD55和CD59增加,而且限制了补体的活化并抑制了溶血的发生[19]。国内研究发现,女子中长跑运动员网织红细胞参数在不同时段显著增加,12天以后网织红细胞计数显著性提高[8],EPO可能通过低氧训练中网织红细胞变化改变免疫分子的数量。但问题在于EPO到底是通过增加新生红细胞引起CD55、CD59增加,还是EPO通过信号转导引起红细胞内CD55、CD59转运增强,这些问题目前还不清楚,以后有必要研究EPO和相关免疫分子变化的关系,在较长时间里考察运动员红细胞这些免疫分子的变化规律,为合理安排训练负荷提供依据。
4 结论
1.HiLo 2周期间RBC-C3bRR明显下降,RBC-ICR升高,运动员红细胞免疫黏附功能明显受到抑制,恢复1周后红细胞黏附功能已经恢复,运动员对本次训练是适应的,红细胞免疫恢复较快。
2.HiLo 2周期间红细胞CR1数量变化不明显,训练期间红细胞免疫黏附功能下降主要是CR1结构功能改变而引起,恢复期CR1数量明显增加可能与新生成熟红细胞增加有关,CR1增加有助于恢复期进一步清除IC。
3.HiLo 2周期间红细胞CD55、CD59数量相比训练前增加,而恢复1周后CD55、CD59增加更加明显,CD55、CD59表达升高有利于红细胞抵御补体的攻击,防止溶血。
4.总体上看,HiLo 2周对运动员红细胞免疫没有产生长时间的免疫抑制,从红细胞免疫角度来看,以后的训练可以延长训练周期或增加训练负荷。控实验研究.红细胞免疫学新探(上卷)[M].南京:南京大学出版社,1993:34-37.
[10]王海滨.红细胞膜分子的表达及意义[J].深圳中西医结合杂志,2002,12(1):20-26.
[11]张利朝,张盈华,陈渝宁.健康人运动前后红细胞免疫功能与细胞数的变化及关系[J].细胞与分子免疫学杂志,2001,7(12): 197.
[12]周帆扬,张缨,胡扬.4周高住低训对红细胞免疫功能的影响[J].体育科学2003,23(6):132-134.
[13]朱荣,张缨,蔡爱洁.高住高练低训对足球运动员红细胞CD58、CD59和T淋巴细胞CD2表达的影响[J].中国运动医学杂志, 2006,25(3):320-322.
[14]ART T.Plasmaβ-EP response of through bred houses to maximal exercise[J].Veternary Res,1991,135(21):499-503.
[15]DECKERT M,TIECHIONI M,MARI B,et al.The glycosylphos phatidyinositol a-nchored CD59 proteinstimulates both cell receptor ZAP-70 dependent and inde-pendent signaling pathways in T cells[J].Eur J Immunol,1995,25(7):15-22.
[16]HEINICKE I,BOEHLER A,RECHSTEINER T,et al.Moderate altitude but not additional endurance training increases markers of oxidative stress in exhaled breath condensate[J]. Eur J Appl Physiol,2009,106(4):599-604.
[17]HEBERT LA,BIRMINGHAM DJ,DILLON JJ,et al.Erythropoietin therapy in humans increases erythrocyte expression of complement receptor type 1(CD35)[J].J Am Soc Nephrol, 1994,4(10):1786-1791.
[18]MORGAN J,SPENDLOVE I,DURRANT L G.The role of CD55 in protecting the tumour environment from complement attack[J].Tissue Antigen,2002,60(3):213-223.
[19]OHI H,TAMANO M,SUDO S,et al.Recombinant EPO therapy increases erythrocyte expression of complement regulatory proteins[J].Am J Kidney Dis,2003,41(1):179-185.
[20]PIALOUX V,BRUGNIAUXJV,FELLMANN N,et al.Oxidative stress and HIF-1alpha modulate hypoxic ventilatory responses after hypoxic training on athletes[J].Respir Physiol Neurobiol,2009,167(2):217-220.
[21]THOMSEN BS,RODGAARD A,TVEDE N,et al.Levels of complement recaptor type one(CR1,CD35)on erythrocytes, circulating immune complexes and complement C3 split products C3d and C3c are not changed by short-term physical exercise or training[J].Int J Sports Med.1992,13(2):172-175.
[22]YOMTOVIAN R,PRINCE GM,MEDOF ME.The molecular basis of paroxysmal nocturnal hemoglobulinuria[J].Transfusion,1993,33:852.
[1]郭峰.红细胞免疫及其调节功能的测定方法[J].免疫学杂志, 1990,6(1):60-62.
[2]郭峰,钱宝华,花美仙.肿瘤患者红细胞天然免疫分子CD35、CD59相关性研究[J].中国免疫学杂志,2004,20(2):136-137.
[3]郭峰,钱宝华,张乐之.现代红细胞免疫学[M].上海:第二军医大学出版社,2002.
[4]高颀,田野,胡扬.高住低训对优秀女子跆拳道运动员运动能力和血象的影响[J].中国运动医学杂志,2006,25(3):304-305.
[5]胡琪琛,郭峰.全国红细胞免疫理论与实践协作成果综述[A].红细胞免疫学新探[M].南京:南京大学出版社,1993:239-246.
[6]刘辉,罗平.银屑病患者红细胞天然免疫分子CD35与CD59/ ECKR相关性变化的初步研究[J].临床军医杂志,2003,31(5): 1-3.
[7]罗琳,张缨.高住高练低训对足球运动员红细胞CD35数量及活性变化的影响[J].中国运动医学杂志,2006,25(4):395-398.
[8]刘媛媛,曾凡星,胡扬.网织红细胞在低氧训练中变化规律的研究[J].体育科学,2006,26(1):49-52.
[9]孙志扬,郭峰,过宗南.β-内啡肽对正常人红细胞免疫功能的调
Effect of HiLo on the Expression of Immune Molecules and Immune Function in the Erythrocyte of Swimmers
ZHAO Yong-cai1,GAO Bing-hong2,DING Shu-zhe3
Objective:To study the changes of erythrocyte immune function in six female swimmers during and after two weeks Hypoxic training(HiLo was applied).Method:Indexes of erythrocyte adhesion function and the expression of erythrocyte CR1、CD55、CD59 were measured at every weekend.Result:During the HiLo,RBC-C3bRR decreased and RBC-ICR increased significantly compared with the conditions before training(P<0.05).One week after training,RBC-C3bRR and RBC-ICR had already recovered.CR1 did not decreased significantly during the training but increased significantly one week after training(P<0.05).The expression of CD55、CD59 increased significantly during the training and continued to increased after training(P<0.05).Conclusion:Two weeks HiLo suppressed adhesion function of CR1 and the erythrocyte immune function recovered one week after training.Enhanced expression of CD55、CD59 was beneficial to RBC from being attacked by complement system.
CR1of erythrocyte;HiLo;RBC-C3bRR;RBC-ICR
G804.7 文献标识码:A
1000-677X(2010)06-0066-06
2009-10-20;
2010-05-10
上海市体育局局管课题(04J T0046)。
赵永才(1980-),男,陕西渭南人,讲师,硕士,主要研究方向为人体机能评定,Tel:(0315)3863302,E-mail: zyc8256@sina.com;高炳宏(1971-),男,副研究员,博士,主要研究方向为高原和低氧训练的理论和实践,E-mail:gaobinghong@126.com。
1.唐山师范学院体育系,河北唐山063000;2.上海市体育科学研究所,上海200030;3.华东师范大学体育与健康学院,上海200241 1.Tangshan Teacher’s College,Tangshan 063000,China;2.Shanghai Research Institute of Sports Sciences, Shanghai 200030,China;3.East China Normal University,Shanghai 200241,China.
