味蕾细胞的Percoll梯度离心纯化技术研究
2010-08-27王腾浩秦玉梅张根华邓少平
王腾浩, 秦玉梅, 张根华, 邓少平*
(1.浙江工商大学食品与生物工程学院,浙江杭州 310035;2.常熟理工学院生物与食品工程学院,江苏常熟 215500)
味蕾细胞的Percoll梯度离心纯化技术研究
王腾浩1, 秦玉梅1, 张根华2, 邓少平*1
(1.浙江工商大学食品与生物工程学院,浙江杭州 310035;2.常熟理工学院生物与食品工程学院,江苏常熟 215500)
以ICR小鼠的菌状味蕾细胞为研究对象,利用Percoll梯度离心技术纯化小鼠菌状味蕾细胞,通过台盼蓝染色和免疫组织化染色方法分别比较纯化前后的味蕾细胞存活率与纯度的变化,应用透射电镜从超微结构鉴定味蕾细胞。结果显示:通过不连续的Percoll密度梯度离心法对味蕾细胞进行纯化,细胞分层效果明显,主要位于体积分数20%与40%的Percoll工作液之间;免疫组化结果表明:纯化后味蕾细胞的纯度显著提高,从10%提高到65%(P<0.01),台盼蓝染色结果显示:纯化后细胞活度达94%,电镜则从超微结构上证实了纯化的细胞为味蕾细胞。
味蕾细胞;纯化技术;Percoll;超微结构
味蕾是哺乳动物味觉的主要感觉器,主要分布在舌、上软腭、咽、喉和食道上部[1]。舌上皮中有4种不同空间分布的舌乳头(lingual papille):丝状乳头(filiform papillae,FI)、菌状乳头(fungiform papillae,FF)、叶状乳头(foliate papillae,FL)和轮廓状乳头(circumvallate papillae,CV),其中FF、CV、FL乳头因含味蕾而被称为味乳头(gustatory papillae)[2]。FF乳头主要位于舌前部三分之二的区域,哺乳动物的每个FF乳头含一到多个味蕾[3]。每个味蕾有50~150个细胞组成,这些细胞根据其超微结构特征将这些细胞分为4种类型[4]:Ⅰ型细胞(暗细胞)、Ⅱ型细胞(亮细胞)、Ⅲ型细胞(中间细胞)和Ⅳ型细胞(基细胞)。其中Ⅱ型和Ⅲ型细胞被认为是味觉感受细胞,已成为味觉生物学研究的热点。随着味蕾细胞分离方法的建立和发展,味蕾细胞的研究已经取得长足的进展。如何获取大量高纯度、高活性的味蕾细胞仍是亟待解决的问题。
味蕾细胞是特化的上皮细胞,对微环境的要求比较严格,且细胞在形成之后平均每十天更新一次,而培养的味蕾细胞不具备增殖功能[7],故很难通过细胞培养的方法来获取大量味蕾细胞。现在味蕾细胞的分离技术相对较少,主要有直接分离法、微吸管吸取法和两步酶解法[5,6],所分离的细胞在数量和纯度上均尚难以满足对味蕾细胞离体研究的需要。作者通过酶-机械法获取细胞悬液,使用不连续的Percoll密度梯度离心法分离纯化味蕾细胞,通过优化条件建立了一套有效的味蕾细胞分离纯化技术,为离体味蕾细胞生理生化特性及味蕾细胞传感器研究提供了一定的参考依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周ICR小鼠购自浙江省医学科学院实验动物中心。
1.1.2 主要试剂 IMDM培养基、胎牛血清(fetal bovine serum,FBS)、青霉素与链霉素均购自Gibco公司;MCDB 153、胶原酶Ⅱ(collagenaseⅡ)、中性蛋白酶Ⅱ(dispaseⅡ)、胰岛素(insulin)均购自Sigma公司;HEPES购自北京鼎国生物技术有限公司、细胞角蛋白(Cytokeratin,CK8)购自Epitomics公司,即用型SABC免疫组化染色试剂盒购自武汉博士德生物工程有限公司,其他试剂均为分析纯。1.1.3 培养基及主要试剂的配制 参考Ozdener等[8]的培养基配置方法,IMDM培养基中添加10% FBS,1:5 MCDB 153,50 ng/mL胰岛素和100 U/ mL青霉素与100μg/mL链霉素。
Tyrode溶液:NaCl 7.65 g,KCl 0.37 g,CaCl20.89 g,MgCl20.20 g,HEPES 2.38 g,葡萄糖1.80 g,丙酮酸钠1.10 g,NaHCO30.42 g,p H 7.4。无钙Tyrode溶液,省略CaCl2。
1.2 方法
1.2.1 味蕾细胞悬液的制备 取6~8周ICR小鼠CO2致死,断头后取舌,舌剪至CV状乳头边缘处。Tyrode溶液清洗舌头表面的血迹,清洗完毕放入无钙Tyrode溶液中。用5 ml一次性注射器将0.1~0.3 mL的混合酶液(1∶1混合的1 mg/ml胶原酶Ⅱ+3 mg/ml中性蛋白酶Ⅱ)注入舌上皮与其下的肌肉层之间,注射器针头要一直伸至舌尖边缘后缓慢地注射酶液至舌肿胀,舌背面和侧面少量多次注射酶液。无钙Tyrode溶液中孵育4~6 min,用眼科镊将上皮与肌肉层轻轻剥离。将剥离的上皮迅速放入新的Tyrode溶液中,用眼科剪将含有FF乳头的舌前部1/3区域剪下,置于冰浴中的Tyrode溶液中备用。将含有FF乳头的上皮切成大约1 mm2的小碎片,放入含有质量分数0.25%胰蛋白酶和0.05%EDTA消化液的培养皿内,37℃、体积分数5%CO2培养箱内消化5~10 min,得细胞悬液。
1.2.2 Percoll离心液梯度分离
1)Percoll工作液的制备 将Percoll母液和Percoll稀释液按表1所列方案配制Percoll各密度梯度溶液。用长针头注射器从高密度向低密度逐层放置,有时相邻两层Percoll比重相差不大时,可将Percoll液放入注射器中,小针头斜面紧贴管壁,任其自然慢慢流下。
2)装样 样品体积和细胞浓度根据不同细胞而异,一般加样体积不宜过大,细胞浓度也不可过高,否则会影响细胞的分离和回收。
3)Percoll离心液梯度的选择 参考Seta等[9]的方法(1997)并对Percoll工作液进行改进,简要过程为:先通过在50 mL离心管中加入各种浓度的Percoll工作液各3 mL,浓度从高到低铺于管中,后加入4 mL 1×107~1×108个/mL细胞悬液,观察细胞主要集中区域,选取细胞分离纯化的Percoll梯度浓度。通过实验选取得出用于纯化味蕾细胞的Percoll工作液质量分数为70%、40%和20%。用选取的浓度梯度采用两次离心法对味蕾细胞进行纯化。如图1为3层不同密度的Pecoll液叠加时的实物图。从下到上分别为质量分数70%、40%和20%的Percoll溶液。
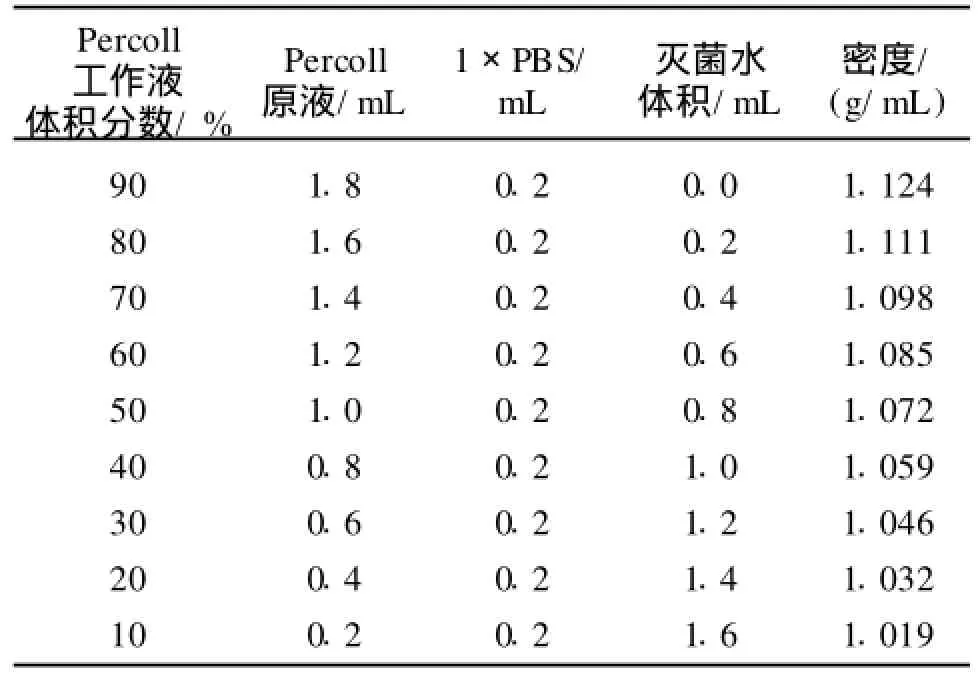
表1 Percoll工作液配制表Tab.1 Preparation of Percoll solution of different concentration

图1 不同密度Percoll溶液叠加图Fig.1 Discontinuous gradients of three Percoll working solution with the concentration of 70%,40% and 20%from top to bottom
4)味蕾细胞的纯化 将细胞悬液铺于上述不连续密度梯度的Pecoll分离液中,在离心管中先静置30 min,然后25℃下1 200 r/min离心6 min。分离的细胞绝大部分位于在两层Percoll工作液的交界面时,逐层去除Percoll液后收集界面部位的细胞。收集含有Percoll液的细胞用培养培养液洗涤两次,计数调整细胞浓度后备用。
1.2.3 ABC免疫组化评估味蕾细胞的纯度 制作细胞爬片,体积分数4%多聚甲醛4℃固定60~90 min。室温1份体积分数30%H2O2与50份纯甲醇的混合液中浸泡30 min,以灭活内源性过氧化物酶,蒸馏水1~2次。后按博士德试剂盒说明操作。DAB显色封片后普通光学显微镜下观察。所使用一抗为兔抗CK8的单克隆抗体,稀释度1∶500。实验设阴性对照,一抗用PBS代替。
1.2.4 味蕾细胞的超微结构鉴定 纯化的细胞悬液1 000 r/min离心4 min,去上清,将细胞悬浮于体积分数2.5%的戊二醛溶液中4℃固定过夜。倒掉固定液,用0.1 mol/L,p H 7.0的磷酸缓冲液漂洗样品3次,每次15 min,然后用质量分数1%的锇酸溶液固定样品1~2 h。倒掉固定液,用0.1 mol/ L,p H 7.0的磷酸缓冲液漂洗样品3次,每次15 min。用梯度体积分数(50%,70%,80%,90%和95%)的乙醇溶液对样品进行脱水处理各15 min,再用100%的乙醇处理一次20 min,最后过度到纯丙酮处理20 min。用包埋剂与丙酮的混合液V(包埋剂)∶V(丙酮)=1∶1处理样品1 h,然后用包埋剂与丙酮的混合液V(包埋剂)∶V(丙酮)=3∶1处理样品3 h,纯包埋剂处理样品过夜。将经过渗透处理的样品包埋起来,70℃加热过夜,即得到包埋好的样品。样品在Reichert超薄切片机中切片,获得70~90 nm的切片,该切片经柠檬酸铅溶液和醋酸双氧铀的体积分数50%乙醇饱和溶液各染色15 min,用日本J EOL公司的J EM-1230型透射电镜观察。
1.2.5 味蕾细胞活力测定 用台盼蓝染色法测定味蕾细胞的活力。将纯化前、后的味蕾细胞悬液的密度各调至1×106/mL,取9滴细胞悬液滴入试管,加入1滴质量分数0.4%台盼蓝染色,混匀,滴在计数板上。此时由于死细胞的细胞膜被破坏,细胞被染成紫蓝色,而活细胞不被染色。3 min内在显微镜下用血细胞计数版分别计数活细胞和死细胞的数量,按下式计算味蕾细胞的存活率。

2 结果与讨论
2.1 不同梯度层味蕾细胞形态和活力
实验采用离心前将细胞悬液在离心管中先静置30 min,使细胞悬液中的味蕾细胞下沉,以提高分离效果。25℃、1 200 r/min离心6 min,离心后细胞主要集中在各浓度液面交界处,各层内部细胞分布较少。各个细胞聚集层的细胞形态有明显差异,如图2所示,原细胞悬液中混有大量杂细胞和上皮碎片(图2(A),且活性相对较低,计数1 895个细胞,其中413个台盼然染色阳性,成活率为78.21%,经纯化后体积分数20%Percoll溶液与40%Percoll溶液的液面交界处的分离物以梭形细胞为主,混有少量圆形细胞和扁平细胞(图2(C)),从形态上判断味蕾细胞主要集中在这一层,将位于此层的细胞清洗重悬再纯化,混杂细胞的数量会进一步减少。20%与原液层之间主要为一些内径在5~10μm且大小均匀的圆形细胞(图2(B)),最下层的交界面则较多地聚集了一些内径为20~30μm的细胞(图2(D)),离心管底部有大块的上皮碎片。参照表1数据可知小鼠味蕾细胞的密度主要集中在1.03-1.06 g/mL之间,比Seta[10]得出的大鼠的密度要小,并且介于外周非味觉上皮细胞的密度之间。纯化后细胞活性有较大提高(计数了2 478个细胞,其中131个台盼蓝着色阳性,成活率为94.71%),主要原因可能是因为纯化前含有大量非味觉上皮细胞,这些细胞在分离过程过受损所致。上述结果证明了Percoll梯度离心纯化味蕾细胞有利于提高味蕾细胞的活性。
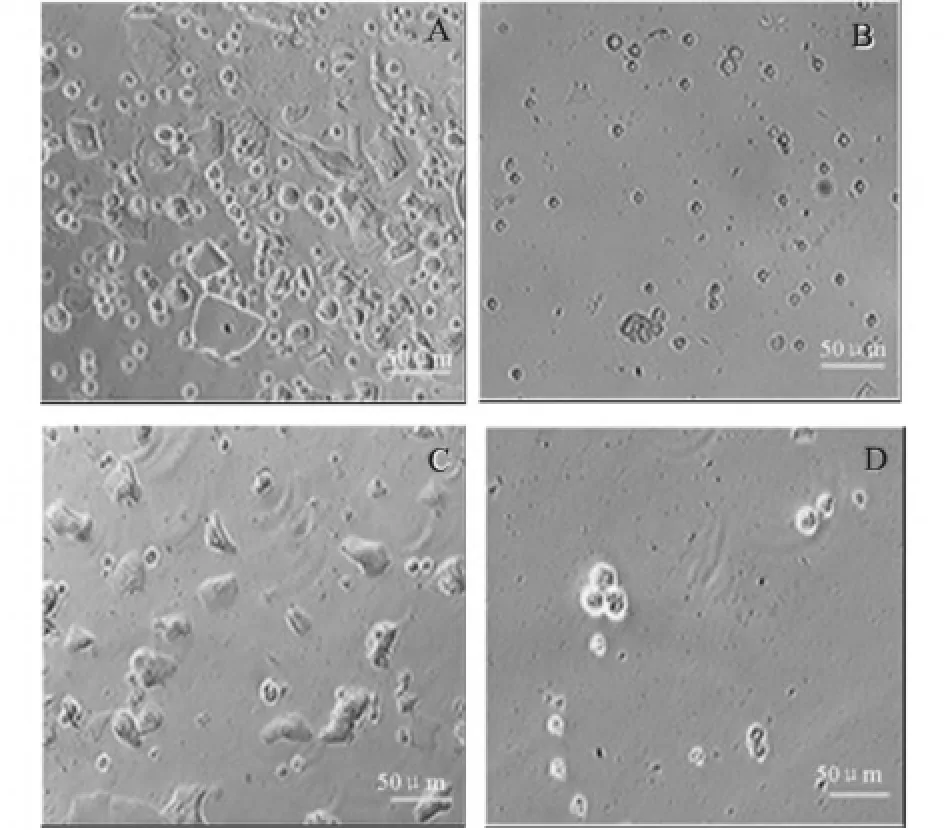
图2 Percoll离心后各细胞聚集层细胞形态:(A)细胞原液,(B)20%与原液交界面,(C)20%~40%交界面,(D)40%~70%交界面Fig.2 Cell morphology of different layers after Percoll centrifugation:original cell samples(A),interface between 20%Percoll and cell samples(B), interface between 20%and 40%Percoll(C), interface between 40%and 70%Percoll(D)
2.2 ABC免疫组化定量判定味蕾纯化前后细胞浓度
味蕾细胞起源于上皮细胞,是一种简单的柱状上皮细胞,被周围的复麟质状上皮细胞所包围。有5种CK分子(CK 7、8、18、19和20)在正常的味蕾细胞中表达,但在其周围的非味觉细胞中不表达。其中CK 8在大量味蕾细胞表达,是一种良好的成熟和正在成熟的味蕾细胞的分子标记[11]。与其他成熟的味蕾细胞的标记(α-gustducin,PLCβ2, NCAM等)相比,CK 8能够更充分的表明混杂细胞中味蕾细胞的纯度。如图3(A),省略一抗时味蕾细胞没有阳性反应,以证明此抗体的特异性。从图3(B)和图3(C)中可以看出纯化后阳性味蕾细胞的数量显著多于纯化前,通过计数得知纯化前阳性味蕾细胞数少于10%(8.59±1.29,n=10),而纯化后阳性味蕾细胞数量显著提高(P<0.01),大约占细胞总数65%(65.7±2.11,n=12)。造成纯化后味蕾纯度不太理想的原因可能因为味蕾细胞分为4种类型,迄今还没有那种标记物能够完全标记所有类型味蕾细胞。
图3 纯化前后味蕾细胞的CK8免疫组化。(A)阴性对照,(B)和(C)分别为纯化前后味蕾细胞的CK8免疫组化Fig.3 Immunohistochemistry of CK8 for TBCs before(B)and after(C)purification;the negative contrast is showed in(A)
2.3 味蕾细胞超微结构鉴定
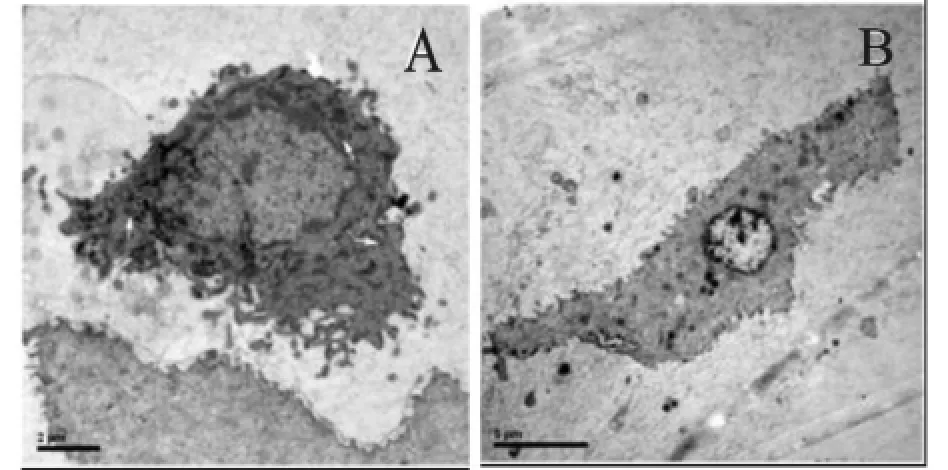
图4 分离味蕾细胞的透射电镜图片,(A)横切面图, (B)纵切面图Fig.4 Transverse section(A)and longitudinal section (B)of an iolated taste bud cell by transmission electron microscopy
味蕾细胞的超微结构也是识别味蕾细胞的一个重要标志,每种类型细胞具有独特的细胞内部结构,纯化后细胞的透射电镜结果如图4所示,图4 (A)图为细胞的横切面,胞浆中含有丰富的微丝和粗面内质网,细胞核形状不规则,含有大量的异染色质。细胞质中存在许多100~400 nm的致密团粒结构(如箭头所示),这是I型细胞的显著结构特征,I型细胞是暗细胞,呈纺锤形,味蕾中其数量最多。图4(B)为细胞的纵切面,细胞呈梭形,胞浆透亮,具有圆形细胞核,细胞顶部细胞质不含有致密颗粒,这是II型细胞的特点。细胞纯化技术是细胞生物学实验中的基本技术之一,它主要是根据细胞本身的某些性质来分离具有同一性状的细胞群。细胞的分离方法有很多种,常用的细胞分离纯化方法有:速度沉降分离法;等密度沉降分离法;流式细胞分离仪分离法;免疫磁珠分离法等[12]。与需要抗体的流式细胞分离仪分离法和免疫磁珠分离法相比,Percoll密度梯度离心方法操作简单方便,成本低,一次处理细胞数量多。Percoll是一种外面被聚乙酰胺吡咯烷酮包被的硅胶颗粒,以它作为密度梯度分离剂的优点是无毒,无刺激性,对细胞无吸附作用,产生的渗透压很小,在全部密度范围保持相等张力。Percoll密度梯度离心法主要根据细胞之间密度差异分离细胞。细胞在连续密度梯度的分离介质中,受强离心力的作用,最后会到达与其密度相同的分离介质层面,并能保持平衡。在非连续的梯度中,分离的细胞主要集中在介于其自身密度的两种密度交界面上或密度层内。
实验通过采用Percoll密度梯度离心法对小鼠味蕾细胞进行纯化,获得了较好的效果,纯化后的细胞纯度在65%以上(P<0.01),而且细胞存活率达到94.71%。细胞经消化后形态趋于圆形,培养后味蕾细胞的形态异于体内形态。为了证明培养的细胞为味蕾细胞,通过透射电镜技术对其进行鉴定,结果从精细结构上证明了纯化的细胞为味蕾细胞。但由于味蕾细胞包含4种类型的细胞,而CK 8不能标记所有味蕾细胞,这也许是导致纯化后细胞纯度偏低的主要原因。
3 结 语
总之,作者已经初步建立了一种有效的小鼠味蕾细胞分离纯化方法,通过Percoll密度梯度离心法从小鼠舌上皮组织中富集形态和活力良好的味蕾细胞。应用纯化的味蕾细胞可以开展甜味感受热力学和细胞传感器方面的研究,并结合膜片钳和钙影像技术研究味蕾细胞的生理生化特性。
[1]Jung H S,KEIICHI AKITA,KIM J Y.Spacing patterns on tongue surface-gustatory papilla[J].Int J Dev Biol,2004,48 (2-3):157-161.
[2]Bigiani A,Delay RJ,Chaudhari N,et al.Responses to glutamate in rat taste cells[J].The Journal of Neurophysiology, 1997,77(6),3048-3059.
[3]Chandrashekar J,Hoon M A,Ryba N J,et al.The receptors and cells for mammalian taste[J].Nature,2006,444 (7117):288-294.
[4]Doty R L.Handbook of olfaction and gustation[M].New York:Madison Avenue press,2003:707-718.
[5]Kinnamon S C,Cummings T A,Roper S D.Isolation of single taste cells from lingual epithelium[J].Chem Senses, 1988,13:355-366.
[6]Thomas E F.Cell Types and Lineages in Taste Buds[J].Chem Senses,2005,30(Suppl 1):i54-i55.
[7]Farbman AI.Renewal of taste bud cells in rat circumvallate papillae[J].Cell Tissue Kinet,1980,13(4):349-357.
[8]Ozdener H,Yee K K,Cao J,et al.Characterization and long-term maintenance of rat taste cells in culture[J].Chem Senses,2006,31(3):279-290.
[9]Seta Y,Harada H,Toyoshima K.Isolation,partial purification,and ultrastructure of taste bud cells from rabbit foliate papillae[J].Neurosci Lett,1997,227(1):61-64.
[10]Seta Y,Toyono T,Takeda S,et al.Expression of Mash1 in basal cells of rat circumvallate taste buds is dependent upon gustatory innervation[J].FEBS Lett,1999,444:43-46.
[11]Zhang C,Oakley B.The distribution and origin of Keratin 20 containing taste buds in rat and human[J].Differentiation, 1996,61:121-127.
[12]姜俊芬,韩伟.动物组织细胞分离纯化方法学[J].解剖学杂志,2006,29(6):799-802.
Jiang Jun-Feng,Han Wei.Methodology on separation and purification of animal tissues and cells[J].Chinese Journal of Anatomy,2006;29(6):799-801.(in Chinese)
(责任编辑:朱明)
Development of a Discontinuous Percoll Gradient Centrifugation Process for Taste bud Cells Purification
WANG Teng-hao1, QIN Yu-mei1, ZHANG Gen-hua2, DENG Shao-ping*1
(1.College of Food Science and Biotechnology Engineering,Sensory Science Laboratory,Zhejiang Gongshang Uni
versity,Hangzhou 310035,China;2.College of Food Science and Biotechnology,Changshu Institute of Technolo
gy,Changshu 215500,China)
In this manuscript,the taste bud cells of fungiform papillae of ICR mice were select as research model and Percoll gradient centrifugation was used as purify method.The methods of trypan blue staining and immunohistochemistry staining were performed to compare the viability and purity of taste bud cells of before and after purification respectively.Taste bud cells were further identified by transmission electron microscopy.Results showed that taste bud cells, which were purified by discontinuous Percoll gradient centrifugation,were remarkably separated and mainly located interface between 20%and 40%Percoll working solution;the purity of taste bud cells were distinctly improved from less than 10%to more than 65%(p<0.01)by this treatment;the viability of taste bud cells were up to 94%after purification by trypan blue staining and the results of transmission electron microscopy further confirmed taste bud cells from ultrastructure.
taste bud cells,purification technology,Percoll,ultrastructure
Q 434
:A
1673-1689(2010)01-0118-05
2009-03-03
国家自然科学基金资助项目(30770536);浙江省科技厅新苗人才项目(2008R40G2050028);浙江工商大学研究生科研创新基金(1110XJ1508066).
*通讯作者:邓少平(1956-),男,江西新干人,教授,博士生导师,主要从事食品感官科学方面的研究。Email:spdeng@zjgsu.edu.cn
