酿酒酵母线粒体NADH激酶功能相关表型研究
2010-08-27李志君史锋廖祥儒
李志君, 史锋*, 廖祥儒
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
酿酒酵母线粒体NADH激酶功能相关表型研究
李志君1,2, 史锋*1,2, 廖祥儒2
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
NADH激酶是辅酶NADP(H)从头合成的关键途径。酿酒酵母中由POS5基因编码的线粒体NADH激酶是线粒体NADPH供应的重要来源之一。由IDP1基因编码的一种关键的NADP+依赖性脱氢酶也能够供应线粒体NADPH。通过对POS5单缺失体、IDP1单缺失体、POS5IDP1双缺失体关键的表型研究,包括它们的生长性能、温度敏感性、对非发酵性碳源的利用能力、线粒体及细胞质内代表性氨基酸的合成性能,初步解析酿酒酵母线粒体中NADPH的主要供应方式及NADH激酶在线粒体中的功能。
NADH激酶;NADPH;表型;酿酒酵母
NAD(H)和NADP(H)作为两种重要的辅酶,参与细胞内多种氧化还原反应,是生物体最重要的递氢体。前者主要涉及一些氧化性生物降解反应,后者主要参与还原性生物合成反应。除此之外,近年来的研究表明,它们还涉及多种不同的生化过程。NAD参与蛋白质的ADP核糖基化修饰,从而调控多种生化过程[1],而NADPH则参与细胞内的抗氧化防御系统,它在细胞抵抗活性氧分子(ROS)攻击的过程中处于核心地位[2-3]。基于NAD(H)和NADP(H)截然不同的生理功能,它们在细胞内的水平必然会受到严格的控制,NADH激酶就是控制它们相互转变的一种关键酶。
NADH激酶利用A TP作为磷酸供体,催化NAD+和NADH发生磷酸化,生成NADP+和NADPH。这构成了NADP(H)从头生物合成的最后一步,也是目前已知的惟一一个催化NAD(H)生成NADP(H)的反应[4]。除此之外,NADPH还可以通过细胞内多种NADP+依赖性脱氢酶循环再生。
在酿酒酵母细胞中,线粒体和细胞质存在不同的NADH激酶和NADP+依赖性脱氢酶体系。线粒体中的NADH激酶由POS5基因编码[3,5];而关键的一种NADP+依赖性脱氢酶由IDP1基因编码,即NADP+依赖性异柠檬酸脱氢酶[6]。细胞质中存在两种NADH激酶,分别由U TR1和YEF1基因编码[7];而细胞质中关键的NADP+依赖性脱氢酶由ZWF1基因编码,即葡萄糖-6-磷酸脱氢酶,它催化戊糖磷酸途径的第一步反应。
另外,有研究发现,酿酒酵母细胞质中的NADH可通过外膜复合体借助离子通道转运至线粒体,NAD+可通过YIA6(NDT1)和YEA6 (NDT2)基因产物转运至线粒体。但是迄今为止还未发现任何机制能够将酿酒酵母细胞质中的NADP+/NADPH转运至线粒体。因此,酵母线粒体中NADPH的供应完全依赖于线粒体内的NADH激酶或NADP+依赖性脱氢酶[8-10]。
鉴于NADPH具有不同于NADH的重要生理功能,以及它在酿酒酵母线粒体内独立的供应方式,作者拟通过表型研究探讨线粒体内NADH激酶的功能,关键是它对线粒体NADPH库的供应能力及对线粒体功能的维持能力。通过构建酿酒酵母线粒体NADH激酶及NADP+依赖性脱氢酶基因缺失株,包括单基因缺失株pos5Δ、idp1Δ,以及双基因缺失株pos5idp1Δ,研究它们在不同培养条件下NADPH依赖性表型及线粒体功能相关表型,从而初步解析酿酒酵母线粒体中NADPH的主要供应方式及NADH激酶在线粒体中的功能。
1 材料与方法
1.1 培养基
预培养基(YPD):酵母膏1 g/dL,蛋白胨2 g/dL,葡萄糖2 g/dL,p H 5.0,G418 0.2 mg/mL。固体培养基中加入2 g/dL琼脂。
SD培养基:氨基酸酵母氮基础0.67 g/dL,葡萄糖2 g/dL,所需氨基酸和抗生素,p H 5.0。固体培养基中加入2 g/dL琼脂。
1.2 酿酒酵母菌株的筛选及培养
实验中所使用的酿酒酵母菌株列于表1。突变株的初步筛选采用SD选择性平板。构建好的各酵母菌株在YPD培养基中30℃预培养,用超纯水洗涤后,以终密度OD600=0.05转移至不同碳源的培养基中培养,并监测其在不同培养时间的生长密度,直至达到饱和期[11]。为了验证野生型和突变型酵母菌株在固体培养基中的生长表型,各酵母菌株在YPD培养基中以30℃预培养,收集并洗涤3次后,分别稀释至OD600为2.0、0.2、0.02。稀释后的细胞悬液各取5μL点在合适的固体培养基上, 30℃培养3~5 d后拍照记录。
1.3 NADH激酶和NADP+依赖性脱氢酶双基因缺失株的构建
对照细胞BY4742,NADH激酶单基因敲除株utr1Δ、pos5Δ、yef1Δ和ZW F1、ID P1基因敲除株zw f1Δ、idp1Δ来自EUROSCARF,见表1。NADH激酶双基因缺失株utr1yef1Δ、pos5utr1Δ、pos5yef1Δ来自Feng Shi[12]。NADH激酶和脱氢酶双基因缺失株pos5idp1Δ、pos5zw f1Δ采用同源置换法构建[13]。以质粒pFA6a-His3MX6(酿酒酵母基因敲除载体,HIS3,氨苄青霉素抗性)为模板, pos5hisf和pos5hisr为嵌合引物,通过PCR扩增出两端各带有POS5基因上游和下游约40 bp的嵌合HIS3基因(pos5-HIS3),将此PCR扩增产物纯化后分别转化idp1Δ和zw f1Δ细胞,以使HIS3基因置换idp1Δ或zw f1Δ细胞染色体上的POS5基因,通过His-平板筛选阳性转化体idp1pos5:: HIS3或zw f l pos5::H IS3,并经菌落PCR验证后得到双缺失体pos5idp1Δ或pos5zw f1Δ,验证用引物为pos5upf、pf ahis3r、pf ahis3f和pos5dnr,见表2。
2 结果与讨论
为了研究酿酒酵母线粒体NADH激酶的功能,尤其是它对线粒体中NADPH的供应能力,及线粒体正常功能的维持能力、及其它关键NADP+依赖性脱氢酶对NADPH的供应能力,了解线粒体内NADPH的优势供应途径,作者比较了野生菌和不同突变菌在液体培养基中的生长状况,及它们在不同固体培养基中的生长表型,包括对温度的敏感性、对非发酵碳源的利用能力、氨基酸合成能力以及抗氧化能力等。

表1 酿酒酵母菌株Tab.1 S.cerevisiaestrains used in this study

表2 引物Tab.2 Primers used in this study
2.1 基因缺失株在液体培养基中的生长情况
将酿酒酵母细胞中POS5和/或IDP1基因敲除后,生长状况与野生菌BY4742相比,在YPD和SD液体培养基中的生长表现出明显的不同,见图1。
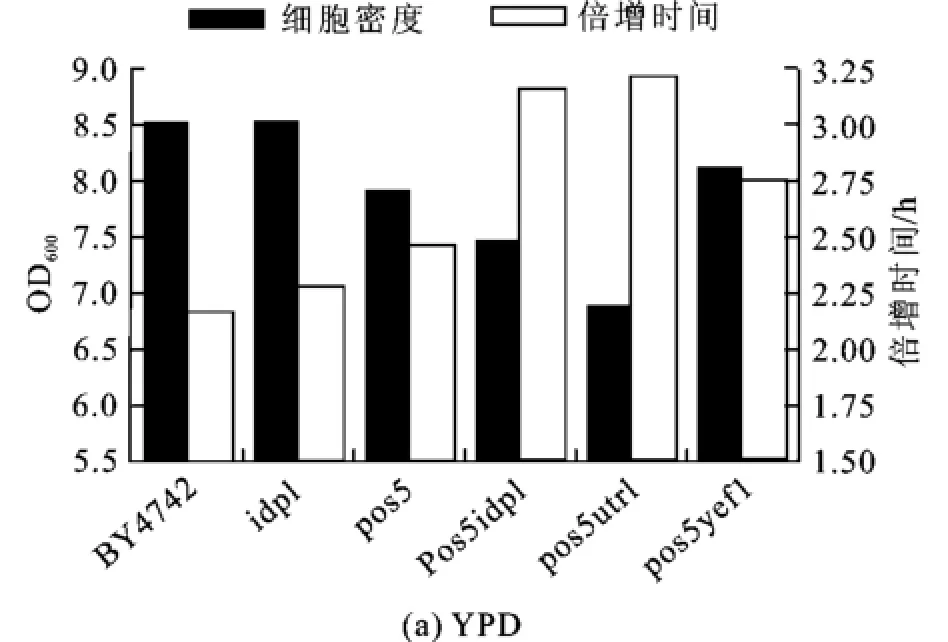
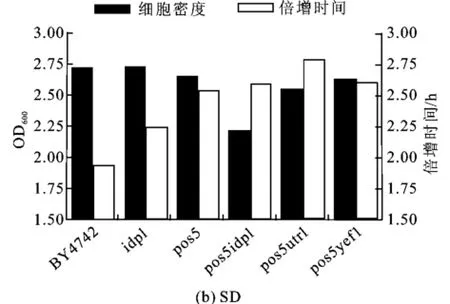
图1 BY4742和突变株生长至饱和态时的生长密度及生长倍增时间Fig.1 Cell density and doubling time of BY4742 and mutants growing in liquid medium
不管是在YPD培养基还是在SD培养基中,突变株的生长倍增时间均高于野生型,且双基因缺失株,即pos5idp1Δ、pos5utr1Δ、pos5yef1Δ与野生型或单基因缺失株相比,所用的倍增时间更长。pos5idp1Δ与pos5utr1Δ在饱和态时细胞密度相对较低。从图1可以看出,POS5和ID P1基因产物对于维持酿酒酵母正常生长(生长速度和细胞密度)均起到一定作用,其中POS5的作用更大,而双基因的敲除会减弱细胞的生长能力。
2.2 基因缺失株对温度的敏感性
当酿酒酵母在最适温度30℃下培养时,野生型和突变型酵母均能表现出正常的生长状态。而将温度提高至37℃时,pos5Δ突变株(pos5Δ,pos5idp1Δ)表现出一定的生长缺陷,其中,pos5idp1Δ双基因缺失株的生长缺陷更为明显。说明POS5基因的敲除会增加细胞对不适宜温度的敏感性,当同时伴随ID P1基因缺失时,这种敏感性会增加,见图2。

图2 BY4742和突变株对温度的敏感性Fig.2 Temperature sensitivity of BY4742 and mutants
2.3 基因缺失株对非发酵性碳源的利用能力
为了考察突变株对非发酵性碳源的利用能力,作者改变了培养基中的碳源,见图3。之前已有报道称pos5Δ突变株在以甘油作为惟一碳源的培养基中存在生长缺陷[14]。由于呼吸缺陷型酵母不能利用非发酵性碳源如乳酸、甘油、乙酸等,因此pos5Δ突变株很可能存在一定程度的呼吸障碍。于是,作者对比了pos5Δ、idp5Δ、pos5idp1Δ对甘油、乙酸的利用能力,结果表明,idp1Δ对非发酵性碳源的利用能力明显强于pos5Δ,而pos5idp1Δ表现出非常严重的缺陷。从表型观察的结果可以推断,在酿酒酵母线粒体中,POS5基因编码的NADH激酶对线粒体正常功能的维持,尤其是呼吸链上电子传递过程的正常进行起到一定作用。

图3 BY4742和突变株在不同碳源中的生长情况Fig.3 G rowth of BY4742 and mutants in different media with indicated carbon sources
2.4 基因缺失株的细胞质和线粒体氨基酸合成能力
pos5Δ突变株表现出精氨酸营养缺陷[2]。这是由于线粒体NADPH是精氨酸合成所必需的,它为谷氨酸生成精氨酸的第三步反应提供还原力,见图4[15]。而细胞质中NADPH则是甲硫氨酸合成所必需的[16,17]。
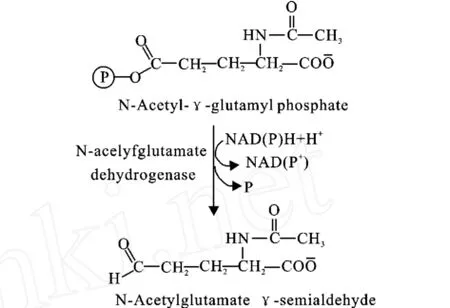
图4 谷氨酸生成精氨酸过程的第三步反应Fig.4 The third step in the conversion of glutamate to arginine
另有报道称,在哺乳动物细胞中,线粒体NADP+依赖性异柠檬酸脱氢酶(NADP-IDHm)是线粒体中NADPH的重要供应源[18]。然而酿酒酵母的idp1Δ突变株并不存在显著的精氨酸合成缺陷。pos5Δ存在明显的精氨酸合成缺陷,且pos5idp1Δ未表现出比pos5Δ更强烈的精氨酸合成缺陷,见图5。

图5 BY4742和突变株对精氨酸和甲硫氨酸的合成能力Fig.5 Arginine and methionine biosynthesis of BY4742 and mutants
pos5Δ在精氨酸合成上的缺陷,也说明细胞质中NADPH的正常供应不能缓解线粒体中NADPH的缺陷。另外由于pos5Δ突变株不存在甲硫氨酸合成上的缺陷,说明供应线粒体NADPH的相关基因的敲除不影响细胞质中NADPH的供应,再次证明了酿酒酵母线粒体NADPH库和细胞质NADPH库是相互独立。zw f1Δ的精氨酸原养型和甲硫氨酸异养型也证明了这一点,见图6。pos5zw f1Δ既存在精氨酸营养缺陷,又存在甲硫氨酸营养缺陷,说明其线粒体NADPH和细胞质NAD-PH的供应均存在障碍。而pos5utr1Δ仅为精氨酸营养缺陷型,说明它的线粒体NADPH供应有明显障碍,而细胞质NADPH的供应未受显著影响。

图6 BY4742和突变株在精氨酸和甲硫氨酸合成上的缺陷Fig.6 Arginine and methionine biosynthesis defect of BY4742 and mutants
2.5 基因缺失株的抗氧化能力
生物有机体抵抗活性氧分子的能力取决于它们抗氧化系统的正常运行。NADPH对于维持细胞氧化还原体系平衡,保障细胞抗氧化能力非常重要。因此,NADPH的缺乏往往会引起细胞对氧化压力的敏感。从图7,8可见,pos5Δ突变株(包含pos5Δ、pos5idp1Δ、pos5utr1Δ、pos5zw f1Δ)对CuSO4和H2O2都很敏感,双突变株(pos5idp1Δ、pos5utr1Δ、pos5zw f1Δ)对于CuSO4的敏感性更高于单突变株(pos5Δ、idp1Δ、utr1Δ、zw f1Δ)。对于线粒体内的一种代表性NADP+依赖性脱氢酶Idp1p,其基因突变株idp1Δ可以同野生菌一样正常抵御这两种氧化压力,这说明它对于酿酒酵母抵抗氧化压力没有贡献。细胞质NADH激酶突变株utr1Δ和细胞质葡萄糖-6-磷酸脱氢酶突变株zw f1Δ对这两种氧化压力也比较敏感,说明它们对于对抗氧化压力(很可能是细胞质内的活性氧)具有一定的功能。
3 结 语

图7 BY4742和突变株的抗氧化能力Fig.7 The anti-oxidation ability of BY4742 and mutants
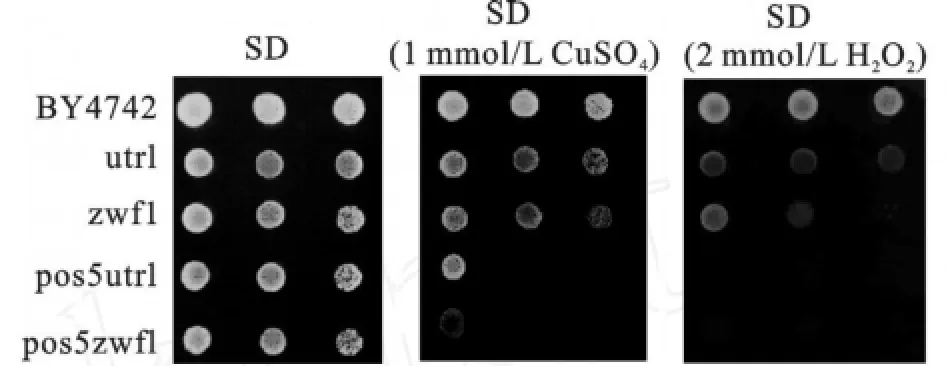
图8 BY4742、zwf1Δ、utr1Δ、及其与POS5基因的双突变株的抗氧化能力Fig.8 The anti-oxidation ability of BY4742 and mutants
对酿酒酵母的表型研究表明,在最优培养基、最适培养温度的条件下,野生型和突变型都能生长,但pos5Δ,尤其是pos5idp1Δ双基因缺失株在YPD和SD液体培养基中的生长速率变慢,细胞密度降低。当改变培养温度,或培养基成分时,突变株尤其是pos5Δ表现出明显的温度敏感性,对非发酵性碳源的利用能力出现障碍,氨基酸合成能力以及抗氧化能力也存在缺陷,而pos5idp1Δ在特定情况下会加剧。
从表型比较的结果中还发现,POS5基因编码的NADH激酶是线粒体NADPH的主要供应来源;ID P1基因编码的异柠檬酸脱氢酶对于线粒体中NADPH的供应也能起到一定作用,但其贡献不如Pos5p。pos5idp1Δ双基因缺失株在一些特定条件下的生命表征弱于pos5Δ单基因缺失株。线粒体和细胞质中NADPH存在于两个相互独立的体系中。
[1]Ziegler M.New functions of a long-known molecule.Emerging roles of NAD in cellular signaling[J].Eur J Biochem, 2000,267:1550-1564.
[2]Foster J W,Moat A G.Nicotinamide adenine dinucleotide biosynthesis and pyridine nucleotide cycle metabolism in microbial systems[J].Microbial Rev,1980,44:83-105.
[3]Outten C E,Culotta V C.A novel NADH kinase is the mitochondrial source of NADPH inSaccharomyces cerevisiae[J]. EMBO J,2003,22:2015-2024.
[4]Mcguinness E T,Butler J R.NAD+kinase-a review[J].INT J Biochem,1985,17(1):1-17.
[5]Strand M K,Stuart G R,Longley M J,et al.POS5 gene ofSaccharomyces cerevisiaeencodes a mitochondrial NADH kinase required for stability of mitochondrial DNA[J].Eukaryot Cell,2003,2:809-820.
[6]Robert J,Haselbeck,Lee McAlister-Henn.Isolation,nucleotide sequencea,and disruption of theSaccharomyces cereuisiaegene encoding mitochondrial NADP(H)-specific isocitrate dehydrogenase[J].J Biol Chem,1991,266:2339-2345.
[7]Kawai S,Mori S,Suzuki S,et al.Molecular cloning and identification of UTRl of a yeastSaccharomyces cerevisiaeas a gene encoding an NAD kinase[J].FEMs Microbiol Let,2001,200:181-184.
[8]Benz R.Permeation of hydrophilic solutes through mitochondrial outer membranes:review on mitochondrial porins[J]. Biochim Biophys Acta,1994,1197:167-196.
[9]Kmita H,Budzinska M.Involvement of the TOM complex in external NADH transport into yeast mitochondria depleted of mitochondrial porin1[J].Biochim Biophys Acta,2000,1509:86-94.
[10]Todisco S,Agrimi G,Castegna A,et al.Identification of the mitochondrial NAD+transporter inSaccharomyces cerevisiae[J].J Biol Chem,2006,281:1524-1531.
[11]Van Roermund C W T,Hettema E H,Kal A J,et al.Peroxisomalβ-oxidation of polyunsaturated fatty acids inSaccharomyces cerevisiae:isocitrate dehydrogenase provides NADPH for reduction of double bonds at even positions[J].EMBO J,1998,17:677-687.
[12]Feng Shi,Shigeyuki Kawai,Shigetarou Mori,et al.Identification of ATP-NADH kinase isozymes and their contribution to supply of NADP(H)inSaccharomyces cerevisiae[J].FEBS Journal,2005,272:3337-3349.
[13]Wach A,Brachat A,Alberti-Segui C,et al.Heterologous H/S3 marker and GFP repo rter modules for PCR-targeting inSaccharomyces cerevisiae[J].Yeast,1997,13:1065-1075.
[14]Dimmer K S,Fritz S,Fuchs F,et al.Genetic basis of mitochondrial function and morphology inSaccharomyces cerevisiae[J].Mol Biol Cell,2002,13:847-853.
[15]Jauniaux J C,Urrestarazu L A,Wiame J M.Arginine metabolism inSaccharomyces cerevisiae:subcellular localization of the enzymes[J].J Bacteriol,1978,133:1096-1107.
[16]Thomas D,Cherest H,Surdin-Kerjan Y.Identifcation of the structural gene for glucose-6-phosphate dehydrogenase in yeast.Inactivation leads to a nutritional requirement for organic sulfur[J].EMBO J,1991,10:547-553.
[17]Slekar K H,Kosman D J,Culotta V C.The yeast copper/zinc superoxide dismutase and the pentose phosphate pathway play overlapping roles in oxidative stress protection[J].J Biol Chem,1996,271:28831-28836.
[18]Jo S H.Control of mitochondrial redox balance and cellular defense against oxidative damage by mitochondrial NADP+-dependent isocitrate dehydrogenase[J].J Biol Chem,2001,276:16168-16176.
(责任编辑:李春丽)
Function and Phenotype of Mitochondrial NADH Kinase inSaccharomyces cerevisiae
LI Zhi-jun1,2, SHI Feng*1,2, LIAO Xiang-ru2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214036,China;2.Key Laboratory of Industrial Biotechnology,Ministy of Education,Jiangnan University,Wuxi 214036,China)
NADH kinase is the critical pathway for NADP(H)biosynthesis in yeast.InS accharomyces cerevisiae,mitochondrial NADPH is mainly supplied by a mitochondrial NADH kinaseencodedbyPOS5gene.However,amitochondrialNADP+-specificisocitrate dehydrogenase encoded by IDP1 gene could also supply mitochondrial NADPH.Here,through the phenotypic study of POS5 single mutant,IDP1 single mutant,POS5IDP1 double mutant, including their growth ability,temperature sensitivity,non-fermentable carbon sources usage ability,amino acid synthetic ability and anti-oxidation,supplying mode of mitochondrial NADPH and function of NADH kinase in mitochondria were investigated.
NADH kinase,NADPH,phenotype,S accharomyces cerevisiae
Q 55
:A
1673-1689(2010)01-0128-06
2009-03-10
国家自然科学基金项目(30770019,30870056)。
*通讯作者:史锋(1970-),女,江苏丹阳人,工学博士,副教授,硕士生导师,主要从事微生物与生物化学方面的研究。Email:shifeng@jiangnan.edu.cn
