基于核壳型荧光纳米颗粒检测的人免疫球蛋白G免疫分析方法研究
2010-08-27徐欢王周平杨震吴佳
徐欢, 王周平*, 杨震, 吴佳
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122)
基于核壳型荧光纳米颗粒检测的人免疫球蛋白G免疫分析方法研究
徐欢1,2, 王周平*1,2, 杨震1,2, 吴佳1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122)
生物分子标记的荧光检测技术已广泛应用于生物学检测和疾病诊断。实验利用反向微乳液技术,制备出Ru(bpy)3Cl2掺杂SiO2荧光纳米粒子。IgG的检测是基于IgG和荧光纳米颗粒标记的羊抗人IgG的特异性结合。实验中,IgG检测的线性范围为1~100 ng/mL,检出限达到0.3 ng/mL,对30 ng/mL人IgG进行11次检测,相对标准偏差为2.2%。实验结果表明,该检测新方法具有检测灵敏度高、操作简单和重复性好。
核壳型荧光纳米颗粒;联吡啶钌;荧光检测;人免疫球蛋白G
免疫球蛋白G(IgG)是人体血清中含量最高的抗体,占血清中免疫球蛋白的70~80%,是唯一能通过胎盘的免疫球蛋白,具有抗菌、抗病毒、抗毒素的特性,在机体免疫防护中起着重要作用。同时, IgG还是保持人体健康的重要物质,市场上出现了许多富含IgG的保健食品如牛初乳片等。在临床检测中,IgG含量的变化也是判定病变的重要指标。
目前,利用抗体-抗原的识别来对目标分析物进行定量和定性分析,即免疫分析,在临床检测和环境监测中有着广泛的应用,但现有的每一种免疫分析方法都有它固有的缺点[1]。在20世纪70年代早期建立起来的放射免疫虽然在测定中具有较高的选择性和灵敏度,但是标记物有放射性对环境有污染和对人体有危害作用[2]。酶联免疫分析技术因为其分析的高选择性,而且无需放射性试剂,因而已经有许多商品化的免疫试剂盒出现[3]。然而,标记酶需要特别的保存,而且用比色法检测时一般均要用到致癌性物质作为标记物。化学发光免疫分析有明显的优势,比如具有灵敏度高、操作简单、测定快速和使用成本低等优点[4]。由于它的高灵敏度,其在生物分析和临床检测方面都有很好的应用。虽然有关化学发光免疫分析的报道很多,但是,化学发光信号灵敏,在实际应用中要求操作仔细,并要避免所使用水中金属离子对化学发光信号的影响[5]。荧光免疫分析法已经广泛地被用于临床检测和复杂样品的分析研究中[6]。然而,这传统的荧光免疫分析法具有标记效率低、耐光性差、荧光强度相对较低等缺点[7-8]。而文献报道的其他方法或仪器昂贵,或操作复杂,或耗时长。建立既简单又灵敏的免疫分析方法对疾病的早期诊断和提高治疗效果具有重要的意义。最近研究表明,纳米粒子标记荧光免疫分析很有希望代替放射免疫分析、酶联免疫分析和传统的荧光免疫分析[9]。
纳米粒子标记荧光免疫分析法有许多优点,如检出限低、耗样量少、选择性好和灵敏度高等。在过去的几年中,纳米粒子标记荧光免疫分析法中研究最多的纳米粒子标记物就是核-壳型荧光纳米粒子[10-12]。因为数以千计的荧光分子被包埋在一个对荧光染料具有保护作用免于其光漂白的纳米粒子基质中,所以其作为标记物比较传统的有机荧光染料标记物而言,核-壳型荧光纳米粒子提供了较好的耐光性和更高的光信号。并且该荧光纳米粒子能够容易地在温和的条件和简单的操作程序下使用较廉价的试剂制备得到。而且其粒径大小一致,容易修饰,这些优点为各种不同的科学研究和临床应用提供了便利[13-20]。
在食品安全越来越受政府、大众关注的今天,如何实现低检测限,快速分析食品中的农残、抗生素等有害物质,激素、酶、蛋白质、DNA、致病菌等生物活性物质已经成为科学研究的热点。建立一种新型、快速的免疫球蛋白检测分析模式,对食品安全、生物分析检测具有很好的借鉴作用。在本工作中,以Ru(bpy)3Cl2掺杂SiO2纳米粒子(FNs)为标记物,“三明治”夹心免疫分析为原理,建立了一种测定IgG荧光免疫分析新方法。根据待测样品中IgG与羊抗人IgG抗体标记的Ru(bpy)3Cl2掺杂SiO2纳米粒子之间特异性的交互作用和荧光强度的强弱实现了对其的定量分析。该检测新方法具有操作简单、检测灵敏度高和精密度高的特点,可被用于血清中IgG的测定。
1 材料与方法
1.1 仪器
DF-101S型集热式磁力加热搅拌器:河南巩义市予华仪器厂产品;用于荧光纳米粒子合成;TU-1900紫外可见光分光光度计:北京普析通用仪器有限责任公司产品,用于测定抗体吸收光谱;TecnaiG220透射电镜(TEM):美国FEI公司产品,用于合成的荧光纳米粒子的形貌表征;5804R高速离心机:上海泰亚赛福科技发展有限公司产品,用于纳米粒子及生物功能化纳米粒子离心分离;KJ-300超声波发生器用于纳米材料的制备和分散处理。荧光/化学发光仪:用于荧光强度检测;96微孔板为加拿大BBI公司产品。
1.2 试剂
联吡啶钌、牛血清蛋白(BSA):购于美国Fluka公司;(3-氨基丙基)三乙氧基硅烷APTES:购于美国Alfa Aesar公司;羊抗人IgG、IgG、牛血清蛋白(BSA):购于北京鼎国生物科技有限公司;环己烷、正己醇、TX-100、正硅酸乙酯TEOS、丙酮、氨水(28%)、25%戊二醛、碳酸钠、氢氧化钠、磷酸二氢钾、磷酸氢二纳、氯化钠、氯化钾、浓盐酸等购于中国医药上海化学试剂公司;超纯水购于无锡华润华晶微电子有限公司。
实验所用试剂均为分析纯。
1.3 实验方法
1.3.1 联吡啶钌掺杂的二氧化硅纳米材料的制备与表征 荧光纳米粒子制备方法有许多种。但反相微乳液聚合法是制备荧光染料掺杂荧光纳米粒子最常用的方法之一。该法制备条件温和,成本低,并且操作过程简单。制得的荧光纳米粒子粒径均匀,分散行好,易于标记。在这项实验中Ru (bpy)32+掺杂的SiO2纳米粒子的制备按照文献并稍作改动制备而成。
其制备的具体方法[21-22]如下:首先在室温下,将1.77 mL表面活性剂TX-100,7.5 mL环己烷和1.8 mL助表面活性剂正己醇用磁力搅拌器混合30 min。然后,加入0.48 mL Ru(bpy)3Cl2荧光染料溶液,并持续搅拌至混合物形成均匀的油包水微乳液体系。加入100μL TEOS,然后加入60μL N H3· H2O(28~30 wt.%)开始水解反应。持续搅拌24 h,然后加入100μL APTES和60μL NH3·H2O并继续搅拌。24 h后,加入25 mL丙酮破乳。在10 000 r/min下,离心10 min,收集产物。用乙醇和水超声、离心洗涤数次,以除去纳米粒子表面吸附的表面活性剂和吸附的Ru(bpy)3Cl2荧光染料。室温干燥后,用荧光分光光度计和透射电镜对其进行表征。
1.3.2 联吡啶钌掺杂的SiO2纳米材料标记羊抗人IgG 按常规的戊二醛法将羊抗人IgG固定在Ru (bpy)3Cl2掺杂SiO2纳米粒子的表面[23]。具体步骤如下:
1)将2 mg Ru(bpy)3Cl2掺杂SiO2纳米粒子分散在含5%戊二醛的PBS缓冲溶液中,持续搅拌2 h。
2)用PBS缓冲液离心清洗3次,将纳米粒子分散在含有羊抗人IgG的PBS溶液中,4℃振动孵育12 h。
3)将所得产物用PBS缓冲液清洗3次后,4℃保存在PBS缓冲液中。
1.3.3 检测IgG的分析过程 实验按照双抗体夹心法免疫分析步骤进行。用p H值9.6 0.05 mol/L包被液稀释羊抗人IgG后,在96孔板的每孔中加入100μL。将96孔板4℃放置过夜,然后用PBST清洗3次。加入IgG标准品或待测样品(每孔100μL),37℃孵育1 h,用PBST清洗后,再加入羊抗人IgG修饰的Ru(bpy)3Cl2掺杂SiO2纳米粒子(每孔100μL),37℃孵育1 h。然后,用PBS清洗3次。最后,在荧光/化学发光仪上测定荧光强度,根据荧光强度进行定量。
1.3.4 人血清样品中的IgG测定
1)样品处理:随机留取门诊患者的静脉血标本,2 500 g离心10 min。分离血清,于-20℃冰箱保存。
2)免疫浊度法:IgG待测血清和标准血清各按1∶10用生理盐水稀释,各取5根试管,每管加入10 μL血清和1 mL应用抗体,混匀各管,37℃水浴10 min后,振荡混匀,在波长340 nm处,用0.5 nm的比色杯,以生理盐水作空白调零,在酶标仪上测定溶液的吸光度。
3)基于纳米颗粒标记的荧光免疫分析:按本文1.3.3所述方法,待测物为10μL1∶100 000的稀释血清。5个微孔中平行地加入10μL血清,经免疫反应后测定荧光强度,来确定人血清中IgG的量。
2 结果与分析
2.1 联吡啶钌掺杂的二氧化硅纳米粒子的表征
联吡啶钌是一种广泛使用的无机染料分子,利用Ru(bpy)32+与SiO2纳米粒子之间的静电吸引作用可以成功的制备Ru(bpy)32+掺杂的SiO2纳米粒子。TEOS和APTES通过共解,在纳米粒子表面形成带有氨基的单分散的球形Ru(bpy)3Cl2掺杂SiO2纳米粒子。而TEOS的水解速度大于APTES的水解速度。在纳米粒子表面,Si–O–Si键与TEOS水解产物的进一步结合可以抑制APTES水解产物氨的形成,未水解的APTES被包纳米粒子中心,为解决这一问题,在W/O微乳液中,先加入TEOS水解24 h后,加入APTES。利用此方法,通过在纳米粒子中加入APTES,修饰纳米粒子表面,使结更容易,更多的自由氨基被直接引入在纳米粒子表面。
对所制备的纳米颗粒进行透射电子显微镜(TEM)分析,从图1中可以看到,所制备的联吡啶钌掺杂的SiO2纳米颗粒形成了规则的球形,直径在100±5 nm左右,内部颜色比近表面的地方要深,原因是在接近球心的地方所包覆的染料分子数较多,且荧光纳米粒子具有很好的分散性,有利于其在生物标记中的应用。

图1 所制备的荧光纳米TEM形貌Fig.1 TEM image of fluorescence nanoparticles
利用荧光分光光度计对纳米粒子的荧光性质进行了表征。联吡啶钌染料水溶液在460 nm的激发光下的最大发射波长是595 nm。如图2所示,当利用460 nm作为荧光染料和纳米材料的激发波长时,相对于荧光染料而言,纳米材料的发射波长向长波方向移动了3 nm,抗体修饰后的荧光纳米颗粒的发射波长向长波方向移动了2 nm,表明,Rubpy荧光染料的特征光谱在加入纳米粒子后和抗体修饰后并没有明显改变。
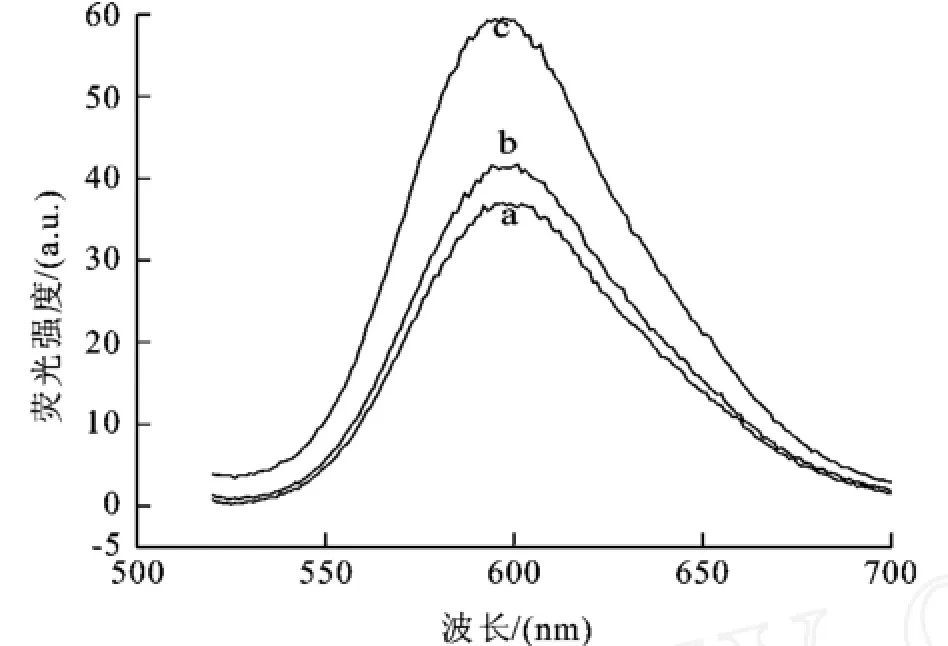
图2 Rubpy染料(a)、荧光纳米颗粒(b)和抗体修饰后的荧光纳米颗粒(c)的荧光发射光谱(激发波长为460nm)Fig.2 Emission spectrum upon excitation at 460nm of Rubpy dry(a)、Ru(bpy)32+-doped silica nanoparticles(b)and nanoparticle-labeledantibody(c)
图3 荧光纳米颗粒的激发光谱Fig.3 Excitation spectrum of the NFs
2.2 联吡啶钌掺杂的二氧化硅纳米粒子光稳定性研究
光漂白现象是由于溶液中溶剂分子与荧光染料分子之间作用的结果。通常被认为是由于溶液中溶解氧分子和荧光染料分子之间发生了反应。为了研究荧光纳米粒子的光稳定性,考察了其荧光强度随照射时间的变化情况。将荧光纳米材料和荧光染料配制成溶液,用150 W氙灯连续照射荧光染料Ru(bpy)3Cl2、荧光纳米粒子的溶液,每2 min记录一次荧光强度。从图4中可以看出,联吡啶钌掺杂的二氧化硅纳米材料具有较好的光稳定性,用氙灯连续照射60 min后荧光强度仅减少了9.9%。而荧光染料Ru(bpy)3Cl2光稳定性较差,用氙灯连续照射60 min后荧光强度减少了55.1%。说明荧光染料受到二氧化硅基质的保护后荧光稳定性得到了提高。
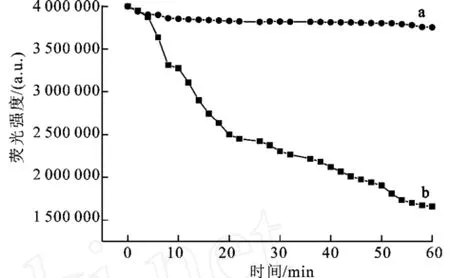
图4 荧光纳米颗粒和Ru(bpy)3Cl2染料的光稳定性Fig.4 Photostability of fluorescence nanoparticles and Ru(bpy)3Cl2dry in aqueous solutions
2.3 染料联吡啶钌的用量对纳米颗粒荧光强度的影响
当制备溶液中Ru(bpy)3Cl2的浓度变化时荧光纳米粒子的荧光强度也随之发生变化。对制备溶液中Ru(bpy)3Cl2的浓度进行了优化。如图5所示,当Ru(bpy)3Cl2的浓度由小增大时(4、8、12、16、20、25、30 mmol/L),荧光纳米粒子的荧光强度也逐渐增大。这是由于Ru(bpy)3Cl2的浓度的增大,生成的纳米粒子包埋的Ru(bpy)3Cl2分子增多,所以荧光强度增大。当Ru(bpy)3Cl2的浓度大于20 mmol/L时,荧光纳米粒子的荧光强度增大变化缓慢。这是由于在高浓度Ru(bpy)3Cl2溶液条件下,一方面由于生成的纳米粒子包埋的Ru(bpy)3Cl2分子趋于饱和,另一方面,由于大量的Ru(bpy)3Cl2分子包埋在一个纳米粒子中,Ru(bpy)3Cl2分子之间距离减小,荧光淬灭变得严重,所以荧光强度增大趋势减缓。选择20 mmol/L的Ru(bpy)3Cl2溶液作为最佳条件。
2.4 抗体标记Ru(bpy)3Cl2掺杂SiO2纳米粒子
TEOS和APTES水解后,纳米粒子表面引入一些氨基。这些氨基使纳米粒子表面的修饰及结合更容易。实验原理如图6所示,Ru(bpy)3Cl2掺杂SiO2纳米粒子与戊二醛结合,然后结合戊二醛的纳米粒子通过醛基和抗体的氨基反应。在本实验中,先在96微孔板上固定羊抗人IgG一抗,加入待测IgG,两者发生特异性结合,再加入Ru(bpy)3Cl2掺杂SiO2纳米粒子修饰的羊抗人IgG二抗,形成“三明治”夹心结构,根据纳米粒子的荧光强度来对IgG进行定量。

图5 Rubpy浓度对荧光强度的影响Fig.5 Effect of concentration of Rubpy in the preparation on the flurescence intensity
如何判断Ru(bpy)3Cl2掺杂SiO2纳米粒子表面抗体标记成功与否,在实验中严格控制实验条件,在Ru(bpy)3Cl2掺杂SiO2纳米粒子与羊抗人IgG抗体交联后,利用红外表征和紫外可见表征,说明标记过程已经成功的将羊抗人IgG抗体与Ru (bpy)3Cl2掺杂SiO2纳米粒子进行了交联。红外表征结果如图7所示,1 089 cm-1是Si-O-Si伸缩震动的特征吸收,纳米粒子和表面修饰抗体纳米粒子的红外吸收峰相比,抗体修饰的纳米粒子在1 535、1 648、2 930和3 422 cm-1处有吸收,且这些吸收峰为抗体的特征吸收峰,表明抗体和纳米粒子成功交联。紫外可见表征由图8所示,在波长280 nm处, 75μg的羊抗人IgG抗体溶液的吸收较强,而等量的羊抗人IgG抗体和纳米粒子反应后离心所得上清液吸收较弱,说明部分羊抗人IgG抗体已经连接到氨基化的纳米粒子表面,同时也说明纳米粒子表面氨基化的成功。
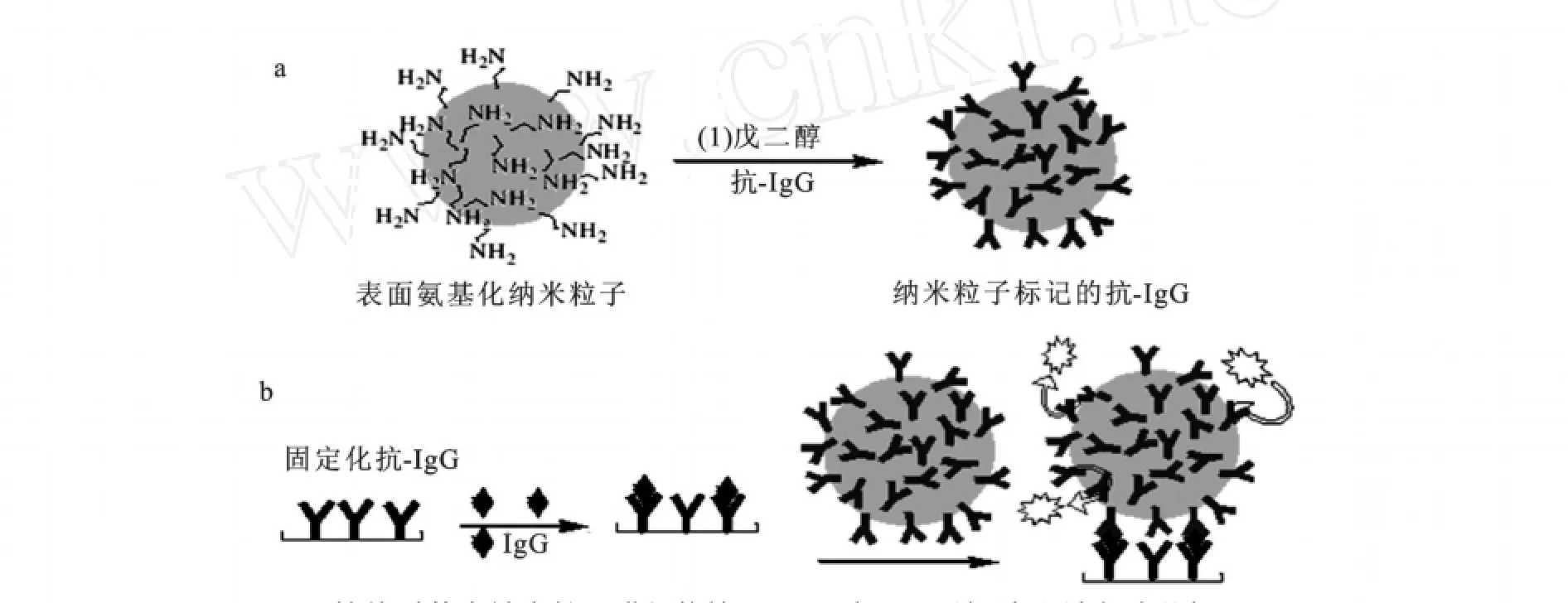
图6 抗体对荧光纳米粒子进行修饰原理(a)和“三明治”夹心法免疫分析原理(b)Fig.6 Schematic representation of antibody immobilization process onto functionalizedfluorescent core-shell nanoparticles(a).Principle of the sandwich fluoroimmunoassay(b)
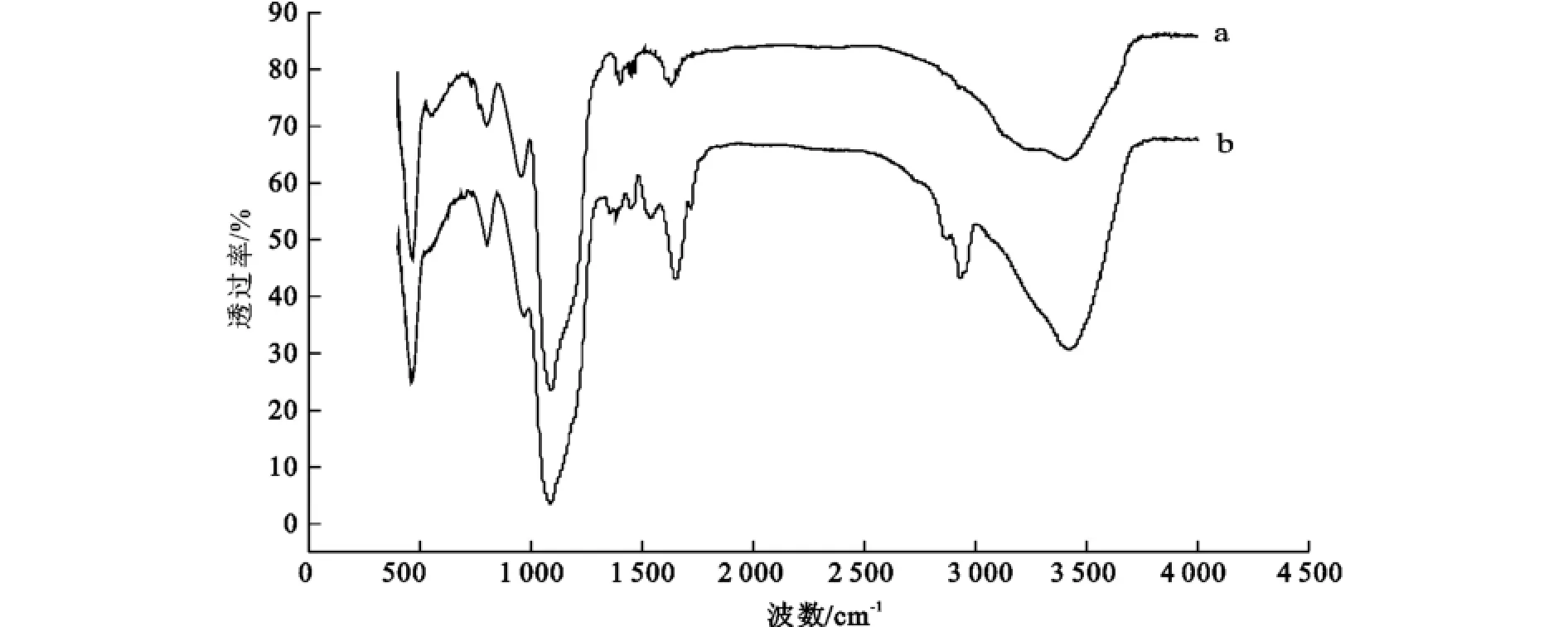
图7 纳米粒子(绿)和抗体修饰的纳米粒子(红)的红外图谱Fig.7 IR spectra of the Ru(bpy)-doped silica nanoparticles(green)and antibody-labeled nanoparticle(red)
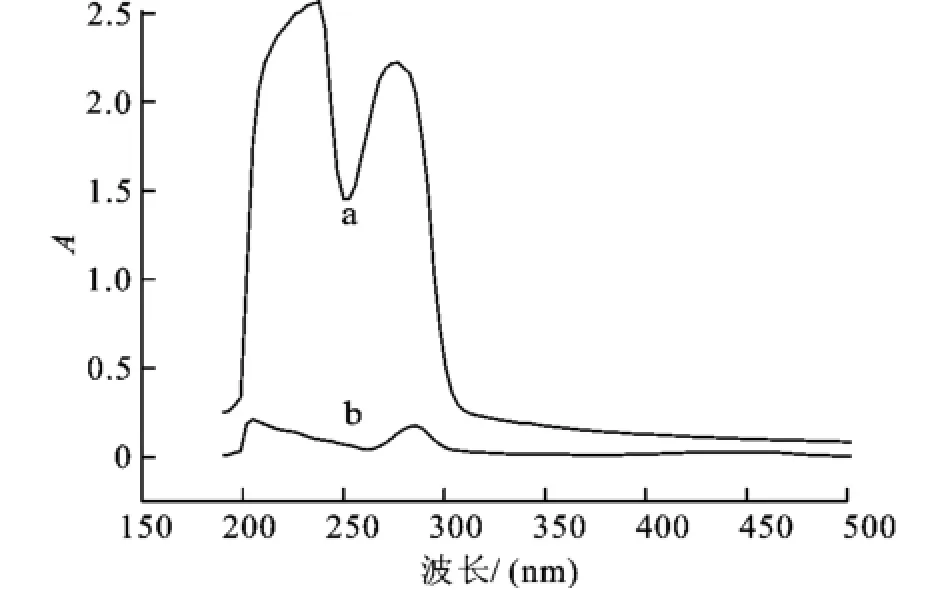
图8 羊抗人IgG(a)以及羊抗人IgG和纳米粒子反应后离心所得上清液(b)的紫外可见吸收图谱Fig.8 Absorption spectrum of(a)goat anti-hIgGand (b)supersatant sliquor after the gost anti-hIgG conjugated nanoparticles were w ashed using centrifugationand and ultrasonication with PBS
2.5 纳米粒子表面结合羊抗人IgG量的优化
在Ru(bpy)3Cl2掺杂SiO2纳米粒子修饰中,抗体的修饰用量对免疫反应中抗原和抗体的识别位点的数目有较大的影响,从而进一步的影响免疫测定中荧光强度。为了研究Ru(bpy)3Cl2掺杂SiO2纳米粒子表面的抗体密度对测定时荧光强度的影响,将Ru(bpy)3Cl2掺杂SiO2纳米粒子与不同量的羊抗人IgG抗体结合,然后进行免疫测定,测定荧光信号的强弱。实验结果如图9所示,当羊抗人IgG抗体用量为10μg时,荧光信号仅为与50μg羊抗人IgG结合时的43%(测定IgG的浓度为10 ng/ mL)。当抗体量从5μg到25μg到50μg变化时,响应值随之增加。然而,当羊抗人IgG抗体浓度变为75μg时,Ru(bpy)3Cl2掺杂SiO2纳米粒子的响应值降低。因此,羊抗人IgG抗体密度的最佳浓度为75μg抗体/mg Ru(bpy)3Cl2掺杂SiO2纳米粒子。
2.6 荧光纳米颗粒浓度优化
免疫分析中,在相同的抗体密度的条件下,抗体修饰的Ru(bpy)3Cl2掺杂SiO2纳米粒子的用量对免疫测定的信号具有较大的影响。因此考察了在加入相同体积的抗体修饰的Ru(bpy)3Cl2掺杂SiO2纳米粒子溶液和相同测定抗体浓度时荧光强度的变化情况。实验结果如图10显示,测定人IgG的质量浓度为100 ng/mL,当Ru(bpy)3Cl2掺杂SiO2纳米粒子质量浓度在0.1至10μg/mL范围变化时,荧光强度随浓度的增加而增强。当浓度继续增加时,由于非特异性吸附的增加和标记抗原达到饱和,使荧光强度不再增加。因此选择10μg/mL为最佳条件。
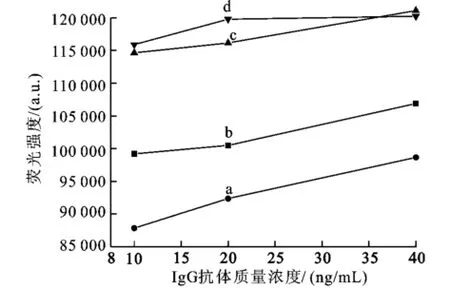
图9 荧光纳米粒子表面抗体密度对免疫检测的影响Fig.9 Effect of fluorescent microsphere surface antibody density on assay response.Antibody density w as increased by increasing amounts of antibody incubated per milligram of nanoparticles: 10 ug(a),25 ug(b),50 ug(c),75 ug(d)
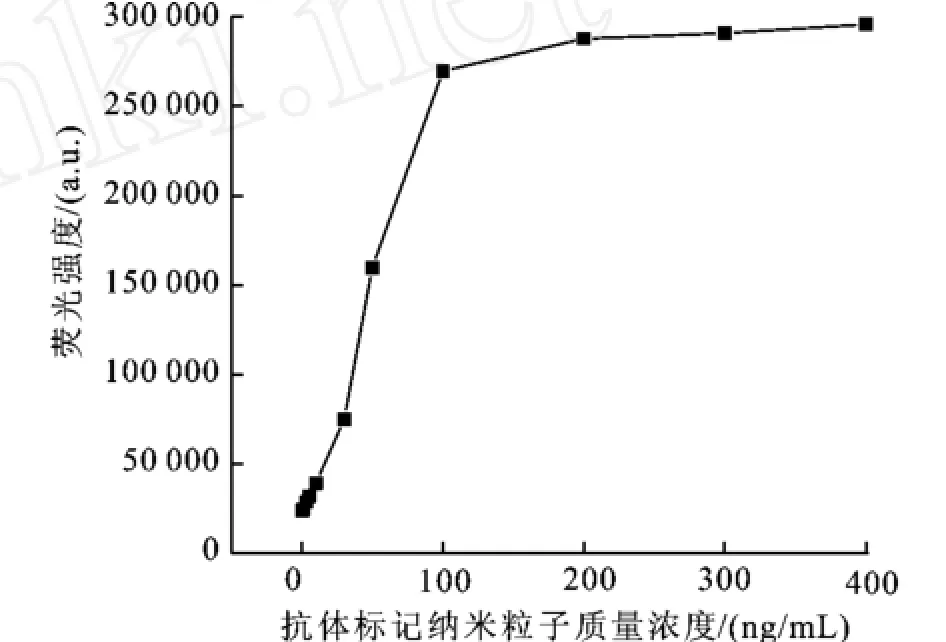
图10 抗体修饰的纳米粒子浓度对免疫分析信号强度的影响Fig.10 Effect of nanoparticles labeled with antibody concentration on assay response at fixed 50 ul antibody per mg nanoparticles in the presence of 100ng/ml hIgG
2.7 分析性能
Ru(bpy)3Cl2掺杂SiO2纳米粒子标记免疫分析对人IgG测定,在最佳条件下,荧光强度与人IgG质量浓度在一定的范围内成正比。线性范围1~100 ng/mL,回归方程为IF=114 882+1191.3 [IgG](ng/mL)(如图11),线性相关系数为R2= 0.997,检出限为0.3 ng/mL(3σ)。对质量浓度为50 ng/mL的人IgG测定11次的RSD为2.2%,表明该方法具有好的精密度。
2.8 分析应用
为了评价本文所建立方法的可靠性,我们将9个不同人血清样品用本文建立的化学发光法与免疫比浊法同时测定,结果如表2-1所示。将两者得出的结果进行比较,可知两者的检测结果相关性很好,表明本文建立的方法可靠,可用于实际样品的测定。
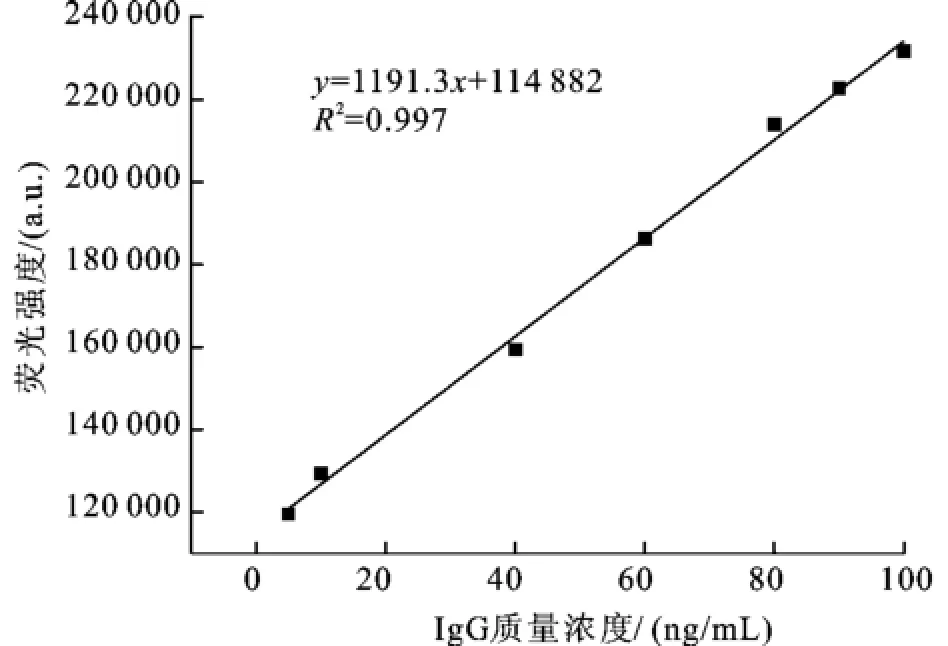
图11 IgG浓度与荧光强度的关系曲线Fig.11 Calibration curve between the fluorescence intensity and concentrations of IgG
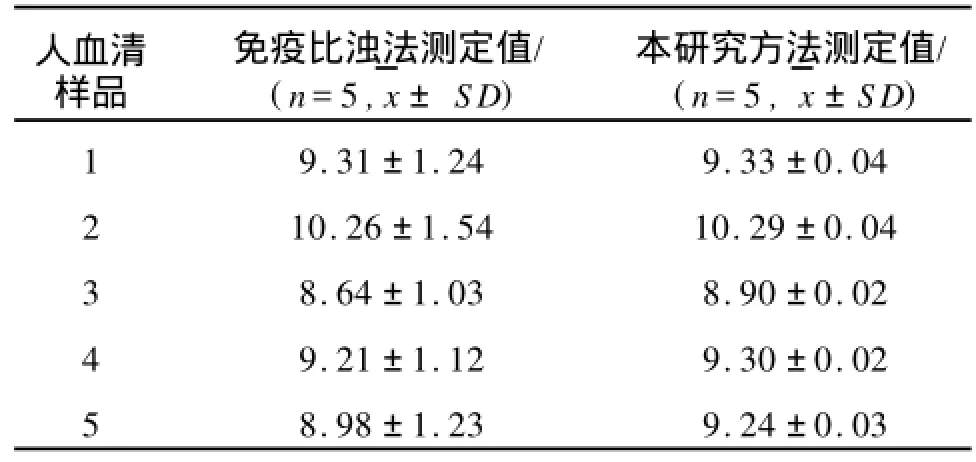
表1 人血清样品中IgG浓度的测定值Tab.1 The measured concentration values of IgG in human serum samplesg/L
3 结 语
我们结合纳米技术、生物技术和荧光标记技术,建立了一种用Ru(bpy)3Cl2掺杂SiO2纳米粒子作为荧光标记物测定IgG的荧光免疫分析新方法。本方法具有灵敏度高,操作简便和精密度高的特点,已成功地应用于人血清中IgG含量的测定,在生命体系的超痕量分析中具有非常重要的意义。
[1]Wei lian,Sally A.Litherland,Hassan Badrane,Weihong Tan et al.Ultrasensitive detection of biomolecules with fluorescent dry-doped nanoparticles[J].annlytical biochemistry,2004(334):135-144.
[2]Lam,M.T.,Wan,Q.H.,Boulet,C.A.,Le,X.C.Competitive immunoassay for staphylococcal enterotoxin A using capillary electrophoresis with laser-induced fluorescence detection[J].Chromatogr.A.1999,853(1-2):545-553.
[3]Giletto,A.,Fyffe,J.G.,A novel ELISA format for the rapid and sensitive detection of staphylococcal enterotoxin A [J].Biosci Biotechnol Biochem,1998,62(11):2217-2222.
[4]Baeyens,W.R.G.,Schulman,S.G.,Calokerinos,A.C.,Zhao,Y.,Campana,A.M.G.,Nakashima,K.,De Keukeleire,D.Chemiluminescence-based detection:principles and analytical applications in flowing streams and in immunoassays[J].Pharm Biomed Anal,1998,17(6-7):941-953.
[5]Roda A,Pasini P,Guardigli M,Baraldini M,Musiani M,Mirasoli M.Bio-and chemiluminescence in bioanalysis[J]. Fresenius J Anal Chem,2000,366(6-7):752-759.
[6]Goldman ER,Balighian ED,Mattoussi H,Kuno MK,Mauro JM,Tran PT,Anderson GP,Avidin.a natural bridge for quantum dot-antibody conjugates[J].Am Chem Soc.2002,124(22):6378-6382.
[7]M.Dyba,S.W.Hell.Photostability of a Xuorescent marker under pulsed excited-state depletion through stimulated emission[J].Appl Opt.2003,42(25):5123-5129.
[8]L.Galassi.Wavelength dependence of the time course of fluorescence enhancement and photobleaching during irradiation of ethidium bromide-stained nuclei[J].Eur.J.Histochem,2000,44:419-432.
[9]Cummins CM,Koivunen ME,Stephanian A,Gee SJ,Hammock BD,Kennedy IM.Application of europium(III)chelate -dyed nanoparticle labels in a competitive atrazine fluoroimmunoassay on an ITO waveguide[J].Biosens Bioelectron, 2006,21(7):1077-1085.
[10]Xu Hun,Zhujun Zhang.Functionalized fluorescent core-shell nanoparticles used as a fluorescent labels in fluoroimmunoassay for IL-6[J].Biosensors and Bioelectronics,2007,22:2743-2748.
[11]Santra S,Wang K,Tapec R,Tan W.Development of novel dye-doped silica nanoparticles for biomarker application [J].Biomed Opt,2001,6(2):160-166.
[12]Santra S,Zhang P,Wang K,Tapec R,Tan W.Conjugation of biomolecules with luminophore-doped silica nanoparticles for photostable biomarkers[J].Anal Chem,2001,73(20):4988-93.
[13]Bagwe RP,Yang C,Hilliard LR,Tan W.Optimization of dye-doped silica nanoparticles prepared using a reverse microemulsion method[J].Langmuir.2004 Sep 14;20(19):8336-8342.
[14]Sharma P,Brown S,Walter G,Santra S,Moudgil B.Nanoparticles for bioimaging[J].Adv Colloid Interface Sci,2006, 123-126:471-485.
[15]Santra S,Xu J,Wang K,Tan W.Luminescent nanoparticle probes for bioimaging[J].Nanosci Nanotechnol,2004,4 (6):590-599.
[16]Santra S,Dutta D,Walter GA,Moudgil BM.Fluorescent nanoparticle probes for cancer imaging[J].Technol Cancer Res Treat,2005,4(6):593-602.
[17]Santra S,Zhang P,Wang K,Tapec R,Tan W.Conjugation of biomolecules with luminophore-doped silica nanoparticles for photostable biomarkers[J].Anal Chem,2001,73(20):4988-93.
[18]X.Zhao,R.Tapec-Dytioco,W.Tan.Ultrasensitive DNA detection using highly fluorescent bioconjugated nanoparticles[J].Am.Chem.Soc.2003,125:11474-11475.
[19]Qhobosheane M,Santra S,Zhang P,Tan W.Biochemically functionalized silica nanoparticles[J].Analyst,2001,126 (8):1274-1278.
[20]Santra S,Wang K,Tapec R,Tan W.Development of novel dye-doped silica nanoparticles for biomarker application [J].Biomed Opt,2001,6(2):160-166.
[21]何晓晓,王柯敏,谭蔚泓等.基于生物荧光纳米颗粒的新型荧光标记方法及其在细胞识别中的应用[J].科学通报.2001, 46(16):1353-1356.
HE Xiaoxiao,WANG Kemin,TAN Weihong.Fluorescent marker method based on the bio-fluorescent nanoparticles and its application in cell recognition.[J].Chinese Science Bulletin,2001,46(16):1353-1356.(in Chinese)
[22]李朝辉,王柯敏,谭蔚泓等.硅壳包被的核壳型量子点荧光纳米颗粒的制备及其在细胞识别中的应用[J].科学通报. 2005,50(13):1318-1321.
LI Zhao-hui,WANG Kemin,Weihong Tan.Preparation of quantum dots core-shell silica nanoparticles and their application in cell recognition[J].Chinese Science Bulletin,2005,50(13):1318-1321.(in Chinese)[23]Kiselev MV,Gladilin AK,Melik-Nubarov NS,Sveshnikov PG,Miethe P,Levashov AV.Determination of cyclosporin A in 20%ethanol by a magnetic beads-based immunofluorescence assay[J].Anal Biochem,1999,269(2):393-398.(in Chinese)
(责任编辑:杨萌)
Fluoroimmunoassay for Human IgG Using Ru(bpy)3Cl2-doped Fluorescent Silica Nanoparticles as Labels
XU Huan1,2, WAN G Zhou-ping*1,2, YANG Zhen1,2, WU Jia1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Fluorescent-labeled molecules have been widely used in biological detection and diagnosis.In this manuscritpt,the Ru(bpy)32+-doped silica nanoparticles were firstly prepared with a modified W/O method.Human IgG(hIgG)was measured based on the specific interaction between hIgG and functionalized fluorescent core-shell nanoparticle-labeled gost anti-hIgG.The calibration graph for hIgG was linear over the range 1-100 ng/mL with a detection limit of 0.3 ng/mL.From 11 measurements,the R.S.D.is 2.2%for samples of 30 ng/mL of hIgG.The results demonstrated that the method have a potential advantages of sensitivity,simplicity and good reproducibility for the determination of hIgG,and is applicable to the determination of hIgG in serum samples.
fluorescent core-shell nanoparticle,rubpy,fluoroimmunoassay,hIgG
TL 271.5
:A
1673-1689(2010)01-0110-08
2008-06-25
国家863计划项目(2008AA10Z419),教育部博士点基金新教师项目(20070295014),江苏省大学生实践创新项目,江南大学科学基金项目。
*通讯作者:王周平(1974-),男,陕西凤翔人,理学博士,教授,博士生导师。主要从事食品营养与安全分析研究。Email:wangzp@jiangnan.edu.cn
