SOE-PCR技术在洛伐他汀九酮合成酶基因克隆中的应用
2010-08-27李东栋
黄 卓,李东栋,张 琳,严 珊
(海南大学 材料与化工学院,海南 海口 570228)
SOE-PCR技术在洛伐他汀九酮合成酶基因克隆中的应用
黄 卓,李东栋*,张 琳,严 珊
(海南大学 材料与化工学院,海南 海口 570228)
为了验证SOE-PCR技术在洛伐他汀九酮合成酶基因(LOVB)克隆中的应用,以土曲霉基因组DNA为模板,设计4对引物,分别扩增LOVB的4个外显子,并按一定的顺序,利用SOE-PCR技术将其一一串联起来,形成LOVB①-④的cDNA序列.结果表明:重叠延伸PCR成功扩增出了LOVB①-④的cDNA序列,大小1.3kb左右,测序结果和NCBI中登录号为AF151722. 1的洛伐他汀九酮合成酶基因LOVB①-④的cDNA序列比对,同源性为98.5%.
重叠延伸PCR;洛伐他汀;聚酮合成酶;他汀类药物
洛伐他汀(lovastatin)是一种丝状真菌的次生代谢产物,它能竞争性抑制胆固醇生物合成限速酶HMG-CoA还原酶的活性,是一种有效的降胆固醇药物[1].洛伐他汀是第一个经FDA批准上市的降血脂他汀类药物,自1979年第一次从红曲霉中分离出后,因其良好的降血脂功能,吸引了人们对其药物机理、生物合成、发酵及临床应用等方面研究的兴趣[2-4].已知的洛伐他汀产生菌主要是土曲霉和红曲霉.利用土曲霉生产洛伐他汀是目前主要的工业化生产方法.目前国内一般是通过菌种改良、优化发酵条件和优化发酵产物分离纯化方法来提高洛伐他汀产率,但这类方法提高洛伐他汀生产水平的效果是有限的.随着洛伐他汀生物合成酶基因结构与功能研究的不断深入,通过基因工程技术来提高洛伐他汀产率是近年来的主要方向.笔者根据Kenndy J等[5]报道的土曲霉基因组DNA中LOVB的基因序列,设计4对引物,利用SOE-PCR技术获得LOVB①-④的cDNA序列,为今后毕赤酵母表达洛伐他汀九酮合成酶基因奠定了坚实的基础.
1 材料与方法
1.1 菌种与试剂
1.1.1 菌种
E.coli JMl09(本实验室保存),土曲霉(购自广东省微生物研究所微生物菌种保藏中心).
1.1.2 试剂
Taq DNA聚合酶和Pfu DNA聚合酶购自Fermentas公司;pMDR18-TVector试剂盒购自大连宝生物公司;分子量标准DL2000 Marker、λDNA/Hind III Marker购自广州东盛科技有限公司;DNA凝胶回收试剂盒购自AXYGEN公司;引物合成与序列测定由上海英骏生物技术有限公司完成.
1.2 方法
1.2.1 土曲霉基因组DNA提取
参照CHRISTENSES等的TENS法[6].
1.2.2 引物设计与合成
根据Kenndy J等报道的LOVB基因序列,分别设计重叠引物:

其中下划线部分为重叠序列.
1.2.3 重叠PCR扩增
LOVB基因4个外显子的扩增按常规PCR方法进行,纯化用DNA凝胶回收试剂盒回收.反应体系:外显子①和外显子②为模板,10×Buffer 2.5μL,2 mmol/L MgCl2,0.2mmol/L dNTPs,2.5U Pfu DNA聚合酶,加双蒸水至25 mL,在不加引物的条件下,95℃变性30 s,47℃退火1.5min,72℃延伸1.5min,8个循环.然后加入0.2μmol P1和P4引物.设定反应条件为95℃30 s,52℃30 s,72℃1.5min,24个循环,72℃延伸10 min,4℃保存.同理,LOVB③和LOVB④的拼接程序同上.得到重叠产物LOVB①②和LOVB③④纯化回收后,以其为模板,延伸时间为2.5min,引物为P1和P8,其他反应条件不变.
1.2.4 PCR产物的连接转化与测序
扩增产物经1%琼脂糖凝胶电泳分离后,用DNA凝胶回收试剂盒将目的片段回收纯化,连接于pMDR18-T载体上.将连接好的质粒热激转化已制备好的感受态E.coli JM109.通过蓝白筛选和菌落PCR初步鉴定后,将阳性菌落于37℃震荡培养过夜,次日收集菌体,送至上海英骏生物技术有限公司完成测序.
2 结果与分析
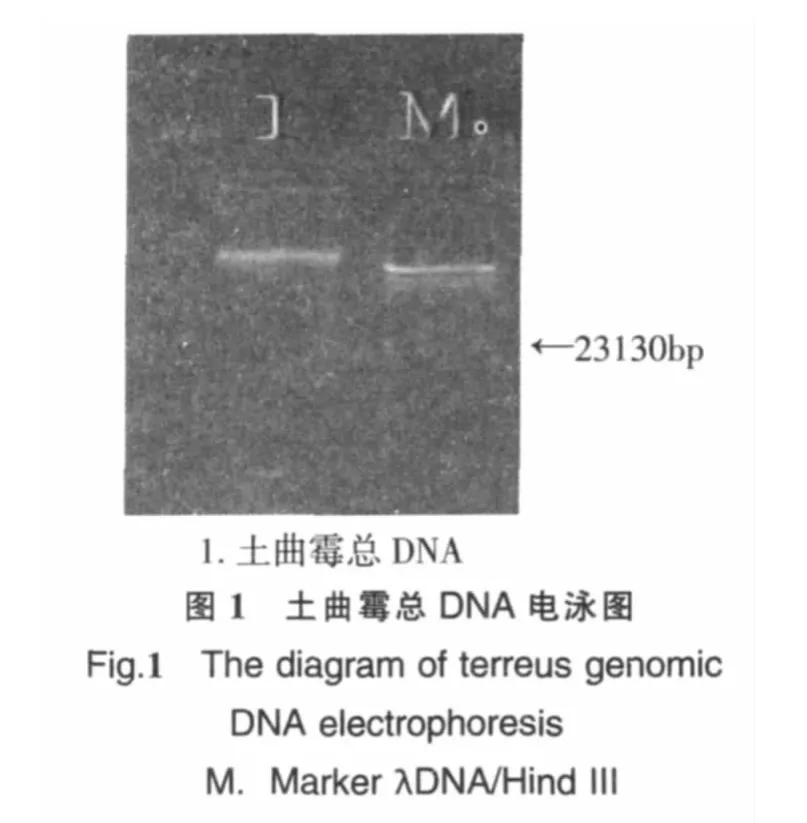
2.1 土曲霉基因组DNA的提取结果
通过去除蛋白质和RNA,获得了土曲霉的总DNA,大小60 kb左右,和预测结果64 kb相比基本符合.经电泳检测,结果见图1.从图中可以看到一条清晰明亮的DNA条带,条带明显,无拖尾现象.说明获得的样品DNA降解非常少,可用于下步PCR反应.
2.2 第一轮PCR扩增结果
分别以P1/P2,P3/P4,P5/P6,P7/P8为引物,土曲霉总DNA为模板进行PCR扩增.优化缓冲液体系、镁离子浓度和模板DNA的稀释倍数等参数,结果显示第一轮PCR扩增的产物均为一条特异的DNA条带,结果见图2.泳道1大小为522 bp左右,和外显子①的大小一致;泳道2大小为213 bp左右,和外显子②的大小一致;泳道3大小为226bp左右,和外显子③的大小一致;泳道4大小为342 bp左右,和外显子④的大小一致.由此可以初步确定扩增到洛伐他汀九酮合成酶基因LOVB的四个外显子片段.
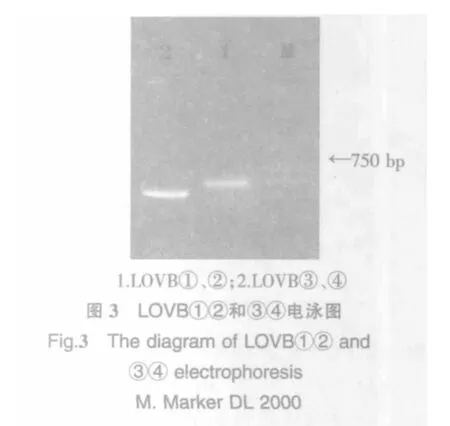
2.3 第二轮PCR扩增结果
分别以P1/P4,P5/P8为引物,LOVB①/②,③/④的PCR回收产物为相对应的模板分别进行PCR扩增.优化缓冲液体系、镁离子浓度和模板DNA的稀释倍数等参数,结果见图3.泳道1大小为740 bp左右,和LOVB①②的大小一致;泳道2大小为570 bp左右,和LOVB③④的大小一致.由此可以初步确定扩增到洛伐他汀九酮合成酶基因LOVB的重叠片段①②和③④.

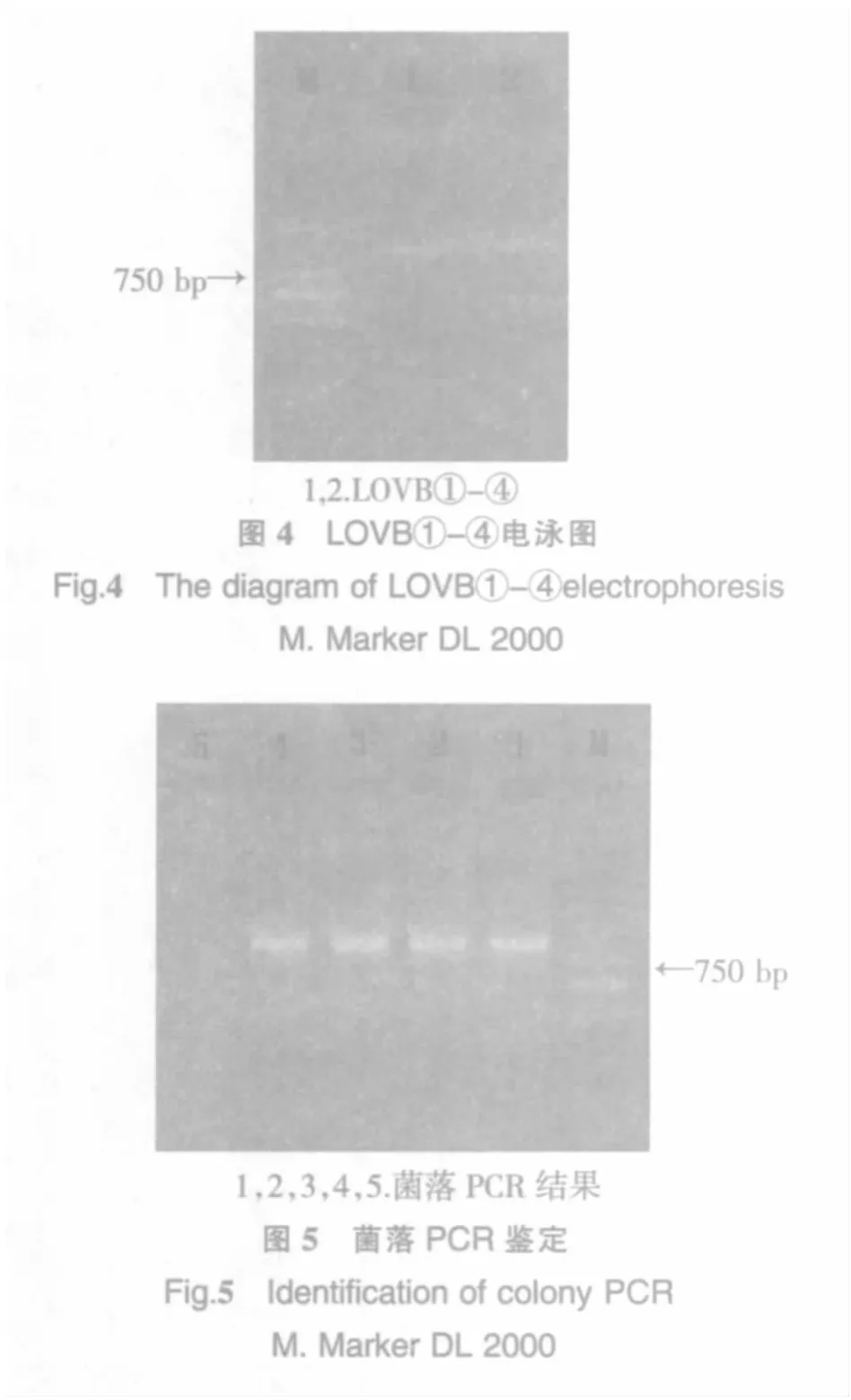
2.4 第三轮PCR扩增结果
以P1/P8为引物,LOVB①②/③④的PCR回收产物为模板进行PCR扩增.优化缓冲液体系、镁离子浓度和模板DNA的稀释倍数等参数,结果见图4.泳道1,2大小为1 300 bp左右,和LOVB①-④的大小一致.由此可以初步确定扩增到洛伐他汀九酮合成酶基因LOVB的重叠片段①-④.
2.5 重组质粒的菌落PCR和序列分析结果
对鉴定为阳性的菌落进行测序,结果见图6,该序列与NCBI上登陆号为AF151722.1的洛伐他汀九酮合成酶基因LOVB的DNA序列进行Blast比对后,发现有20个碱基不同,同源率达98.5%.
3 讨论
他汀类药物是一类重要的聚酮类化合物[7],由于聚酮化合物具有复杂的结构,通常我们不能通过化学合成的方法来进行大规模生产,这就意味着通过发酵的方式生产具有药理活性的聚酮类化合物将会成为工业化生产的唯一途径.随着洛伐他汀生物合成酶基因结构与功能研究的不断深入,通过异源表达来提高其生产水平是近10年来的主要研究方向.如Kennedy、Park等[5,7-8]利用基因工程技术将洛伐他汀生物合成基因组中调节其合成过程的编码基因LovE复制到一株野生型菌株中,使洛伐汀产量提高了5~7倍.


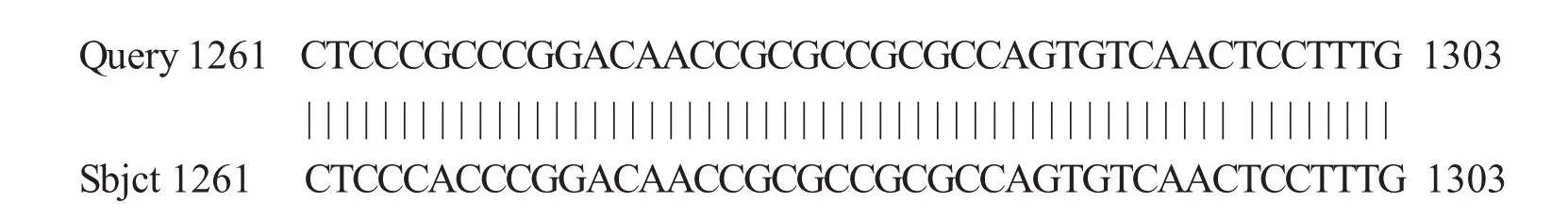
图6 序列测定和分析结果Fig.6 The results of sequence detrMination and analysis
LOVB基因负责合成洛伐他汀生物合成过程他中的一种重要酶,即洛伐他汀九酮合成酶(LNKS).本研究应用重叠延伸PCR技术,根据洛伐他汀九酮合成酶基因LOVB的DNA序列分别设计了4对引物,扩增其4个外显子,然后按一定的顺序将其一一拼接起来,从而获得了LOVB①-④的cDNA序列,大小1 303 bp,该序列与NCBI上登陆号为AF151722.1的洛伐他汀九酮合成酶基因LOVB的DNA序列比对后,发现有20个碱基不同,同源率达98.5%.测序结果比对后有20个碱基不同,可能原因是因为多次的回收纯化操作,使得目的片段在紫外线暴露时间过长,从而导致部分碱基突变,或者是因为重叠PCR得到的产物不是亲本片段通过直接连接产生,而是通过PCR扩增产生的复制品,经过多轮重叠PCR后其保真度会受到一定程度的影响.
[1]Tobert J A.Lovastatin and beyond:The history of the HMG-CoA reductase inhibitors[J].Nat Rev Drug Discovery,2003,2:517-526.
[2]Manzoni M,Rollini M.Biosynthesis and biotechnological Production of statins by filamentous fungi and application of these cholesterol-lowering drugs[J].APPl Microbiol Biotechnol,2002,58:555-564.
[3]高蓝,李浩明.洛伐他汀生物合成及其相关基因研究进展[J].药物生物技术,2005,12(3):201-206.
[4]张骁,束梅英.他汀类降血脂药物的研究进展[J].中国制药信息,2001,17(12):10-18.
[5]Kenndy J,Auclair K,KendreWS G,et al.Modulation of polyketides synthase activity by accessory proteins during lovastatin biosynthesis[J].Science,1999,284:136.
[6]Christense B,Fink J,Merrifield R B,et al.Channel-forming properties of cecropins and related model compounds incorporated into planar lipid membranes[J].Proc Natl A-cad Sci USA,1988,85:5072-5076.
[7]Julia S,Christian H.Advances in cloning,functional analysis and heterologous expression of fungal polyketide synthase genes[J].Biotechnology,2006,124:690-703.
[8]Park C,Hutchinson C R,Kennedy J.Method of Producing antihypercholesteroleMic agents:USA,2004033570[P]. 2004-02-19.
责任编辑:黄 澜
Application of SOE-PCR in the Lovastatin Nonaketide Synthase Gene Cloning
HUANG Zhuo,LI Dongdong*,ZHANG Lin,YAN Shan
(College of Material and Chemical Engineering,Hainnan University,Haikou 570228,China)
In order to verify the application of SOE PCR in the lovastatin nonaketide synthase gene(LovB)cloning,4 couples of primers were designed to amplify 4 exons of LovB,after which the exons can be connected by overlapping PCR one by one to forMthe cDNA sequence of LovB①-④.The results indicated that the exons of LovB①-④ with the size of 1300bp was amplified successfully by overlapping PCR,the sequencing result was blasted with the LovB cDNA sequence titled AF151722.1 in the NCBI,which showed the 98.5%homoeology.
overlapping extension PCR;lovastatin;polyketide synthase;statins
R 392.11
A
1674-4942(2010)03-0300-06
2010-04-13
国家自然科学基金(30560092)
*通讯作者
