高效液相色谱法检测兔血浆中甲氧滴滴涕的浓度
2010-08-21周红宇肖仲祥张馨王萍胡国新
周红宇,肖仲祥,张馨,王萍,胡国新
(温州医学院 药学院,浙江 温州 325035)
甲氧滴滴涕(methoxychlor,MXC),又称甲氧氯,化学名为1,1-三氯-2,2-双(4-甲氧基苯基)乙烷,属有机氯杀虫剂,因具有高效和低残留的特点而取代滴滴涕(DDT)广泛应用,在土壤、工业废水及城市污水中均有检出[1-2]。近年来的研究表明MXC能干扰生殖内分泌系统,降低生育能力,并且具有遗传毒性,是重要的农药类内环境干扰物[3-6]。MXC为脂溶性物质,在受污染的环境中的可通过胃肠道、皮肤及呼吸道进入机体,但其在体内的毒动学过程尚缺乏研究。本研究采用高效液相色谱(HPLC)法检测血浆样品中的MXC浓度,并研究其在兔体内的毒代动力学过程。
1 材料和方法
1.1 材料
1.1.1 仪器:高效液相色谱仪为美国Agilent1100系列,包括G1322A在线脱气机,G1311A四元泵,G1313A自动进样器,G1316A柱温箱,G1315B二极管阵列检测器,Agilent化学工作站(Rev A.08.03.[847])。电子分析天平,涡旋混合器,恒温水浴箱,台式高速离心机等。
1.1.2 药品与试剂:MXC(批号357-25,纯度98%,北京明尼克分析仪器设备中心);马拉硫磷(批号5041-2168,纯度99.2%,安捷伦科技有限公司);乙腈(一级色谱纯,德国默克公司);乙酸乙酯,正己烷(色谱纯,天津四友生物医学技术有限公司);甲醇(一级色谱纯,天津四友精细化学品有限公司);NaF(批号20051125,纯度98%,上海三爱试剂有限公司)。
1.1.3 实验动物:日本大耳兔5只,体重(3.0±0.22)kg,由温州医学院实验动物中心提供,动物合格证号:浙医动字第2203001号。
1.2 方法
1.2.1 色谱条件:色谱柱为Eclipse XDB-C18(4.6×150 mm,5μm,Agilent,USA),流动相为乙腈-水(70:30,V/V)。流速:1.0 mL/min;柱温:30 ℃;检测波长:240 nm;参比波长:380 nm;检测灵敏度:0.05 mAU;内标:马拉硫磷。
1.2.2 血浆样品预处理:准确吸取血浆1.0 mL于10 mL具塞试管中,加入25 g·L-1NaF 100μL,静置10min加入0.3 g·L-1马拉硫磷内标液40μL,加乙酸乙酯-正己烷(4:1,V/V)萃取液2 mL,涡旋混匀后3000×g 离心10 min,取上层有机相1.8 mL于另一锥底试管中,37℃水浴条件下氮气流吹干。用200μL流动相复溶,20μL进样检测。
1.2.3 标准曲线的制备:取9只10 mL具塞试管,加入空白血浆1.0 mL,25 g·L-1NaF 100μL,静置10 min后,加入不同浓度的MXC标准液,配成浓度相当于0.05、0.1、0.25、0.5、1.0、2.5、5、10 μg·mL-1的血浆样品,按“1.2.2”项”方法处理后,测定MXC峰面积Ai和内标峰面积As,以Ai/As为纵坐标,以所对应各点浓度(C)为横坐标绘制标准曲线。
MXC的标准曲线回归方程为血浆标准曲线:C=1.1573Ai/As-0.0245 (r=0.99993);最低检测限均为0.05 mg·L-1。
1.2.4 方法验证:配制浓度分别为0.1、1.0和5.0 mg·L-1的MXC血浆标准品溶液,每个浓度平行5管,按文献[7]考察本方法的回收率和精密度。
1.2.5 动物实验:日本大耳兔5只,MXC用玉米油溶解灌胃,剂量为200 mg·kg-1,分别于给药前和给药后 5、10、20 min,1、2、4、6、9、 12、18、24 h,取静脉血2 mL,注入肝素化的试管,3000×g离心10 min,取血浆,-40 ℃保存备测。
1.2.6 数据处理:实验结果采用中国药理学会数学药理专业委员会编写的DAS药代动力学计算程序进行数据处理,用房室模型计算MXC的毒动学参数。
2 结果
2.1 方法验证 图1为空白血浆、MXC纯标、MXC血标、及含MXC的血浆样品经HPLC分析测定得到的色谱图。由图可见在本实验条件下,MXC与内标马拉硫磷能完全分离,没有明显的内生杂质峰干扰。内标的保留时间为3.4 min,MXC的保留时间为7.1 min。本方法具有较高的专属性,回收率和精密度符合生物样品分析指导原则的要求[8](见表1)。
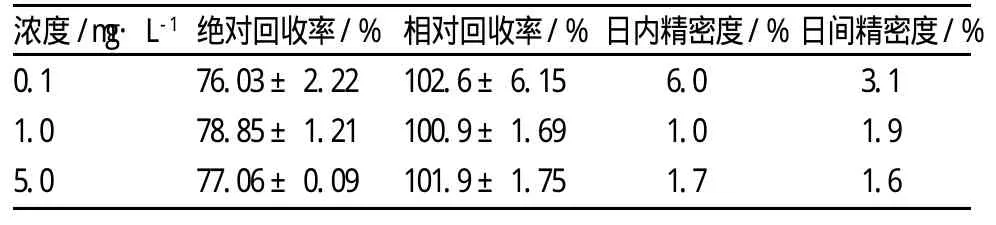
表1 回收率和精密度
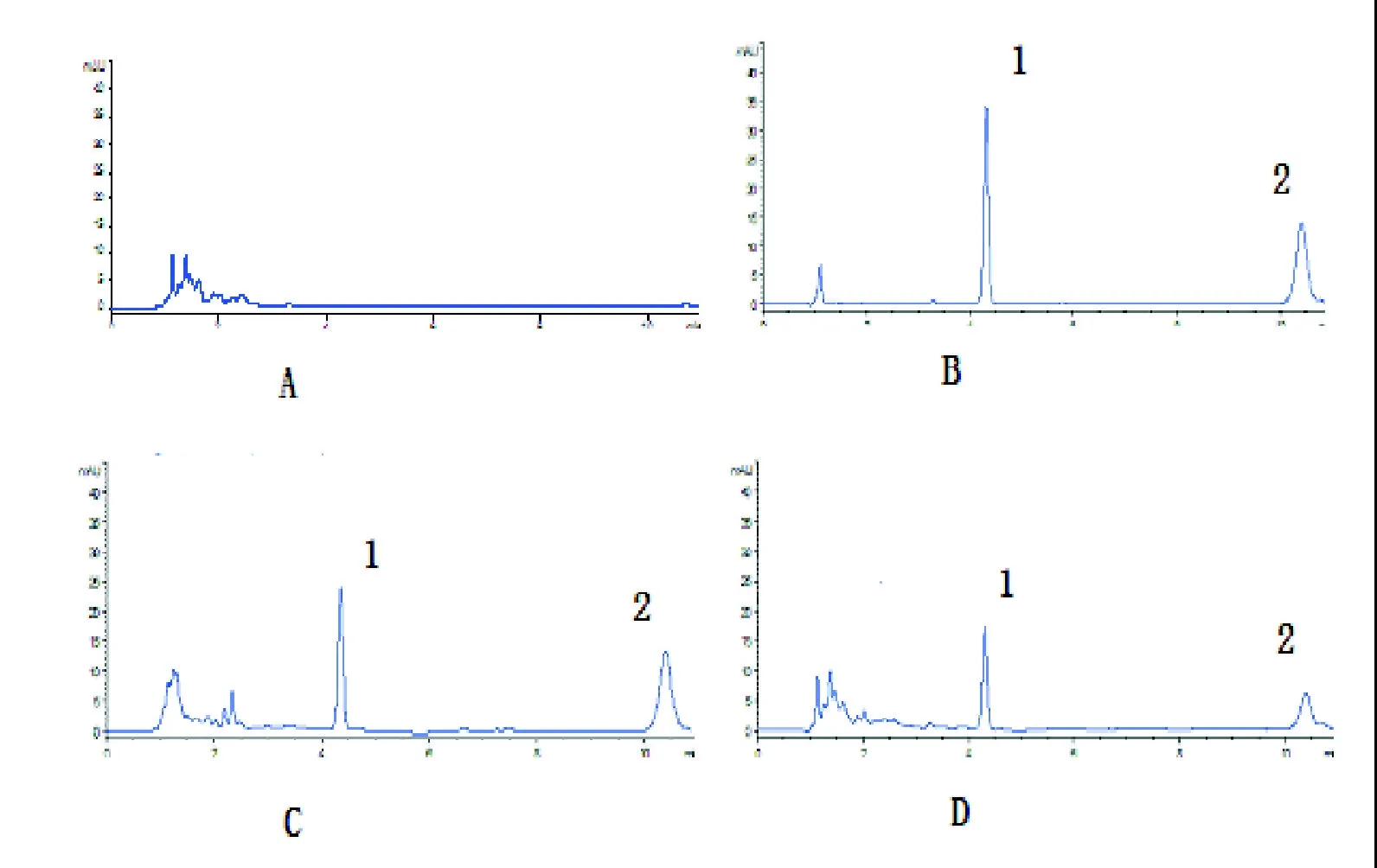
图1 MXC血浆色谱图
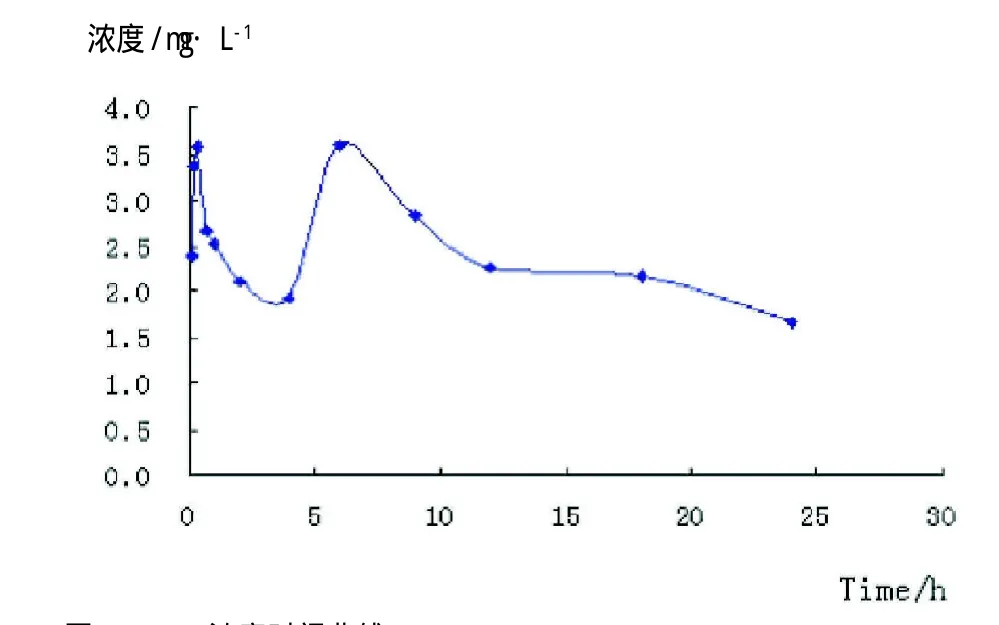
图2 MXC浓度时间曲线
2.2 MXC在兔体内的毒代动力学 200 mg·kg-1MXC一次性灌胃后, 兔血浆中MXC的浓度时间曲线见图2。结果表明,MXC在兔体内的动力学过程呈双峰现象。因目前DAS软件无法拟合双峰现象,将整个体内过程分为(0.083~4)h和(4~24)h两个时间段处理,均符合一级动力学二室模型。主要的动力学参数见表2。
3 讨论
MXC为重要的环境激素类农药,可通过多种机制而产生生殖毒性,涉及氧化应激反应,拟雌二醇作用,对生殖细胞及胚胎的毒性及干扰神经、免疫系统的功能等[6],已成为目前研究的热点。因此有必要建立统一、合理、灵敏的检测方法并开展毒代动力学研究,以了解MXC在动物体内血浆浓度变化的规律及其与各系统毒性作用的关系。目前MXC的检测主要采用气相色谱法和气质联用法[1-2,9],用于环境、农产品、及生物样品中微量农药残留的检测,鲜见毒动学研究的报道。气质联用和气相色谱检测法灵敏度高,峰型好,能同时分辨多种农药,但仪器和试剂的成本也高,样品的前期处理复杂,对实验条件要求的较高。因MXC的毒性较低,家兔急性经口半数致死量>2000 mg·kg-1[6]。可适当加大给药剂量而获得较高的血药浓度,本实验中给兔灌服200 mg·kg-1的MXC,除个别动物有轻微的中枢兴奋外无其他异常中毒反应。因此本研究尝试用HPLC法检测血浆样品中的MXC浓度,并进行整体动物的毒代动力学研究。
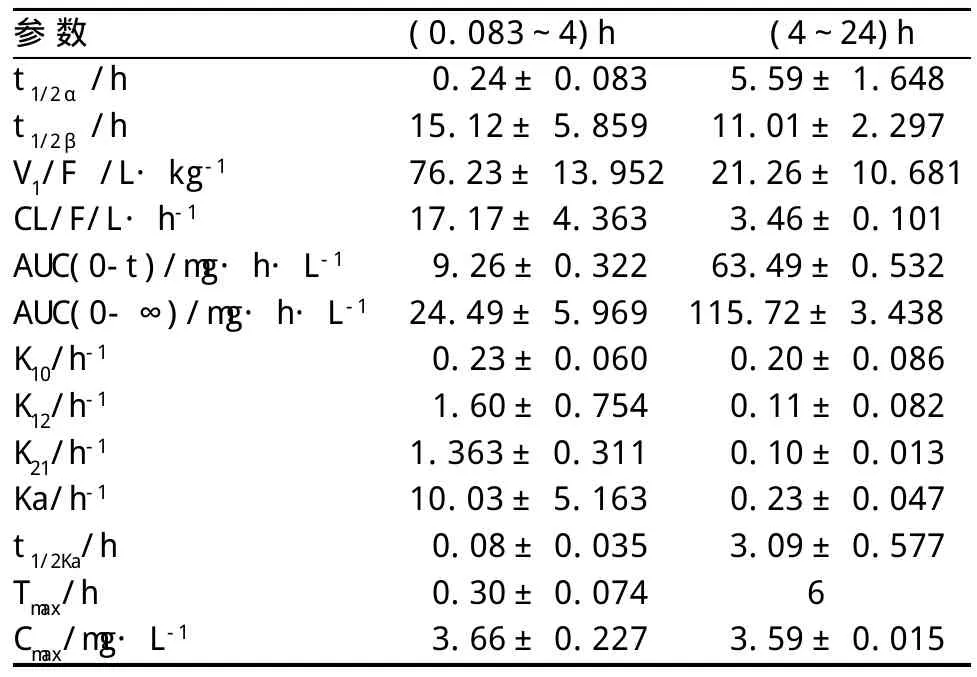
表2 MXC在家兔体内的药动学参数
本研究中流动相采用乙腈和水,比例为70:30。在此条件下MXC与内标马拉硫磷能完全分离,没有明显的内生杂质峰干扰。提高乙腈的比例可使MXC出峰时间提前,峰型也更好,但内标马拉硫磷的出峰时间也提前,与血浆杂峰重叠;降低乙腈的比例可使MXC的出峰时间推迟,如比例为65:35时,MXC的出峰时间在10min左右,此时峰形变宽且与其后的杂峰有部分重叠。选择内标时,考虑到MXC脂溶性的特点,尝试了多种中枢抑制药、有机氯及有机磷农药,以马拉硫磷的出峰时间及峰型最为理想,但马拉硫磷在血浆样品中易被胆碱酯酶水解,因此血浆需事先用NaF处理,抑制胆碱酯酶活性。在本色谱条件下,出峰时间适当,峰形干净利落无干扰,而且所要求的预处理方法简便快速,适合动物实验中大量样本的检测。
毒代动力学研究表明,MXC 200 mg·kg-1灌胃后兔血浆中浓度的变化符合一级动力学二室模型;在给药后18 min和6 h出现两次峰浓度,分别为3.66和3.59 mg·L-1,双峰间隔时间较长,提示可能存在肝肠循环;两个时间段消除相半衰期分别为15.12和11.01 h,说明MXC一次性染毒后可在体内持续较长时间;MXC的血浆浓度较低,参照表2中V1、AUC及T1/2等药动学参数分析,MXC吸收完全,表观分布容积V1偏大,半衰期较长,因此其浓度偏低的原因可能主要是在组织中有较多的蓄积。MXC为低毒类有机氯农药,对人畜毒性小、使用安全,临床未见有急性中毒的报道,但其毒动学特点表明MXC在体内蓄积所致的慢性毒性仍需重视。
[1] 余彬彬,秦榜辉,牟义军,等. 气相色谱-串联质谱多离子监测分析土壤中的有机氯农药残留[J].分析试验室,2008,27(增刊):191-195.
[2] 陈明,任仁,王子健,等. 北京工业废水和城市污水中有机氯农药残留分析[J].中国环境监测,2007,23(4):29-32.
[3] Murono EP, Derk RC, Akugl Y. In vivo exposure of young adult male rats to methoxychlor reduces serum testosterone levels and ex vivo Leydig cell testosterone formation and cholesterol side-chain cleavage activity[J]. Reprod Toxicol,2006,21(2):148-153.
[4] Amstislavsky SY, Amstislavskaya TG, Amstislavsky VS, et al.Reproductive abnormalities in adult male mice following preimplantation exposures to estradiol or pesticide methoxychlor[J]. Reprod Toxicol, 2006, 21(2):154-159.
[5] Amenti AE, Zama AM, Passantino L, et al. Developmental methoxychlor exposure affects multiple reproductive parameters and ovarian folliculogenesis and gene expression in adult rats[J]. Toxicol Appl Pharmacol,2008,233(2):286-296.
[6] 常飞,陈必良. 环境激素类农药甲氧滴滴涕生殖毒性研究进展[J].国外医学:卫生学分册,2007,34(2):70-74.
[7] 周红宇,陈醒言,黄成珂,等.冰片对卡马西平在小鼠体内分布的影响[J]. 温州医学院学报, 2008,38(4):300-305.
[8] U.S. Food and Drug Administration, Centre for Drug Evauation and Research(CDER). Guidance for industry,bioanalytical method validation[EB/OL]. 2001[2009-08-02]. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM070107.pdf.
[9] 夏俊鹏,吴飞,刘红亚. 工作场所空气中甲氧滴滴涕的气相色谱测定方法研究[J].中国卫生检验杂志,2007,17(4):588-600.
