鸭源大肠杆菌O78菌蜕的制备及免疫原性研究
2010-08-06吕敏娜覃宗华余劲术袁建丰孙铭飞吴彩艳蔡建平
吕敏娜,覃宗华,余劲术,袁建丰,孙铭飞,吴彩艳,蔡建平
(广东省农业科学院兽医研究所广东省兽医公共卫生实验室,广东广州 510640)
埃希氏大肠杆菌(Escherichia coli)是一种血清型多样、能感染各种动物和人类并引起严重疾病的革兰氏阴性菌。由于抗生素的滥用/误用,导致E.coli耐药性菌株不断出现,给养殖业造成严重的经济损失,对动物和人类的健康都造成了危害,因此,免疫预防已成为防治E.coli病的首选方法。
细菌菌蜕(Bacterial ghost)是指缺乏细胞浆和核酸的无活力细菌菌(壳)体[1-2],是在噬菌体phiX174的裂解基因E所表达的裂解蛋白作用下,在G-细菌细胞膜上形成直径约40 nm~200 nm的特异性跨膜孔道,在渗透压差的作用下,细菌的胞质内容物由孔道流出[3-4],从而产生的细菌空壳。菌蜕完好地保留了菌体表面的各种抗原结构和粘附活性,可以类似活菌体诱导机体产生良好的免疫保护反应[5-6]。菌蜕技术被认为是研究开发新型基因工程疫苗的技术平台[7-8]。本研究通过构建鸭源E.coliO78/pHH43菌蜕及其免疫原性的试验研究,为进一步研制非变性灭活基因工程菌蜕疫苗奠定了基础。
1 材料和方法
1.1 主要材料 含有E基因的裂解重组质粒pHH43为本研究室保存;鸭源E.coliO78为本课题组从广东省珠三角地区某发病鸭场分离、鉴定并保存的菌珠;庆大霉素、氯霉素均购自上海生工生物工程服务有限公司;实验雏鸭购自广州市郊某养鸭场。
1.2 E.coliO78/pHH43菌蜕的制备
1.2.1 质粒pHH43转化E.coliO78将pHH43转化氯化钙法制备的感受态E.coliO78后,以含氯霉素(34 μg/mL,以下同)的LB琼脂平板进行筛选,挑取单菌落于含氯霉素的LB液体培养基中培养。所筛选阳性转化菌命名为E.coliO78/pHH43。
1.2.2 E.coliO78/pHH43菌蜕的制备 E.coli O78/pHH43接种含氯霉素的LB平板上,28℃恒温培养过夜;挑取单菌落于3 mL含氯霉素的LB液体培养基中,28℃200 r/min振荡培养过夜,次日取1 mL转接于30 mL LB液体培养基中,28℃200 r/min培养至OD600nm为0.4~0.5时,升温至42℃,诱导4 h。其间每隔1 h取样,测定OD600nm及活菌数,观察其诱导结果。
1.2.3 裂解效率观察 将诱导后E.coliO78/pHH43菌蜕做如下处理:一是直接冻干;二是以PBS洗涤3次,5000 r/min,10 min,定容到原体积后进行冻干。冻干后用同体积的LB液体培养基重悬,各取冻干前、后的菌液进行活菌计数,按失活率=(1-冻干后活菌数/冻干前活菌数)×100%计算失活率。
冻干后重悬的E.coliO78/pHH43菌液分别添加不同浓度的庆大霉素(62 μg/mL~150 μg/mL),室温作用1 h后,分别涂布LB平板(含上述浓度氯霉素,100 μL/板),37℃恒温箱培养16 h,确定使未裂解存活菌完全失活的庆大霉素浓度。
1.3 鸭源E.coli菌蜕的免疫原性研究
1.3.1 抗原的制备 E.coliO78/pHH43菌蜕的制备:将诱导4 h的E.coliO78/pHH43菌液用PBS洗涤3次,冻干后重悬,添加庆大霉素(124 μg/mL),经无菌检验合格,即为E.coliO78/pHH43菌蜕,置4℃保存备用。
E.coliO78福尔马林灭活菌苗:E.coliO78菌液加入福尔马林灭活,经无菌检验合格后,加入蜂胶佐剂(10 mg/mL),置4℃保存备用。
1.3.2 实验动物和免疫方法 试验组1:E.coliO78/pHH43菌蜕以不同剂量4×109cfu/只、6×109cfu/只、8×109cfu/只、1×1010cfu/只和 1.2×1010cfu/只分别接种7日龄雏鸭,30只/组,观察免疫保护效果。
试验组2:E.coliO78/pHH43菌蜕与E.coliO78传统灭活苗均以8×109cfu/只剂量免疫7日龄雏鸭,30只/组,比较保护效果。
以上两组均于免疫后14 d,E.coliO78腿部肌肉注射攻毒(2×108cfu/只),观察临床反应,并于攻毒后7 d迫杀存活鸭,剖检观察病变。按免疫保护(RPS)=(1-免疫组死亡数/对照组死亡数)×100%公式计算免疫保护率。
2 结果
2.1 E.coliO78/pHH43菌蜕的制备 E.coliO78/pHH43在28℃,200 r/min条件下培养至OD600nm为0.4~0.5时,立刻升温至42℃进行诱导,随诱导时间OD600nm值不断上升,但其活菌数却下降,裂解百分率升高,诱导4 h后基本处于平稳状态(图1)。
经直接冻干及洗涤3次后进行冻干处理,分别取冻干前及冻干后重悬的菌液作稀释,各取100 μL涂平板计数。结果显示,冻干并不能使活菌100%失活(表1)。因此,需要进一步添加庆大霉素使其完全灭活。结果表明庆大霉素的终浓度为124 μg/mL时能够使未裂解的存活菌100%灭活。
2.2 动物试验结果 第一组E.coli O78/pHH43菌蜕免疫组以1×1010cfu/只免疫7日龄雏鸭可获得100%的免疫保护,以8×109cfu/只免疫剂量获得87.5%的免疫保护(表2)。第二组E.coli O78/pHH43菌蜕与E.coli O78传统灭活苗组攻毒后结果表明:E.coli O78/pHH43菌蜕与E.coli O78传统灭活苗对雏鸭均有免疫保护效果,但E.coli O78/pHH43菌蜕免疫保护率为87.5%,稍高于传统的甲醛灭活菌苗的免疫保护率 75%(表 3)。


表1 E.coliO78/pHH43菌蜕冻干结果Table 1 Inactivating effect ofE.coliO78/pHH43 bacterial ghost by lyophilized method

表2 E.coliO78/pHH43菌蜕不同免疫剂量的免疫保护效果Table 2 E.coliO78/pHH43 bacterial ghost of different doses of immune protective effect
3 讨论
编码phiX174噬菌体E裂解基因的重组质粒可在温敏阻遏元件c1857的控制下进行E基因的限制性表达,在温度低于30℃时,阻遏蛋白c1857的表达可使E基因的表达得以很好抑制;而当温度高于30℃时,阻遏蛋白c1857发生热失活,解除对E基因表达的抑制导致发生菌体的裂解作用,并且在42℃达到最大的裂解效应。利用这一原理,本实验以雏鸭为实验动物,以鸭源致病性E.coliO78为试验菌,将带有E裂解基因的重组质粒pHH43转化至此宿主菌,并经热诱导方法制备了E.coli菌蜕。
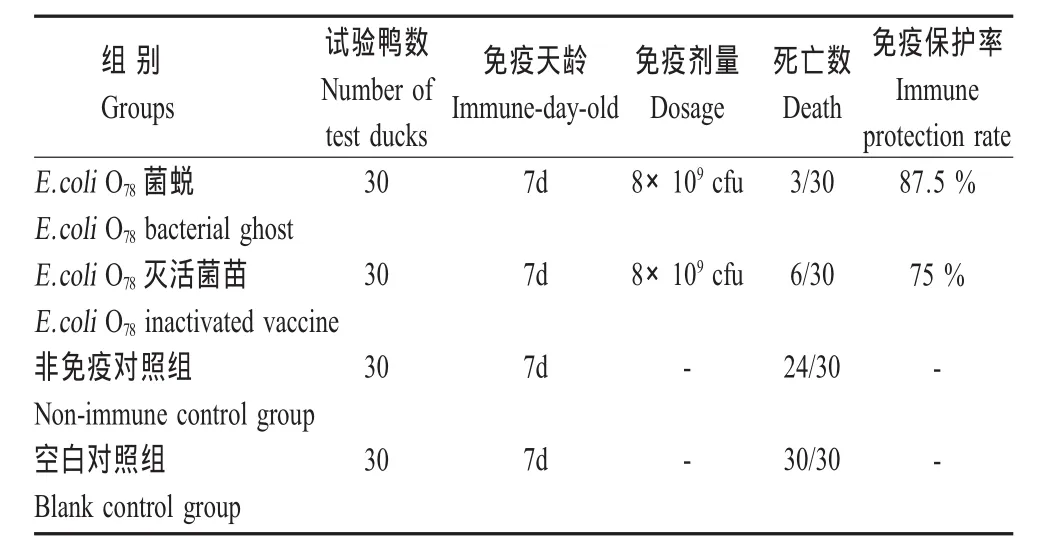
表3 E.coli菌蜕与传统灭活疫苗的免疫保护效果比较Table 3 Comparison of protective effect betweenE.coli bacterial ghost and traditional inactivated of vaccine
含有E基因的裂解质粒pHH43转化于致病性E.coliO78后,42℃诱导,菌液OD600nm值持续呈上升趋势,与常月红报道的胸膜肺炎杆菌菌蜕在升温诱导后,菌液OD600nm值始终无明显的升高或下降,整体曲线非常平缓的试验结果不一致,这是否与宿主菌的固有性状有关,有待进一步探讨[9]。
菌蜕的诱导不能完全裂解宿主菌,未被裂解的存活菌膜上存在E蛋白,在冻干时易破裂,因此冷冻干燥可让其灭活。本实验将致病性E.coliO78/pHH43菌蜕冷冻干燥也未能使其完全灭活,加入庆大霉素124 μg/mL(终浓度)后使其完全灭活。
菌蜕与传统灭活苗相比,没有福尔马林对机体的不良刺激,菌蜕本身具有佐剂效应[10-11];菌蜕缺乏遗传物质,因此作为疫苗进入动物体内后,消除了耐药基因或毒力岛基因的水平转移引起的潜在风险,比传统灭活疫苗(含细菌全部DNA)具有更高的生物安全性。
[1]Lubitz W,Pugsley A P.Changes in host cell phospholipid composition of PhiX 174 gene E product[J].FEMS Microbiol Lett,1985,30:171-175.
[2]Blasi U,Henrich B,Lubitz W,et al.Lysis ofEscherichia coliby cloned gene E depends on its expression[J].J Gen Microbiol,1985,131:1107-1114.
[3]Witte A,Wanner G,Sulznel M,et al.Dynamics of PhiXl74 protein E-mediated lysis ofEscheriehia coli[J].Arch Microbiol,1992,157(4):381-388.
[4]Szostak M P,Hensel A,Eko F O,et al.Bacterial ghosts:non-living candidate vaccines[J].J Biotechnol,1996,44(1-3):161.
[5]Szostak M,Lubitz W.Recombinant bacterial ghosts as multivaccine vehicles[J].Vaccines,1991,91:409-414.
[6]Witte A,Blsi U,Halfmann,et al.PhiX 174 protein E mediated lysis ofEscherichia coli[J].Biochimie,1990,72:191-200.
[7]Jalava K,Henselb A,Szostaka M,et al.Bacterial ghost as vaccine candidates for veterinary applications[J].J Control Release,2002,85:17-25.
[8]Ebensen T,Paukner S,Link C,et al.Bacterial ghost are an efficient delivery system for DNA vaccines[J].J Immunol,2004,172(11):6858-6865.
[9]常月红,刘思国,王春来,等.猪传染性胸膜肺炎放线杆菌“菌影”的制备[J].中国预防兽医学报,2008,30(9):674-677,693.
[10]Kwon S R,Nam Y K,Kim S K,et al.Protection oftilapia(Oreochromis mosambicus)from edwardsiellosis by vaccination withEdwardsiella tardaghost[J].J Fish Shellfish Immunol,2006,(20):621-626.
[11]Eko F O,Mayr U R,Attridgeb S R,et al.Characterization and immunogenicity ofVibrio cholerae ghostsexpressing toxin-coregulated pili[J].J Biotechnol,2000,83:115-123.
