β-catenin/Tcf复合体 、cyclinD1 、c-myc在鼻咽癌中的表达及临床意义
2010-08-04林琼琼李锦添
林琼琼 李锦添
(1.温州医学院附属第二医院,浙江 温州 325027;2.中山大学肿瘤防治中心,广东 广州 510060)
Wnt/β-catenin通路是胚胎组织发育分化所必需的关键信号通路[1],其多种重要成分已经证明在细胞分化中有明确的作用。该通路主要通过枢纽分子β-catenin从胞浆内进入核内与T细胞因子/淋巴增强样因子(Tcf/Lef)结合成β-catenin/Tcf复合体起作用,启动下游靶基因cyclinD1、c-myc、cox-2等的转录,调控细胞发育分化并参与肿瘤的发生发展。本研究对不同分化程度鼻咽癌细胞株中βcatenin/Tcf复合体的表达水平进行检测,并进一步研究该通路下游基因cyclinD1和c-myc的表达,对上述三个分子和鼻咽癌分化的关系进行研究,为将来通过该通路对鼻咽癌进行靶向治疗提供基础。
1 材料与方法
1.1 材料 收集温州医学院附属第二医院2004年1月~2008年12月病理诊断为鼻咽癌的石蜡标本79例,其中角化性鳞状细胞癌8例,分化型非角化性癌31例,以及未分化癌40例。高分化鼻咽癌细胞株CNE-1、低分化鼻咽癌细胞株CNE-2和HONE-1、荧光素酶报告质粒 TOPFLASH和FOPFLASH以及校正转染效率的质粒β-gal-CMV均为本实验室收藏。
1.2 试剂 质粒提取试剂盒产自Invitrogen公司。荧光素酶检测系统和β-半乳糖苷酶检测系统均产自Promega公司。cyclinD1多克隆抗体为Newmarker公司产品,c-myc单克隆抗体(克隆号9E10)购自Santa Cruz公司,免疫组化S-P二步法试剂盒和DAB显色剂均购自北京中山生物技术有限公司。
1.3 方法
1.3.1 细胞传代 以2.5×104细胞数在24孔板中生长至75%~95%面积时用脂质体2000进行转染。每种细胞分别转染TOPFLASH/β-gal和FOPFLASH/β-gal[2]各 0.8 μ g,且每种细胞转染 3 个平行孔,并做阴性对照。按照Promega公司的说明书在48小时后加入裂解缓冲液并收集细胞裂解液。在 BIOSCAN公司的单光子仪(LUMI—SCINT TM)上检测30秒内荧光素酶催化荧光素氧化反应所产生的光强度(Relative Luciferase Unit,RLU);并在分光光度计上测定β-半乳糖苷酶(β-gal)在420nm处吸光值对转染效率进行标准化。每种细胞的荧光素酶表达值(即转录活性)为3次RLU值和βgal值之比的平均值。
1.3.2 cyclinD1的检测 实验中设阴性对照和阳性对照。所用方法为S-P二步法,将切片脱蜡,水化,浸入3%过氧化氢(H2O2)溶液中,室温下15分钟以封闭内源性过氧化酶,置于pH6.0的0.01mol/L柠檬酸盐缓冲液中,以高火5分钟,中低火20分钟的条件在微波炉中加热以修复抗原,室温冷却30分钟;磷酸盐缓冲溶液(PBS)洗涤后,滴加cyclinD1多克隆抗体,工作浓度为 1∶35,孵育过夜;PBS洗涤,滴加二抗后孵育并洗涤,滴加链霉素抗生物素-过氧化物酶溶液,于37℃孵育15分钟;PBS洗涤,3.3-四盐酸二氨基联苯胺(DAB)显色,蒸馏水冲洗,苏木素复染;中性树胶封片,显微镜下观察。
1.3.3 c-myc的检测 同样设阴性对照和阳性对照,利用S-P二步法,将切片脱蜡,水化,浸入 3%H2O2溶液中,室温下1小时以封闭内源性过氧化酶;然后置于pH8.0的1 mol/L的EDTA缓冲液中,微波炉加热修复抗原,高火5分钟,中低火20分钟,并于室温下冷却30分钟;PBS洗涤后用0.01%的Triton-X100处理后放置在室温下10分钟,PBS洗涤3次,每次2分钟后,滴加第一抗体,滴度为1∶30,于4℃孵育过夜;PBS缓冲液中洗涤,分别滴加二抗和链霉素抗生物素-过氧化物酶溶液,分别于37℃孵育15分钟;PBS洗涤,DAB显色,蒸馏水冲洗,苏木素复染;中性封片,显微镜下观察。
1.3.4 结果判定 cyclinD1和c-myc蛋白均定位于细胞核内,观察各切片鼻咽癌的表达形式,并参照Carcangiu's[3]的双记分法对各蛋白的表达水平进行半定量评分。
1.4 统计学处理 用SPSS12.0软件包进行统计学处理,采用卡方检验和精确概率法对数据进行分析。
2 结 果
2.1 TOPFLASH-luc和FOPFLASH-luc的表达高分化鼻咽癌细胞株CNE-1中,TOPFLASH-Luc值跟FOPFLASH-Luc值之比仅为1.39。低分化鼻咽癌细胞株CNE-2和HONE-1中,TOPFLASHLuc值与FOPFLASH-Luc值之比分别为16.35和17.13。CNE-2和HONE-1中TOPFLASH-Luc的表达值分别是CNE-1的 80.12倍和 123.6倍,FOPFLASH-Luc的表达值分别是CNE-1的6.79倍和10倍,见表1。
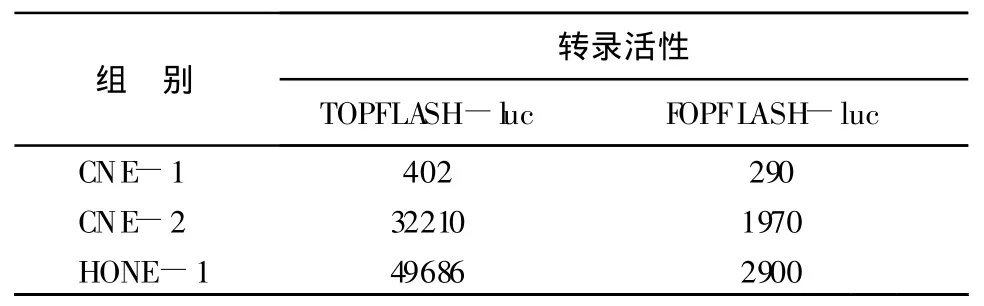
表1 不同分化程度鼻咽癌细胞株TOPFLASH—Luc和FOPFLASH-Luc的表达
2.2 cyclinD1的表达 角化性鳞癌中,cyclinD1的表达绝大部分呈弱阳性;在分化性非角化癌中,cyclinD1除表现为弱阳性外,中等强度阳性和强阳性表达的标本增多;而在未分化型非角化癌中,绝大部分标本为中等强度和强阳性表达。在8例角化性鳞癌标本中,仅1例标本为中度阳性,其余均为弱阳性的表达。分化型非角化癌中,38.71%的标本呈中等强度阳性和强阳性表达;在未分化型非角化癌中,出现2例弱阳性、8例中度阳性表达以及30例强阳性,即95%的样本出现中等/强阳性的表达(见图1)。

图1 HE×400,cyclinD1(+)
采用卡方检验的方法对上述数据进行处理,得到如下结果。角化性鳞癌和未分化型非角化癌中,cyclinD1表达有统计学差异,χ2=24.615,P<0.001;分化型非角化癌与未分化型非角化癌比较,cyclinD1表达亦有统计学意义,χ2=23.93,P<0.001。而角化性鳞癌和分化型非角化癌比较,χ2=0.963,P=0.326,无统计学意义(表2)。

表2 cyclinD1在不同组织学类型鼻咽癌中的表达水平
2.3 c-myc的表达 角化性鳞癌共8例标本,而在这8个标本中,有4例没有表达c-myc蛋白,有2例为弱阳性表达,另外有1例中等强度阳性和1例强阳性表达。即50%的角化性鳞癌病例出现强弱不等的c-myc的阳性表达。在31例分化型非角化癌中,总共有16例出现c-myc蛋白的阳性表达。其中,有3例为中等强度阳性,其余13例均为弱阳性。即有51.6%(16/31)的分化型非角化癌标本出现c-myc蛋白的阳性表达。40例未分化型非角化癌中有33例标本出现核阳性,即在82.5%(33/40)的未分化型非角化癌中可以检测到c-myc蛋白的表达,其中12例为弱阳性,10例为中等强度阳性,以及11例强阳性表达(见图2)。根据卡方检验,发现未分化型非角化癌和分化型非角化癌比较,c-myc的表达有统计学差异,χ2=7.79,P<0.01;而未分化型非角化癌与角化性鳞癌比较,χ2=2.359,P>0.05。(表3)

表3 c-myc在不同组织学类型鼻咽癌中的表达水平

图2 HE×400,c-myc(+)
3 讨 论
Wnt/β-catenin通路不仅在胚胎发育过程中参与背腹轴的形成,而且与细胞极性建立、细胞命运决定以及细胞分化等多个发育事件有关。已有国外学者发现此通路在乳腺上皮的分化过程中起重要作用[4]。同时已经证实在多种肿瘤中有Wnt/βcatenin通路的异常激活。如肝癌[5]、结肠癌[6-7]、胰腺癌[8]、食管癌[9]等。
Wnt/β-catenin通路激活后,胞浆内未被磷酸化降解的β-catenin即去磷酸化的β-catenin进入核内,与Tcf/Lef结合成复合体,启动下游靶基因的转录。为明确胞浆内累积的β-catenin是否进入核内与Tcf结合而发挥作用,本研究采用TOPFLASH和FOPFLASH对3种不同分化鼻咽癌细胞株中βcatenin/Tcf复合体的含量进行了检测。结果显示低分化鼻咽癌细胞株 CNE-2和HONE-1中,TOPFLASH-Iuc明显比FOPFLASH-luc含量高,而在高分化鼻咽癌细胞株CNE-1中此两者的含量却没有太大差异,说明鼻咽癌处于低分化时细胞核内复合体含量有增多,且发现β-catenin/Tcf复合体在低分化鼻咽癌细胞株中的含量是高分化细胞株的80.0~123.6倍;上述结果提示了在低分化鼻咽癌细胞中,Wnt/β-catenin通路可能被异常活化,导致β-catenin/Tcf复合体含量增高,再通过一系列机制抑制鼻咽癌细胞的分化。
cyclinD1是Wnt/β-catenin通路下游的主要靶基因,在头颈部鳞状细胞癌、乳腺癌、胃癌等肿瘤中都发现cyclinD1存在过度表达,并与大肠癌组织的分化有关[10]。cyclinD1在鼻咽癌细胞中有过表达并呈细胞周期依赖性,其高表达可能为鼻咽癌发生过程中的重要事件[11]。作者发现,在角化性鳞癌中,8例标本中只有1例表现为中等阳性;在分化型非角化癌中,出现中等阳性和强阳性的样本占38.71%;而在未分化型非角化癌中,却有95%的标本有中等阳性和强阳性的表达。根据这些数据,不难看出,随着鼻咽癌的分化程度的减低,cyclinD1在核内的表达增强,这意味着,在鼻咽癌的分化过程中,Wnt/β-catenin信号通路可能被某种原因激活,导致下游基因cyclinD1的表达增多,使细胞G1期缩短,细胞不停地进入DNA合成期,最终导致细胞不断增殖,抑制分化。
c-myc基因是被Wnt信号开启的高度保守的癌基因,有研究认为,c-myc的过表达与鼻咽癌的癌变过程有关[12]。检测c-myc在鼻咽癌中的表达,在分化型非角化癌中,有51.6%(16/31)的标本出现c-myc的核阳性;而在未分化型非角化癌中,细胞核内出现c-myc表达的标本占82.5%(33/40)。表明在随着鼻咽癌的分化程度的降低,c-myc在核内的表达也越来越高。也就是说,作为Wnt/βcatenin通路下游的靶基因,c-myc在低分化的鼻咽癌中表达高,很可能是因为高表达的c-myc使细胞快速进入S期,从而抑制分化,促进细胞增殖。
CyclinD1在角化性鳞癌和分化型非角化癌中的表达没有统计学差异;而在角化性鳞癌中,有50%的病例出现了c-myc的阳性表达,与其在分化型非角化癌和未分化型非角化癌中表达的差异相比,虽然阳性率相对较低,但没有统计学意义。这可能是因为角化性鳞癌的样本量较少(8例),与其他两种组织学类型的差别太大而出现的误差,因此有必要在将来的研究中增大角化性鳞癌的样本量进行进一步的验证。
本研究的结果表明,随着β-catenin/Tcf复合体表达水平的增高,cyclinD1和c-myc的表达都呈上调趋势。本研究通过以上的结果,提示Wnt/βcatenin通路在鼻咽癌分化过程中可能由于内外环境改变被异常激活,使β-catenin在胞浆内累积,并进入核内与Tcf结合,导致细胞核内β-catenin/Tcf复合体含量增高,促进下游靶基因的转录,抑制了鼻咽癌的分化。该发现可能为研究鼻咽癌失分化机制提供了新线索,也可能为鼻咽癌的诱导分化治疗提供了新途径。
[1]Macheda M L,StackerS A.Importance of Wnt signaling in the tumor stroma microenvironment.Curr Cancer Drug Targets,2008,8(6)∶454
[2]Yuen Lam Pon,Wong Alic S T.Apoptosis in HumanOvarian Surface Epithelial Cells Is Associated with Cyclooxygenase-2Up-Regulation via the β-Catenin/T-cell FactorSignaling Pathway.Molecular Endocrinology,2006,20(12)∶3336
[3]姜元芹,叶社房,吴艺晖,等.uPRAP/Endol80在鼻咽癌中的表达及其意义.中国肿瘤临床,2008,35(8)∶448
[4]Lindvall C,BuW,Bart O Williams,et al.Wnt Signaling,Stem Cell and the Cellular Origin of Breast Cancer.Stem Cell Rev,2007,3(2)∶157
[5]Zhao D H,Hong J J,Guo S Y,et al.Aberrant expression and function of TCF4 in the proliferation of hepatocellular carcinoma cell line BEL-7402.Cell Res,2004,14(1)∶74
[6]Mees S T,Mennigen R,Spieker T,et al.Expression of tight and adherens junction proteins in ulcerative colitis associated colorectal carcinoma∶upragulation of claudin-1,claudin-3,claudin-4 and beta-catenin.In J Colorectal Dis,2009,24(36)∶1
[7]Chen J Z,Huang X F.β-Catenin Pathway in Ulcerative Colitis-Associated Colorectal Cancer andTherapeutic Implication.J Gastrointestinal Cancer,2009,40(1-2)∶64
[8]Chen P,Tian Dean,Liu M,et al.The role of Tbx2 in pancreatic cancers and its regulation by Wnt/β-catenin signaling,Chinese-German J Clinical Oncology,2008,7(7)∶404
[9]Clement G,Jablons D M,Benhattar J.Targeting the Wnt signaling pathway to treat Barrett's esophagus.Expert Opin Ther Targets,2007,11(3)∶375
[10]戴文斌,任占平,陈蔚麟,等.大肠癌中β-catenin、E-cadherin、c-myc和cyclinD1的表达及其临床意义.广西医科大学学报,2008,25(1)∶43
[11]Angela Bik-Yu Hui.Yvonne Yan-Yan Or.Hirokuni Takano,et al.Array-Based Comparative Genomic Hybridization Analysis Identified CyclinD1 as a Target Oncogene at 11q13.3 in Nasopharyngeal Carcinoma.Cancer Res,2005,65(18)∶8125
[12]徐丽娜,范松青.Wnt/β-Catenin信号转导通路异常及其在鼻咽癌发生中的作用.中国耳鼻咽喉颅底外科杂志,2008,14(4)∶316
