免疫活化血小板对人脐静脉内皮细胞 COX-2及PPAR-α表达与活性的影响及LDL的作用*
2010-08-02吴延庆程晓曙柴俊兵
吴延庆,程晓曙,柴俊兵
(南昌大学第二附属医院心内科,江西 南昌 330006)
心血管疾病已成为人类的头号杀手,也是人类致残的主要原因之一。低密度脂蛋白(low-density lipoprotein cholesterol,LDL)被认为是(atherosclerosis,AS)发生发展的基础因素,LDL在引发起始的炎症反应直至血栓形成的过程中都起到了至关重要的作用,LDL的水平越高,冠心病的危险性就越大。降低LDL能够阻止或延缓AS进展。
血小板在机体内起着重要的促凝血作用。以往认为血小板本身并不主动参与免疫炎症反应。近年来发现血小板表面含有不同结构和功能的糖蛋白受体和相应的配体,在血小板不同的状态,膜上可表达不同的受体蛋白,血小板一旦被活化,表面就会出现许多新的标志物和促进许多标志物表达增加,其中一些标志物如整合素 αIIbβ3(PAC-1)、CD40L、P-选择素等与血小板参与免疫炎症反应密切相关。我们称之为血小板免疫活化。有学者在研究白细胞与血小板相互作用时发现,血小板微粒可与中性粒细胞结合,并可在2个中性粒细胞之间充当连接体,使中性粒细胞连接成串珠状。连接黏附分子(junctional adhesion molecules,JAMs)作为免疫球蛋白超家族中的一员,参与了许多免疫炎症反应过程,也被发现在血小板膜表面表达。血小板通过JAMs与白细胞和内皮细胞结合后,可使它们激活并募集中性粒细胞、单核细胞等炎症细胞聚集,促进炎症反应。
血管内皮细胞的损伤或功能障碍很可能就是AS发生的始动环节或发展的推动因素。近年来随着研究的深入,发现许多内皮细胞的基因表达与AS的发生与发展有关。如过氧化物酶体增殖物活化受体 α (peroxisome proliferator activated receptor α,PPAR-α)在AS损伤区有表达。环氧合酶(cyclooxygenase,COX-2)也参与了AS的发展,在AS的损伤区存在COX-2的表达,多数研究认为COX-2在调节AS稳定性方面发挥了重要作用,COX-2在AS早期是致炎和促进AS发生和发展的。
基于LDL-C在AS发生、发展中的作用及存在的争议,近来随着有关血小板在免疫学和炎症方面功能的新发现以及血管内皮细胞上诸多与AS相关基因的发现与研究的深入,尽管近来血小板免疫活化改变在心血管疾病发生发展中有少量研究报道,但缺乏LDL与免疫活化血小板对血管内皮细胞AS相关基因表达的影响及他汀类药物对血小板免疫活化功能的直接影响的相关报道。因此本研究旨在观察血小板免疫活化对血管内皮细胞内与AS有关基因PPAR-α、COX-2表达的影响及LDL对这一过程的作用。
材料和方法
1 细胞
新鲜机采去白细胞血小板由省血液中心提供,人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自中南大学湘雅中心实验室。
2 主要试剂
Ⅰ抗羊抗人COX-2抗体、羊抗人PPAR-α抗体购自Santa Cruz,各种Ⅱ抗购自中杉金桥生物(进口分装),Trizol购自Invitrogen,LDL购自Chemicon,0.2 mmol/L ADP购自 Biopool,RT-PCR试剂盒及Random primers购自Promega,蛋白抽提试剂盒购自北京普利莱基因技术有限公司,PPAR-α活性测定试剂盒购自Caymen,PGE2ELISA试剂盒购自Amersham,COX-2、PPAR-α及GAPDH引物购自上海生工公司。
3 血小板保存培养及与HUVECs共孵育
从血液中心购取机采血小板,用白细胞过滤器进行进一步白细胞过滤,并进行血小板计数及白细胞、红细胞含量测定(方法同前),用血小板专用保存袋在血小板振荡保存机中22℃水平振荡条件下保存。实验前用22℃ PBS液洗涤,22℃、4000×g离心10 min,反复2次后,调整细胞浓度至2×1010cells/L,用 RPMI-1640培养基于37℃、5%CO2细胞培养箱中短时间与HUVECs共孵育。
4 血小板活化方法
血小板在腺苷二磷酸(adenosine diphosphate,ADP)的作用下激活,血小板激活复合物1(platelet activating compound 1,PAC -1)和 CD40配体(CD40 ligand,CD40L)的表达增加,因血小板CD40L广泛参与了免疫炎症反应,称之为免疫活化,为达到较多血小板活化数量,本研究采用了终浓度为5 μmol/L ADP活化血小板。
5 检测指标及方法
5.1 血小板与HUVECs共孵育后血小板回收及计数 血小板与HUVECs共孵育后,在超净台中首先用吸管小心吸尽悬浮细胞和血小板,然后再用22℃的PBS液轻轻冲洗细胞培养孔,并进一步回收其中的血小板,反复3次,最后进行贴壁 HUVECs的回收、RNA及蛋白的提取。并进行回收血小板的计数,计算血小板的回收率。
5.2 引物序列 根据 NCBI中的GenBank查得人COX -2、PPAR - α、CD40、GAPDH 基因序列,再用Primer 5.0软件设计、筛选,其具体序列见表1。

表1 各基因PCR引物序列及Tm值Table1.PCR primer sequence and it's Tm value
5.3 HUVECs COX-2及PPAR-α基因表达测定采用RT-PCR法,主要步骤包括总RNA提取,总RNA的质量、浓度检测与标化,RNA逆转录,聚合酶链式反应(PCR),琼脂糖凝胶电泳,扩增产物相对定量及统计学分析。
5.4 Western blotting法测定人脐静脉内皮细胞COX-2、PPAR-α蛋白表达 包括蛋白提取、蛋白浓度测定及标化、制备SDS-PAGE变性凝胶、蛋白电泳-转膜、免疫印迹显影、产物定量及统计学分析。
5.5 ELISA法检测培养液中PGE2的浓度 参照试剂盒说明书进行。
5.6 内皮细胞PPAR-α活性测定 包括人脐静脉内皮细胞核蛋白抽提纯化及活性测定,具体方法参照PPAR-α活性测定试剂盒说明书。
6 统计学处理
结 果
1 共孵育后血小板回收计数结果及活化血小板COX-2、PPAR-α mRNA及蛋白表达的检测结果
各组血小板与HUVECs共孵育后血小板回收率为(93.4±1.6)%,可计算推出血小板与HUVECs稳定结合的量小于加入血小板量的10%,与内皮细胞结合的血小板绝对量小于1×106。血小板为无核细胞,血小板内mRNA及蛋白的表达量为有核细胞的1/12500左右。
在用终浓度为5 μmol/L ADP活化的2×106个血小板中未检测到COX-2及PPAR-α mRNA及蛋白的表达。
2 免疫活化血小板对HUVECs COX-2 mRNA表达的影响及LDL的作用
正常HUVECs有极少量COX-2 mRNA表达,血小板对照组和ADP对照组HUVECs COX-2 mRNA的表达与对照组相比无明显变化(0.68±0.21 vs 0.53±0.17,0.77±0.25 vs 0.53±0.17,均 P >0.05),LDL对照组HUVECs COX-2 mRNA的表达似乎有增加,但无显著差异(0.83±0.26 vs 0.53±0.17,P>0.05);血小板活化组 HUVECs COX-2 mRNA的表达较ADP对照组及血小板对照组明显升高(1.49±0.27 vs 0.53±0.17,1.49±0.27 vs 0.68±0.21,均P<0.01),血小板活化+LDL组HUVECs COX-2 mRNA的表达较血小板活化组明显升高(1.79±0.20 vs 1.49±0.27,P <0.05),见图1A、B。
3 免疫活化血小板对HUVECs PPAR-α mRNA表达的影响及LDL的作用
正常HUVECs细胞有极少量PPAR-α mRNA的表达,血小板对照组、ADP对照组和LDL对照组HUVECs PPAR-α mRNA的表达与对照组相比均无明显变化(1.17±0.16 vs 1.13±0.17,1.19±0.19 vs 1.13±0.17和1.12±0.14 vs 1.13±0.17,均P>0.05);血小板活化组HUVECs PPAR-α mRNA的表达较ADP对照组及血小板对照组明显升高(1.45±0.21 vs 1.19±0.19,1.45±0.21 vs 1.17±0.16,均P<0.01);血小板活化 +LDL组HUVECs PPAR-α mRNA的表达较血小板活化组明显升高(1.74±0.23 vs 1.45 ±0.21),P <0.05,见图1A、C。
4 免疫活化血小板对HUVECs COX-2蛋白表达的影响及LDL的作用
正常培养的HUVECs有极少量COX-2蛋白的表达,血小板对照组、ADP对照组和LDL对照组HUVECs COX-2蛋白的表达与对照组相比均无明显差异(0.700±0.073 vs 0.570±0.067,0.710±0.072 vs 0.570±0.067和0.580±0.070 vs 0.570±0.067,均P>0.05);血小板活化组HUVECs COX-2蛋白表达较血小板对照组及ADP对照组明显升高(1.600±0.145 vs 0.700±0.073,1.600±0.145 vs 0.710±0.072,均P<0.01);血小板活化+LDL组HUVECs COX-2蛋白的表达较血小板活化组升高(1.970±0.153 vs 1.600 ±0.145,P <0.05),见图2A、B。
5 免疫活化血小板对HUVECs PPAR-α蛋白表达的影响及LDL的作用
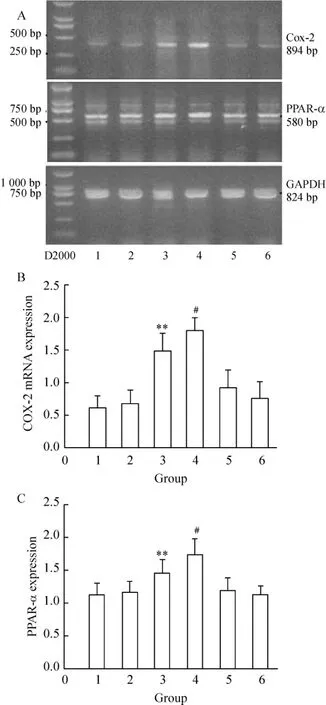
Figure1.Effects of immune-activated platelet and LDL on COX-2 and PPAR-α mRNA expression in HUVECs..n=6.**P<0.01 vs control group;#P<0.05 vs ADP+coincubation group.A:COX -2,PPAR-α and GAPDH mRNA of HUVECs by RTPCR;B:statistical data of HUVECs COX-2 mRNA expressed in different groups;C:statistical data of HUVECs PPAR-α mRNA expressed in different groups.D2000:D2000 marker;1:control;2:coincubation of platelets with HUVECs;3:coincubation+ADP;4:coincubation+LDL+ADP;5:LDL+coincubation;6:ADP+HUVECs.图1 免疫活化血小板对人脐静脉内皮细胞COX-2和PPAR-α mRNA表达的影响及LDL的作用
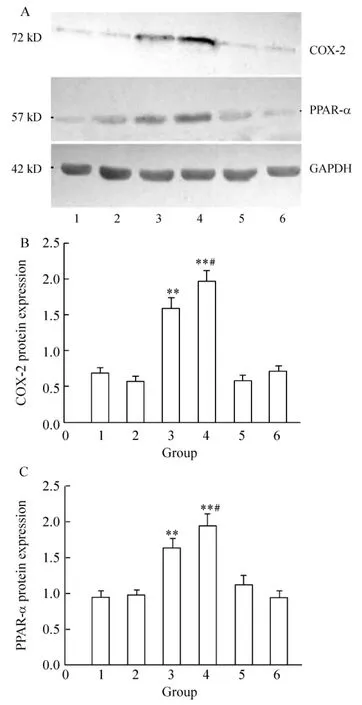
Figure2.Effects of immune-activate platelet and LDL on COX-2 and PPAR- α protein expression in HUVECs..n=6.**P <0.01 vs control group;#P <0.05 vs ADP+coincubation group.A:COX-2,PPAR-α and GAPDH protein of HUVECs by Western blotting;B:statistical data of HUVECs COX-2 protein expressed in different groups;C:statistical data of HUVECs PPAR - α protein expressed in different groups.1:control;2:coincubation of platelets with HUVECs;3:coincubation+ADP;4:coincubation+LDL+ADP;5:LDL+coincubation;6:ADP+HUVECs.图2 免疫活化血小板对人脐静脉内皮细胞COX-2和PPAR-α蛋白表达的影响及LDL的作用
正常HUVECs亦有少量PPAR-α蛋白的表达,血小板对照组、ADP对照组HUVECs PPAR-α蛋白的表达与对照组比较无显著变化(0.960±0.073 vs 0.980±0.082,0.950±0.094 vs 0.980±0.082,均 P>0.05);LDL对照组HUVECs PPAR-α蛋白表达与对照组相比似乎有所增加,但无显著差异(1.120±0.012 vs 0.980±0.082,P >0.05);血小板活化组HUVECs PPAR-α蛋白表达较血小板对照组及ADP对照组明显升高(1.630±0.143 vs 0.960±0.073,1.630±0.143 vs 0.950±0.094,均 P <0.01);血小板活化+LDL组HUVECs PPAR-α蛋白的表达也较血小板活化组升高(1.950±0.157 vs 1.630±0.143,P <0.05),见图2A、C。
6 免疫活化血小板促进HUVECs COX-2活性的增加,活化血小板对HUVECs PPAR-α结合活性无明显影响,LDL本身无明显作用,但能够促进免疫活化血小板的作用,见表2。
表2 各组HUVECs COX-2活性(PGE2浓度)及PPAR-α结合活性对比Table2.Cox-2 activity and PPAR-α binding activity in HUVECs from different groups(.n=6)

表2 各组HUVECs COX-2活性(PGE2浓度)及PPAR-α结合活性对比Table2.Cox-2 activity and PPAR-α binding activity in HUVECs from different groups(.n=6)
**P<0.01 vs control;##P <0.01 vs ADP+platelet+HUVECs.
Group PGE2 concentration(ng/L)PPAR-α binding activity Control 21.31 ±2.34 0.56 ±0.14 Platelet+HUVECs 23.73 ±2.53 0.61 ±0.14 ADP+platelet+HUVECs 42.46 ±5.57** 0.73 ±0.18 ADP+LDL+platelet+HUVECs 64.35 ±6.19## 0.76 ±0.17 LDL+platelet+HUVECs 25.74 ±3.12 0.64 ±0.16 ADP+HUVECs 22.26 ±2.27 0.58 ±0.13
讨 论
COX-2又称诱导型环氧合酶,COX-2介导PGs的合成。研究发现COX-2的高表达仅局限于AS病变处[1]。刺激内皮细胞、单核/巨噬细胞和平滑肌细胞后均可诱导 COX-2的表达[2],McGeer等[3]发现COX-2在AS斑块中的表达水平比正常动脉高4.8倍。Meir等[4]用apoE缺陷型小鼠也得出了类似的结果。近期一系列研究[3-10]认为COX-2对AS尤其是早期AS的形成起促进作用:如COX-2介导的PG产物可以通过多种机制促进AS的进程;COX-2抑制剂有抑制AS的作用。选择性COX-2抑制剂可以抑制血管炎症,因而可以延缓AS进程、增加斑块稳定性从而减少粥样硬化血栓事件。
PPARα属核受体家族一员,是一种在脂代谢、炎症及AS中发挥重要作用的核受体之一,调节多种靶基因的表达、抑制炎症、调节肝脏的急性期反应及血管的炎症反应[11]。如PPARα缺失小鼠肝脏及血管内皮细胞黏附分子1(VCAM-1)及血清淀粉样蛋白A的表达水平明显升高[12,13]。近期研究表明PPAR-α能够抑制内皮细胞的反应,PPAR-α激动剂能够抑制炎症细胞因子如TNF-α诱导的VCAM-1的转录表达[14]。PPAR-α的激活能够抑制T细胞产生IFN-γ和IL-2,从而可能对这些因子的后续效果产生抑制作用[15,16]。在平滑肌细胞 PPAR-α通过干预NF-κB和AP-1途径抑制IL-1β诱导的COX-2的表达。
本研究利用血小板与HUVECs共孵育来模拟机体内血小板与血管内皮细胞的相互关系,利用体外免疫活化的血小板直接刺激内皮细胞,发现免疫活化血小板能够激活HUVECs,促进HUVECs COX-2 mRNA及蛋白表达的增加,而且COX-2活性也随之明显升高,表明COX-2基因表达及活性的增加可能是血小板免疫活化促进AS的一个重要途径。本实验中用50 mg/L的LDL直接干预HUVECs未发现HUVECs COX-2表达及活性有明显的变化,但同等浓度LDL预干预能够明显促进免疫活化血小板刺激HUVECs COX-2的表达及活性的增加。因此LDL有可能通过对血小板或HUVECs的增敏作用间接促进HUVECs COX-2的表达及活性的增加,推测增敏作用可能是LDL促进AS的一个重要方面。
本研究同时发现免疫活化血小板亦能够促进PPAR-α mRNA和蛋白的表达,但PPAR-α的活性并没有明显增加,也就是说增加PPAR-α的表达并不能达到其相应调节其它基因表达、抑制炎症反应的作用。本研究推测免疫活化血小板促进HUVECs PPAR-α的表达可能与其促进了HUVECs其它相关基因表达后的一种被动性、反应性的表达有关,亦或是HUVECs本身对外界炎症刺激的一种防御反应,反应性地增加PPAR-α的表达。当然亦还可能是免疫活化血小板有双向作用,既能通过信号途径促进HUVECs COX-2的表达,亦能通过相同或其它信号途径促进HUVECs PPAR-α的表达,无论何种方式或途径,最终结果是增加的PPAR-α表达并不具有相应的活性。本研究结果提示免疫活化血小板可能通过促进内皮细胞COX-2的表达及活性的增加参与了AS的形成和发展,同时也为临床用PPAR-α激动剂治疗AS提供了一定的理论依据。
[1]Cipollone F,Rocca B,Patrono C.Cyclooxygenase -2 expression and inhibition in atherothrombosis[J].Arterioscler Thromb Vasc Biol,2004,24(2):246 -255.
[2]Mosheimer BA,Kaneider NC,Feistritzer C,et al.CD40-ligand-dependent induction of COX-2 gene expres-sion in endothelial cells by activated platelets:inhibitory effects of atorvastatin[J].Blood Coagul Fibrinolysis,2005,16(2):105-110.
[3]McGeer PL,McGeer EG,Yasojima K.Expression of COX-1 and COX -2 in atherosclerotic plaques[J].Exp Gerontol,2002,37(7):925- 929.
[4]Meir KS,Leitersdorf E.Atherosclerosis in the apolipoprotein E - deficient mouse:a decade of progress[J].Arterioscler Thromb Vasc Biol,2004,24(6):1006 -1014.
[5]Rott D,Zhu J,Bumett MS,et al.Effects of MF-tricyclic,a selective cyclooxygenase - 2 inhibitor,on atherosclerotic progression and susceptibility to cytomegalovirus replication in apolipoprotein - E knock out mice[J].J Am Coll Cardiol,2003,41(10):1812 -1819.
[6]Paramo JA,Rodriguez JA,Beloqui O,et al.Monocyte cyclooxygenase-2 activity:a new therapeutic target for atherosclerosis[J].Curr Drug Targets Cardiovasc Haemato Disord,2005,5(4):303-311.
[7]Cipollone F.COX-2 and prostaglandins in atherosclerosis[J].Lupus,2005,14(9):756 -759.
[8]Orbe J,Beloqui O,Rodriguez JA,et al.Protective effect of the G765C COX-2 polymorphism on subclinical atherosclerosis and inflammatory markers in asymptomatic subjects with cardiovascular risk factors[J].Clin Chim Acta,2006,368(1-2):138-143.
[9]Beloqui O,Paramo JA,Orbe J,et al.Monocyte cyclooxygenase-2 overactivity:a new marker of subclinical atherosclerosis in asymptomatic subjects with cardiovascular risk factors[J].Eur Heart J,2005,26(2):153 -158.
[10]Grosser T,Fries S,FitzGerald GA.J Biological basis forthe cardiovascular consequences of COX-2 inhibition:therapeutic challenges and opportunities[J].Clin Invest,2006,116(1):4-15.
[11]王明牛,蒋青松,吴 芹,等.PPAR-α参与高糖高胰岛素诱导的心肌细胞肥大[J].中国病理生理杂志,2009,25(12):2314 -2318.
[12]Ziouzenkova O,Perrey S,Asatryan L,et al.Lipolysis of triglyceride-rich lipoproteins generates PPAR ligands:evidence for an antiinflammatory role for lipoprotein lipase[J].Proc Natl Acad Sci USA,2003,100(5):2730 -2735.
[13]Han CY,Chiba T,Campbell JS,et al.Reciprocal and coordinate regulation of serum amyloid A versus apolipoprotein A-I and paraoxonase-1 by inflammation in murine hepatocytes[J].Arterioscler Thromb Vasc Biol,2006,26(8):1806-1813.
[14]Xu X,Otsuki M,Saito H,et al.PPAR alpha and GR differentially down-regulate the expression of nuclear factor-kappa B-responsive genes in vascular endothelial cells[J].Endocrinology,2001,142(8):3332 -3339.
[15]Jones DC,Ding X,Daynes RA.Nuclear receptor peroxisome proliferator-activated receptor alpha(PPAR alpha)is expressed in resting murine lymphocytes.The PPAR alpha in T and B lymphocytes is both transactivation and transrepression competent[J].J Biol Chem,2002,277(9):6838-6845.
[16]Marx N,Kehrle B,Kohlhammer K,et al.PPAR activators as antiinflammatory mediators in human T lymphocytes:implications for atherosclerosis and transplantation- associated arteriosclerosis[J].Circ Res,2002,90(6):703-710.
