IL-1β和IL-6对椎间盘髓核细胞NGF表达的影响*
2010-08-02韩敦富施彦璋陈志维李逸群刘尚礼
王 刚,韩敦富,施彦璋,陈志维,李逸群,刘尚礼△
(1佛山市中医院骨科,广东 佛山 528000;2中山大学附属第二医院骨科,广东 广州 510120;3汕头市中心医院骨科,广东 汕头 515031)
源于椎间盘的腰痛仍是目前社会中严重影响人们生活和致残的常见原因之一[1],研究表明,伤害感受器神经纤维的长入可能是导致椎间盘源性腰痛发生的基础[2,3],神经生长因子 (nerve growth factor,NGF)在促进神经纤维长入椎间盘过程中可能起到了关键作用[4]。研究还发现肿瘤坏死因子(tumor necrosis factor,TNF)-α,白细胞介素(interleukin,IL)-1β等在退变椎间盘中高表达[5],并且可以大大提高椎间盘细胞分泌 NGF[6,7];进一步研究表明,IL-6、IL-8在疼痛的椎间盘高表达,而TNF-α、IL-1β则表达较低[8]。因此,我们推测 IL-6、IL-8等在促进椎间盘细胞产生NGF,诱导神经长入过程中可能发挥了更重要的作用。因此,本文目的旨在观察IL-1β和IL-6对体外培养的人椎间盘髓核细胞NGF表达的影响。
材料和方法
1 材料
1.1 主要试剂 DMEM-F12培养基(Gibco),胎牛血清(Hyclone),IL-1β 及 IL-6(Peprotechec),Trizol(Invitrogen),逆转录多聚酶链反应 (reverse transcription polymerase chain reaction,RT-PCR)试剂盒(TaKaRa),PCR引物(上海生工生物工程技术服务有限公司),蛋白裂解液 (申能博彩,进口分装),β -actin、NGF-β 单克隆抗体(Newmarker),Ⅱ型胶原单克隆抗体(Chemicon),羊抗兔Ⅱ抗(晶美生物有限公司),增强化学发光液(enhanced chemiluminescence,ECL)(晶美生物有限公司)。
1.2 人髓核细胞来源 将取自特发性脊柱侧弯患者的髓核组织标本进行分离培养,男女各2例,年龄在10-15岁之间,L2/L3节段2例,L3/L4节段2例,所取节段椎间盘术前MRI显示Pfirrmann退变分级[8]为 1 级。
2 方法
2.1 髓核细胞的分离和培养 前路手术取出椎间盘组织后立刻装入50 mL无菌离心管,置于冰盒后即刻送往实验室。椎间盘组织用冰磷酸盐缓冲液(phosphate buffered saline,PBS)溶液漂洗3次,分离出中央胶冻样髓核组织,在DMEM/F12培养基中将其剪成约1 mm×1 mm×1 mm的组织颗粒,1000 r/min离心5 min,去上清液,用含10%胎牛血清的DMEM/F12培养基(含青、链霉素各1×105U/L)重悬后转移到15 mL离心管中,在37℃、5%CO2培养箱中培养8 h,然后离心去上清,PBS漂洗后,依次用0.25%胰蛋白酶、2%Ⅱ型胶原酶消化后,收集上清液,1000r/min离心 5 min,去除上清液,再加入10 mL含10%胎牛血清的DMEM/F12培养基吹打均匀后计数,以3×105cells/cm2浓度转移到6孔培养板或25 cm2培养瓶在37℃、5%CO2培养箱中培养备用。细胞贴壁后,每2-3 d换液1次,按时用倒置显微镜观察、拍照。
2.2 髓核细胞鉴定 制备好细胞爬片,用新鲜配制的4%多聚甲醛固定20 min。甲苯胺蓝染色观察细胞糖胺多糖的分泌能力:将固定好的细胞爬片,10 g/L甲苯胺蓝室温染色10 min,光学显微镜观察拍照。番红-O染色观察蛋白多糖的分泌能力:将固定好的细胞爬片,用1%番红-O室温浸染30 min,光镜下观察拍照。Ⅱ型胶原免疫细胞化学染色确定Ⅱ型胶原分泌情况:将固定好的细胞爬片,3%H2O2甲醇溶液灭活内源性过氧化物酶10 min,正常山羊血清室温封闭20 min,滴加1∶150稀释的Ⅱ型胶原单克隆抗体,4℃孵育过夜,滴加生物素化Ⅱ抗,37℃孵育20 min,滴加SABC试剂 37℃ 20 min,滴加新鲜配制的DAB显色剂,镜下控制显色。并设置阴性对照组。冲洗、脱水、封片,光镜下观察拍照。
2.3 IL-1β、IL-6和髓核细胞共培养 细胞培养7 d后,更换无血清培养基继续培养24 h,分别设置对照组和实验组,更换为含0.3% 胎牛血清的DMEM/F12 培养基,实验组中分别加入(10 μg/L、50 μg/L)IL-1β、IL-6共培养48 h,分别应用免疫组织化学法、RT-PCR和Western blotting检测细胞表达NGF的情况。
2.4 IL-1β、IL-6和髓核细胞共培养后 NGF表达的检测
①免疫组织化学法检测髓核细胞NGF的表达情况步骤同Ⅱ型胶原免疫细胞化学染色。
②RT-PCR检测髓核细胞NGF mRNA的表达 共培养48 h时弃去上清液,加入Trizol提取总RNA,采用TaKaRa PrimeScriptTMRT-PCR kit试剂盒二步法RT-PCR检测 NGF mRNA的表达。NGF-β、磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上、下游引物序列及产物长度见表1,扩增产物以2%琼脂糖凝胶电泳,凝胶成像系统进行拍照,MacintoshⅡ图像分析软件进行吸光度扫描分析,以目的条带吸光度与内参照GAPDH吸光度比值表示目的基因表达水平。
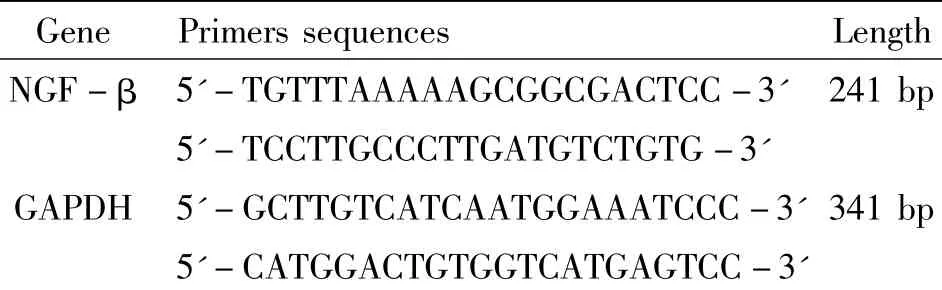
表1 NGF-β、GAPDH上、下游引物序列及产物长度Table1.The primer and the length of NGF and GAPDH
③Western blotting检测髓核细胞NGF蛋白表达 共培养48 h时弃去上清液,加入蛋白裂解液提取总蛋白,制备样品并配置SDS(sodium-dodecyl sulphate)-PAGE(polyacrylamide gel electrophoresis)凝胶,行SDS-PAGE凝胶电泳,将蛋白质电转移聚乙烯二氟
(polyvinylidene difluoride,PVDF)膜和膜封闭,封闭结束后,孵育Ⅰ抗4℃过夜(NGF-β和β-actinⅠ抗稀释度均为1∶1000),1×PBST洗涤3次,每次5 min,室温孵育Ⅱ抗(稀释度1∶1000)1 h。将 ECL发光试剂涂于PVDF膜上,反应1-3 min,置于暗盒中使X光胶片曝光2-30 min,显影定影,照像留底。用MacintoshⅡ图像分析系统计算分析条带的灰度值,用NGF-β与相应β-actin条带值的比值反映β-NGF表达的变化。
3 统计学处理
结 果
1 髓核细胞鉴定
自髓核组织中分离和培养出的髓核细胞,可被甲苯胺蓝、番红-O深染色,具有分泌糖胺多糖和蛋白多糖能力;Ⅱ型胶原免疫细胞化学染色确定该类型细胞可分泌Ⅱ型胶原,见图1。
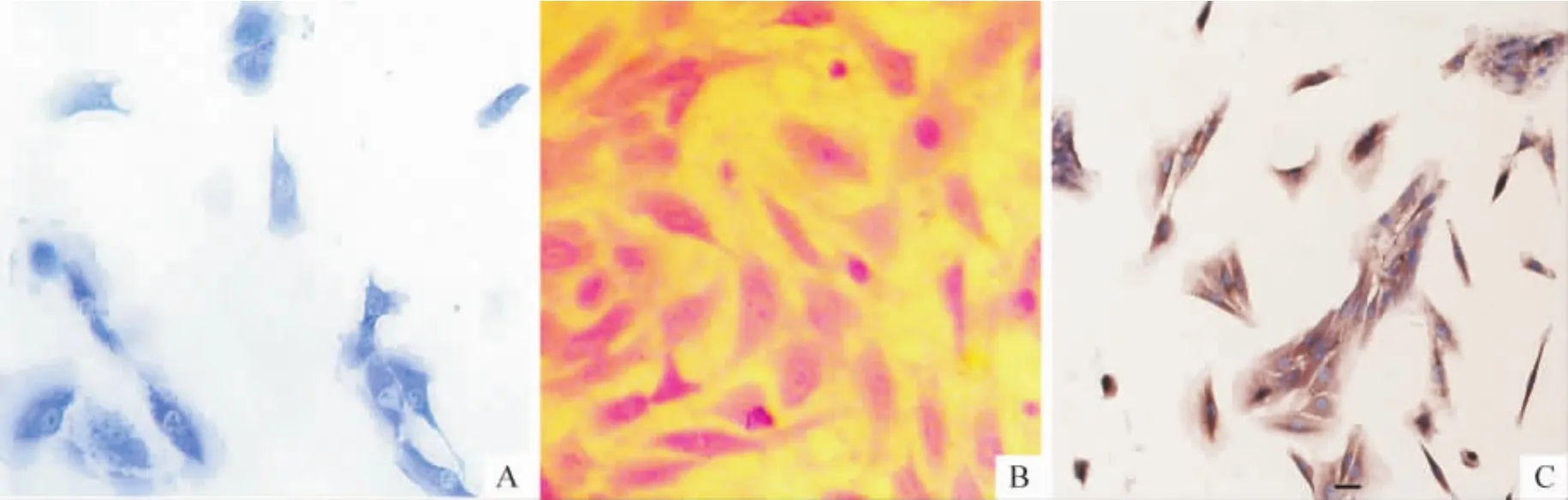
Figure1.The identification of nucleus pulposus cells(×200).A:the staining of toluidine blue;B:the staining of safranine-O;C:immunocytochemical staining of collagen-II.图1 髓核细胞的鉴定
2 髓核细胞和IL-1β、IL-6共培养后NGF表达情况
2.1 髓核细胞NGF表达的免疫组织化学检测 各组中髓核细胞细胞质中均出现弥散的淡黄染色,分别和IL-1β、IL-6共培养后的髓核细胞弥散的淡黄染色稍增多,见图2。
2.2 IL-1β、IL-6对髓核细胞 NGF mRNA 表达的影响 髓核细胞分别和不同浓度的IL-1β、IL-6共培养48 h后,提取总RNA行RT-PCR检测NGF mRNA表达,结果显示:与对照组比较,10 μg/L、50 μg/L IL-1β组分别上调了髓核细胞NGF mRNA的表达约2.6、2.8 倍,而10 μg/L、50 μg/L IL -6 组分别上调了约3.6、4.1倍,见图3、表2。
Figure2.Immunocytochemical staining of NGF in nucleus pulposus cells(×200).A:control;B:stimulated by IL-1β (50 μg/L);C:stimulated by IL -6(50 μg/L).图2 髓核细胞NGF免疫组织化学染色
2.3 IL-1β、IL-6对髓核细胞 NGF蛋白表达的影响 共培养48 h后提取总蛋白用Western blotting检测NGF蛋白表达结果显示:与对照组比较,10 μg/L、50 μg/L IL-1β组分别上调了髓核细胞NGF蛋白的表达约5.4、5.8 倍,而10 μg/L、50 μg/L IL -6 组分别上调了约7.4、8.0倍,结果和RT-PCR检测的NGF mRNA表达结果相一致,见图4、表2。

Figure3.The expression of NGF mRNA in the nucleus pulposus cells after IL-1β or IL-6 stimulation.1:control;2:10 μg/L IL - 1β;3:50 μg/L IL - 1β;4:10 μg/L IL -6;5:50 μg/L IL -6.图3 IL-1β、IL-6对髓核细胞NGF mRNA表达的影响

Figure4.The expression of NGF protein in the nucleus pulposus cells after IL-1β or IL-6 stimulation.1:control;2:10 μg/L IL - 1β;3:50 μg/L IL - 1β;4:10 μg/L IL -6;5:50 μg/L IL -6.图4 IL-1β、IL-6对髓核细胞NGF蛋白表达的影响
表2 IL-1β、IL-6对髓核细胞NGF mRNA及蛋白表达的影响Table2.The expression of NGF mRNA and protein in the nucleus pulposus cells after IL-1β or IL-6 stimulation(.n=3)

表2 IL-1β、IL-6对髓核细胞NGF mRNA及蛋白表达的影响Table2.The expression of NGF mRNA and protein in the nucleus pulposus cells after IL-1β or IL-6 stimulation(.n=3)
**P <0.01 vs control group;△△P <0.01 vs IL-1β.
Group NGF mRNA NGF protein Control 1.00 ±0.10 1.00 ±0.20 IL -1β10 μg/L 2.60 ±0.26** 5.40 ±0.30**IL -1β 50 μg/L 2.80 ±0.25** 5.80 ±0.28**IL -610 μg/L 3.60 ±0.22**△△ 7.40 ±0.40**△△IL -650 μg/L 4.10 ±0.23**△△ 8.00 ±0.45**△△
讨 论
椎间盘为“三明治”结构,上下为软骨终板,与上下方椎体相连,中间部分的内外层分别为髓核和纤维环。正常人类椎间盘除纤维环的外1/3存在血管神经外基本是一个不含神经血管组织,然而研究发现,在疼痛椎间盘中,微血管伴随神经末梢通过终板长入正常无血管的椎间盘内部[2,3]。Peng 等[2]的研究发现,椎间盘源性腰痛病人椎间盘中,新生的神经纤维和毛细血管沿椎间盘裂隙的肉芽组织长入纤维环和髓核,这种神经纤维的长入以及神经分布密度的增加可能是椎间盘源性疼痛的解剖基础。
与感受疼痛相关的神经元分为NGF依赖性神经元和胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)依赖性神经元。NGF依赖性神经元表达P物质(substance P,SP)及降钙素基因相关肽(calcitonin gene-related peptide,CGRP),与炎症疼痛相关;GDNF依赖性神经元表达结合凝集素B4,与各种疼痛如神经损害相关的神经性疼痛有关。在人类椎间盘中感觉神经元是表达CGRP神经元纤维,未发现结合凝集素B4神经元纤维,椎间盘感觉神经纤维主要是与炎症疼痛相关的包含神经肽的 NGF依赖性小神经元[9,10]。NGF在疼痛椎间盘中的表达较在无症状的椎间盘中明显增加,且存在表达NGF受体TrkA的神经纤维和微小血管[1,2]。NGF 能支持神经元存活,促进其生长、分化,维持其功能[11],对NGF起反应的神经元主要有交感神经元、感觉神经元和中枢胆碱能神经元,NGF由这些神经元的靶组织产生,被神经元的轴突末梢摄取,籍逆运行运输到胞体,为这些神经元的存活和维持所必需,所以,NGF是典型的靶源性神经营养因子。体外培养实验证实背根神经节细胞轴突生长依赖于髓核细胞分泌的NGF[12],提示髓核细胞产生的NGF可能是神经长入退变的椎间盘启动因素。
NGF具有营养神经和致敏伤害感受器的作用,在炎症组织中NGF的合成明显增加[13]。致炎因子IL-1β和TNF-α已被确定与椎间盘退变有明确关系[5],且可诱发椎间盘细胞分泌 NGF[6,7],从而诱导神经纤维的长入和致敏椎间盘感觉神经末梢而导致盘源性腰痛的发生。然而,Burke等[8]研究显示椎间盘源性腰痛患者的椎间盘中促炎因子IL-6、IL-8、PGE的表达比不伴腰痛的坐骨神经痛腰椎间盘突出患者明显增高,却未检测到IL-1β和TNF-α的表达。进一步的研究显示,IL-6、IL-8在退变的椎间盘中表达明显升高,而IL-1β和TNF-α则在椎间盘突出周围的肉芽组织中高表达[14]。因此,我们推测IL-6、IL-8等因子在导致椎间盘源性腰痛的发生发展过程中可能起到了重要作用,但其是否通过提高椎间盘细胞分泌NGF进而诱发了一系列反应这一具体机制,有待进一步研究。
本研究发现IL-1β、IL-6均可增强体外培养的人髓核细胞产生NGF的能力,同等浓度下IL-6具有更强的上调作用。但IL-1β、IL-6在正常和退变人椎间盘中的表达量尚需进一步确定以明确其在何种浓度下何者发挥了更重要的作用。结合以往文献,这一结果说明IL-6等因子可能通过提高椎间盘细胞分泌NGF,从而诱导神经纤维长入椎间盘而导致盘源性腰痛的发生。
[1]Deyo RA,Weinstein JN.Low back pain[J].N Engl J Med,2001,344(5):363-370.
[2]Peng B,Wuw,Hou S,et al.The pathogenesis of discogenic low back pain[J].J Bone Joint Surg Br,2005,87(1):62-67.
[3]Peng B,Hao J,Hou S,et al.Possible pathogenesis of painful intervertebral disc degeneration[J].Spine,2006,31(5):560-566.
[4]Aoki Y,Takahashi Y,Ohtori S,et al.Distribution and immunocytochemical characterization of dorsal root ganglion neurons innervating the lumbar intervertebral disc in rats:a review[J].Life Sci,2004,74(21):2627 -2742.
[5]Millward - Sadler SJ,Costello PW,Freemont AJ,et al.Regulation of catabolic gene expression in normal and degenerate human intervertebral disc cells:implications for the pathogenesis of intervertebral disc degeneration[J].Arthritis Res Ther,2009,11(3):R65.
[6]Abe Y,Akeda K,An HS,et al.Proinflammatory cytokines stimulate the expression of nerve growth factor by human intervertebral disc cells[J].Spine,2007,32(6):635-642.
[7]Purmessur D,Freemont AJ,Hoyland JA.Expression and regulation of neurotrophins in the nondegenerate and degenerate human intervertebral disc[J].Arthritis Res Ther,2008,10(4):R99.
[8]Burke JG,Watson RW,McCormack D,et al.Intervertebral discs which cause low back pain secrete high levels of proinflammatory mediators[J].J Bone Joint Surg Br,2002,84(2):196-201.
[9]Ozawa T,Ohtori S,Inoue G,et al.The degenerated lumbar intervertebral disc is innervated primarily by peptidecontaining sensory nerve fibers in humans[J].Spine,2006,31(21):2418-2422.
[10]Aoki Y,Ohtori S,Takahashi K,et al.Innervation of the lumbar intervertebral disc by never growth factor-dependent neurons related to inflammatory pain[J].Spine,2004,29(10):1077-1081.
[11]祝晓春,张 力,司云凤,等.SHP-2通过ERK和JNK通路调节PC12细胞应对NGF的细胞生存和凋亡[J].中国病理生理杂志,2009,25(7):1348 -1354.
[12]Yamauchi K,Inoue G,Koshi T,et al.Nerve growth factor of cultured medium extracted from human degenerative nucleus pulposus promotes sensory nerve growth and induces substance P in vitro[J].Spine,2009,34(21):2263-2269.
[13]Pezet S,McMahon SB.Neurotrophins:mediators and modulators of pain[J].Annu Rev Neurosci,2006,29:507-538.
[14]Burke JG,Watson RWG,Conhyea D,et al.Human nucleus pulposis can respond to a pro-inflammatory stimulus[J].Spine,2003,28(24):2685 -2693.
