苞叶香茶菜庚素诱导人白血病细胞系HL-60凋亡的分子机制研究
2010-08-01梁宇光董瑞华刘泽源军事医学科学院附属医院药学部北京100071
梁宇光,苏 佳,董瑞华,刘泽源(军事医学科学院附属医院药学部,北京 100071)
近年来,多项研究成果表明,诱导细胞凋亡是萜类成分介导抗肿瘤作用的主要途径[1-5]。本研究室在对香茶菜属植物中提取分离的20余种新化合物做抗肿瘤活性初步评价时发现,其中一种名为苞叶香茶菜庚素(melissoidesin G, MOG)的二萜化合物对多种肿瘤细胞均显示较强的体外抗肿瘤活性;且此化合物在植物中含量较高,遂对其抗肿瘤作用的相关分子机制进行了研究。本研究拟通过探讨MOG诱导白血病细胞系HL-60的凋亡效应,阐明该化合物可能的抗肿瘤分子作用机制,也为进一步研究和开发能应用于临床的天然植物类抗肿瘤新药提供一定的实验依据。
1 材料与方法
1.1 药品、试剂、仪器
MOG由中国科学院昆明植物所分离纯化。Caspase-3/7 试剂盒和caspase抑制剂Z-VAD-FMK(Promega公司)。JC-1(Molecular Probes公司)。抗cleaved-caspase-3, cleaved-caspase-7,cleavedcaspase-8,cleaved-caspase-9和anti-β-actin antibodies,辣根过氧化物酶标记的二抗,辣根过氧化物酶显色底物LumiGLO®substrate(Cell Signaling公司)。BCATMProtein Assay Kit(Pierce公司);其余试剂均购自Sigma公司。酶标检测仪(Clinic Bio生物技术公司)。流式细胞仪(美国Becton Dickinson公司)。
1.2 细胞培养
人早幼粒白血病细胞系HL-60,人T细胞白血病细胞系Jurkat-T,人幼单核细胞白血病细胞系U937,人慢性粒细胞白血病细胞系K562,人B细胞急性淋巴性白血病细胞系Daudi,人卵巢癌细胞系A2780,人肺癌细胞系A549,人宫颈癌细胞系Hela,人乳腺癌细胞系MCF-7,人前列腺癌细胞系PC-3为本室冻存;小鼠纤维瘤细胞系L929购自ATCC。上述细胞用含10%胎牛血清之RPMI1640或DMEM培养液在37 ℃,5% CO2条件下培养。
1.3 生长抑制试验
选用MTT法测定。通过细胞计数将细胞浓度调整至105·mL-1,先加细胞悬液至96孔板中,再将不同浓度MOG分别加入96孔板的细胞悬液中,于培养箱培养48 h,随后加入MTT再培养4~5 h,用10% SDS终止反应,约12 h溶解后于酶标分析仪570 nm波长处测各孔OD值并计算IC50(半数有效抑制浓度)。
1.4 流式细胞仪检测
用PI单染法分析周期变化。收集不同时间、不同剂量MOG处理的细胞,PBS洗3次,1000 r·min-1离心5 min,弃上清液,70%乙醇4 ℃条件下固定过夜。检测前用PBS洗2遍,然后加入RNase (1 mg·mL-1) 100 μL于37 ℃孵育30 min,加300 μL PI (50 μg·mL-1),避光孵育20 min后,用流式细胞检测仪检测。
用Annexin V/PI双染法分析细胞凋亡,收集不同时间、不同剂量MOG处理后的细胞,用PBS洗3次,1000 r·min-1离心5 min,弃上清液,将细胞重悬于50 μL结合缓冲液,室温孵育30 min后加入2.5 μL Annexin V-FITC和0.5 μL PI(10 mg·mL-1)继续避光孵育5 min。加入400 μL PBS,1 h内流式细胞检测仪检测。
1.5 线粒体膜电位(△Ψm)检测
应用膜电位依赖性结合的荧光探针JC-1标记△Ψm的变化,1×106个HL-60细胞在室温下与JC-1(5 μg·mL-1)反应15 min,用PBS洗2遍后重悬,流式细胞仪检测,JC-1单体(绿色荧光)和JC-1聚集体(红色荧光)分别通过FL-1和FL-2通道收集,激发光波长527 nm,发射光波长590 nm。
1.6 Caspase活性检测
依据Promega公司提供的Apo-ONE Homogeneous Caspase Assay试剂盒说明书进行操作(荧光检测激发光波长为485 nm,发射光波长为535 nm)。
1.7 免疫印迹(Western blotting)检测
MOG处理后既定时间内收集细胞,用冰冷的PBS洗细胞1次,加入预冷的细胞裂解液。细胞裂解处理后,将裂解液在4 ºC条件下12 000 r·min-1离心10 min。等量蛋白(20 μg)进行12% SDS-PAGE电泳并电转。转膜后用特异性一抗孵育,洗膜,二抗孵育。结合的抗体用ECL显色系统检测。
2 结果
2.1 MOG与DDP对多种肿瘤细胞系的增殖抑制活性
选择10种人常见肿瘤细胞系用MTT法对MOG的细胞增殖抑制活性进行评估,并与阳性对照药顺铂(DDP)比较。结果表明,MOG对不同肿瘤细胞的增殖抑制程度不同。其中,血液系统肿瘤细胞系普遍对MOG较敏感,如Jurkat-T,U937,K562及Daudi,其IC50均较低且几乎在同一水平。MOG对肿瘤细胞系的增殖抑制强度与DDP相近。同批比较MOG与DDP对多种肿瘤细胞系的IC50见图1。因HL-60相对其他细胞株对MOG最敏感,以下实验均以HL-60为细胞模型研究。
2.2 MOG诱导HL-60细胞凋亡
为了进一步验证MOG诱导肿瘤细胞死亡的具体形式,我们通过流式细胞术分析不同浓度的MOG与HL-60细胞共孵育24 h后细胞DNA含量的变化。结果表明:HL-60细胞在10 μmol·L-1MOG作用24 h后出现明显的sub-G1峰,不同浓度MOG作用后sub-G1期细胞比例呈剂量依赖性升高,说明HL-60细胞正在经历凋亡(图2)。通过Annexin V-FITC结合实验可以分析细胞凋亡的严重程度,如图3所示,不同浓度MOG作用HL-60细胞9 h后,Annexin V阳性细胞的比例呈现很明显的剂量依赖性升高,10,20 μmol·L-1MOG作用9 h后HL-60细胞几乎全部凋亡。
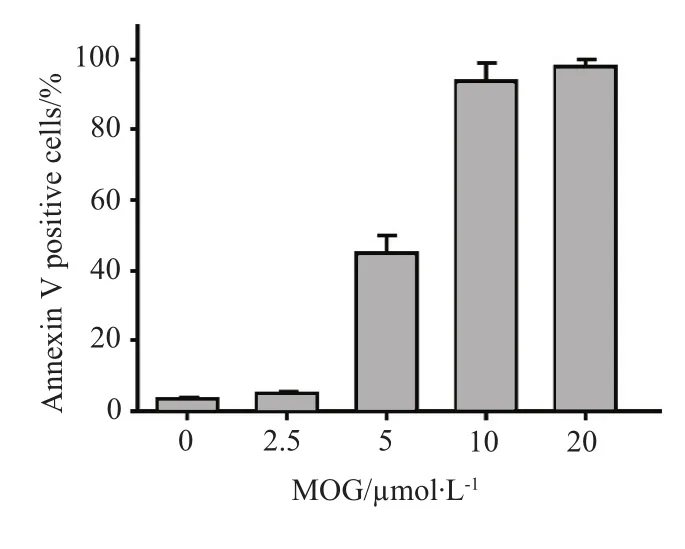
图3 MOG诱导HL-60细胞凋亡的剂量效应Fig 3 Dose course of the apoptotic effect induced by MOG in HL-60
2.3 MOG诱导△Ψm降低
线粒体在细胞凋亡调节中起着不可替代的作用,△Ψm的变化可以直接反映线粒体功能状态的改变。用JC-1作为荧光探针测定线粒体跨膜电位时,发现MOG作用HL-60细胞一定时间后,细胞内线粒体膜电位会降低且呈时间依赖性(图4)。红绿荧光比值FL-2/FL-1反映线粒体膜电位水平变化,与对照组(FL-2/FL-1 = 5.55)比较,10 μmol·L-1的MOG作用细胞1.5 h后,膜电位水平有明显降低(FL-2/FL-1= 1.93),9 h达最低值(FL-2/FL-1 = 0.02)。
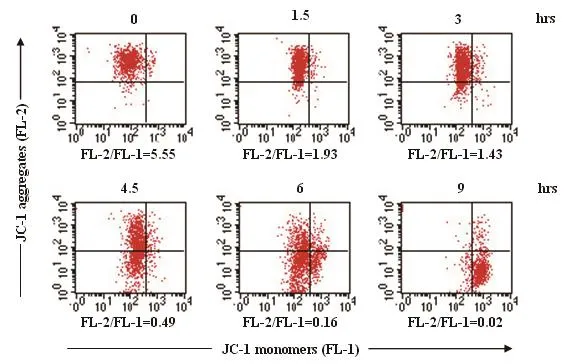
图4 MOG引起△Ψm改变的时间效应Fig 4 Time course of change of △Ψm induced by MOG
2.4 Caspase激活在MOG诱导的细胞凋亡中的作用
Caspase家族在细胞凋亡发生的过程中起着非常重要的作用,大多数凋亡过程均可检测到caspase通路的激活,不同的细胞类型或不同的凋亡诱导剂可能激活不同的caspase家族成员。Western blotting实验结果显示,HL-60细胞在MOG(10 μmol·L-1)作用6 ~12 h后可见明显的caspase-3,caspase-7,caspase-8和caspase-9剪切条带(图5)。 但在广谱caspase抑制剂Z-VAD-FMK的作用下,MOG诱导的caspase激活可以被完全抑制(图6)。而且,在Z-VAD-FMK的作用下,MOG诱导的细胞凋亡也被完全抑制(图7),提示MOG诱导caspase依赖性细胞凋亡。
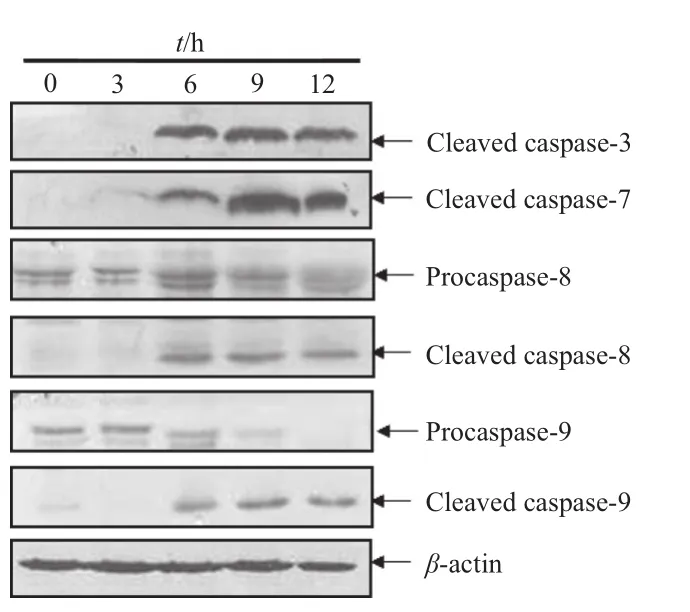
图5 MOG诱导的caspases活化Fig 5 MOG-inducing caspases activation
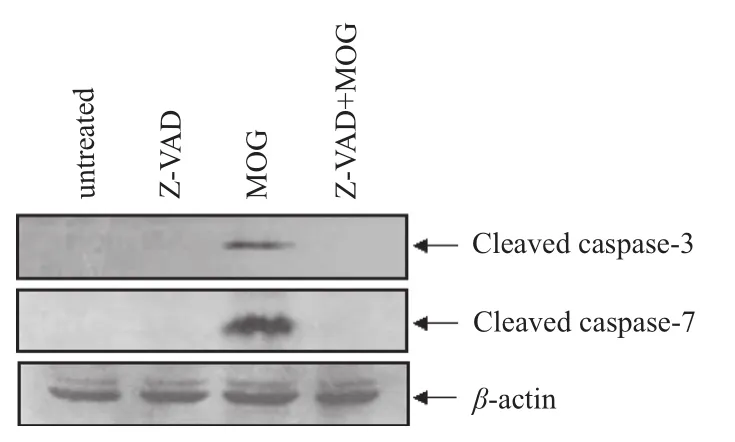
图6 Z-VAD-FMK抑制MOG诱导的caspase-3/7活化Fig 6 Effect of inhibition by Z-VAD-FMK on MOG-inducing caspase-3/7 activation
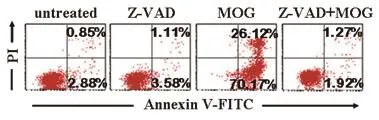
图7 Z-VAD-FMK阻断MOG诱导的细胞凋亡Fig 7 Effect of inhibition by Z-VAD-FMK on MOG-inducing apoptosis
2.5 NAC对MOG诱导△Ψm降低的 影响
用JC-1探针标记△Ψm,观察抗氧化剂NAC对MOG诱导的△Ψm降低的影响。如图8所示,1.25 mmol·L-1NAC单独作用不影响细胞△Ψm,而与10 μmol·L-1MOG共孵育HL-60细胞6 h则可以完全抑制MOG诱导的△Ψm降低。说明NAC对MOG诱导的△Ψm降低有明显的抑制作用。而40 μmol·L-1Z-VAD-FMK与10 μmol·L-1MOG共孵育HL-60细胞6 h仅可部分抑制MOG诱导的△Ψm降低。
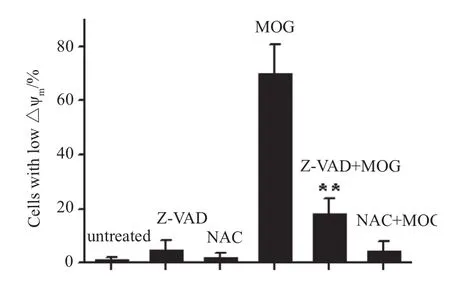
图8 NAC对MOG诱导的△Ψm降低的影响 (n = 3)Fig 8 Effect of NAC on MOG-inducing △Ψm decrease (n = 3)
2.6 NAC对MOG诱导的caspase-3激活和细胞凋亡的影响
为评价细胞氧化还原状态的改变在MOG诱导的细胞凋亡中的作用,我们用Annexin V标记流式细胞仪检测细胞凋亡,荧光检测caspase-3激活。结果如图9所示,NAC(1.25 mmol·L-1)和/或MOG(10 μmol·L-1)处理HL-60细胞9 h后,NAC可以完全抑制MOG诱导的细胞凋亡及caspase-3激活。
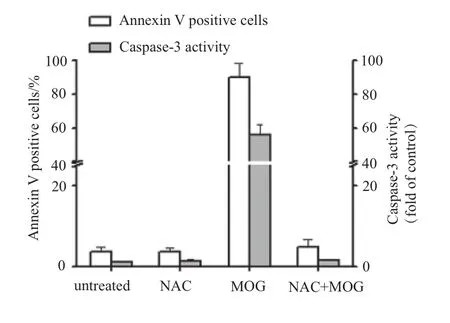
图9 NAC对MOG诱导的caspase-3激活和细胞凋亡的影响 (n = 3)Fig 9 Effect of NAC on MOG-inducing caspase-3 activation and apoptosis (n = 3)
3 讨论
本研究通过观察MOG对多种肿瘤细胞株的生长抑制能力、对HL-60细胞周期及凋亡的影响发现,MOG能够诱导肿瘤细胞发生周期阻滞和凋亡并呈时间和剂量依赖性,说明此二萜化合物主要通过抑制细胞增殖、诱导肿瘤细胞凋亡而产生抗肿瘤效果。
凋亡通路的激活是抗肿瘤药杀灭肿瘤细胞的关键因素[6]。目前,化疗药物诱导肿瘤细胞凋亡的核心通路有配体或受体激活的caspase依赖性细胞凋亡通路和线粒体依赖性细胞凋亡通路。Caspase依赖性细胞凋亡通路是指配基与受体结合,激活caspase-8,进而激活caspase-3和PARP诱导细胞凋亡;线粒体依赖性细胞凋亡是通过线粒体损伤引起的,包括线粒体膜通透性及膜电位变化、细胞色素c和其他凋亡因子的释放等改变,最终也可以激活caspase-3和PARP导致细胞凋亡[7-8]。
本实验中MOG可以引起caspase- 3/7的激活,同时MOG又可诱导时间依赖性线粒体膜电位降低,提示caspase通路激活及线粒体功能失调均参与MOG诱导的细胞凋亡过程。在广谱caspase抑制剂Z-VADFMK的作用下,MOG诱导的细胞凋亡可以被完全抑制,说明MOG诱导的细胞凋亡依赖于caspase通路的激活。而抗氧化剂NAC也可特异性抑制MOG诱导细胞凋亡作用,提示MOG引发细胞凋亡效应与细胞内氧化还原状态失平衡有关。试验观察到外源性加入NAC可以抑制MOG引起的HL-60细胞增殖抑制,线粒体膜电位下降,caspase激活以及细胞凋亡,而caspase 广谱抑制剂Z-VAD-FMK虽然能完全阻断MOG诱导的细胞凋亡,却只能部分抑制△Ψm降低,因此我们推测MOG诱导细胞内氧化还原失平衡是其介导凋亡效应的启动因素。进一步研究表明,不同机制的抗氧化剂中仅有NAC和GSH可以抑制MOG诱导HL-60细胞增殖抑制,提示细胞内氧化还原失平衡可能由GSH水平降低引起,结合MOG和GSH的化学结构特征,推测GSH很可能是MOG诱导肿瘤细胞凋亡的细胞内作用靶点,相关试验仍在进行中。
本课题通过对苞叶香茶菜庚素诱导的细胞凋亡分子机制研究,初步探明了该二萜类化合物抗肿瘤作用可能的作用靶点及参与调节的信号传递途径,研究结果可以为进一步研究和开发能应用于临床的天然植物类抗肿瘤新药提供实验依据。
[1] Salminen A, Lehtonen M, Suuronen T,et al.Terpenoids: natural inhibitors of NF-kappaB signaling with anti-inflammatory and anticancer potential[J].Cell Mol Life Sci, 2008, 65(19): 2979-2999.
[2] Deng R, Tang J, Xia LP,et al.ExcisaninA, a diterpenoid compound purified fromIsodon MacrocalyxinD, induces tumor cells apoptosis and suppresses tumor growth through inhibition of PKB/AKT kinase activity and blockade of its signal pathway[J].Mol Cancer Ther, 2009, 8(4): 873-882.
[3] Lin FM, Tsai CH, Yang YC,et al.A novel diterpene suppresses CWR22Rv1 tumor growth in vivo through antiproliferation and proapoptosis[J].Cancer Res, 2008, 68(16): 6634-6642.
[4] Kunnumakkara AB, Ichikawa H, Anand P,et al.Coronarin D,a labdane diterpene, inhibits both constitutive and inducible nuclear factor-kappaB pathway activation, leading to potentiation of apoptosis, inhibition of invasion,and suppression of osteoclastogenesis[J].Mol Cancer Ther, 2008, 7(10): 3306-3317.
[5] Takayuki I, Yang Y, Kentaro B,et al.The inhibition of NF-kappaB at a level after nuclear translocation of activated NF-kappaB may be a common feature of compounds with terpene structure[J].Mol Cancer Ther, 2005, 4(4): 578-586.
[6] Fulda S, Debatin KM.Extrinsic versus intrinsic apoptosis pathways in anticancer chemotherapy[J].Oncogene, 2006,25(34): 4798-4811.
[7] Jiang X, Wang X.Cytochrome C-mediated apoptosis[J].Annu Rev Biochem, 2004, 73: 87-106.
[8] Thorburn A.Death receptor-induced cell killing[J].Cell Signal,2004, 16(2): 139-144.
