nPKC和cPKC调节骨骼肌葡萄糖转运体4型转位的研究*
2010-07-21李金茹牛文彦初桂兰
李金茹 牛文彦 初桂兰
餐后升高的血糖80%由胰岛素刺激骨骼肌摄取,葡萄糖转运入细胞是骨骼肌葡萄糖代谢的限速步骤,由胰岛素敏感的葡萄糖转运体4型(glucose transporter 4,GLUT4)完成。基础状态下,GLUT4主要位于细胞内囊泡上,少量位于细胞膜上。胰岛素作用下,GLUT4从细胞内囊泡转位到细胞膜上,从而转运更多的葡萄糖进入细胞[1]。另一个生理性刺激GLUT4转位的因素是运动/肌肉收缩。相对于胰岛素作用机制而言,运动/肌肉收缩促进葡萄糖摄取的机制尚不明确。目前研究认为,收缩刺激骨骼肌葡萄糖摄取主要通过2个通路,一是腺苷酸激酶(AMPK)途径[2],运动收缩消耗能量,AMP/ATP 升高,激活AMPK,促进骨骼肌葡萄糖转运;另一是Ca2+介导的信号,胞浆内Ca2+浓度升高触发肌肉收缩,激活下游信号分子。蛋白激酶C(PKC)为Ca2+的下游信号分子之一[3]。PKC可由二酰甘油(DAG)激活,肌肉收缩可增加细胞内DAG含量,激活PKC[4]。PKC在收缩刺激骨骼肌摄取葡萄糖的机制中的作用目前说法不一。本研究应用PKC激活剂佛波酯(PMA),观察激活PKC对GLUT4转位的调节作用。
1 材料与方法
1.1 试剂 PMA、PKC抑制剂Go6976、Go6983、邻苯二胺、抗myc多克隆抗体购自Sigma。DMEM高糖和低糖培养基购自天润善达(GIBCO分装)。胎牛血清(fetal bovine serum,FBS)为以色列优级血清。马血清(horse serum,HS)购自美国GIBCO。细胞培养耗材购自Corning。
1.2 细胞培养与处理 稳定过表达GLUT4myc的C2C12小鼠骨骼肌细胞株由本课题组确立。C2C12GLUT4myc细胞用含 10%FBS (体积分数,V/V)和 5 mg/L杀稻瘟菌素(blasticidin)的DMEM高糖培养基,在37℃,5%CO2条件下培养,按4×104/mL接种于培养板中,待细胞汇合度达100%时,用含5%HS(V/V)DMEM高糖培养基分化细胞为肌管。C2C12GLUT4myc肌管用无血清的DMEM低糖培养基,在37℃,5%CO2条件下,培养3 h后进行实验处理。根据不同孵育细胞和条件分为PMA组(0.1 μmol/L PMA孵育20 min),Go6983+PMA 组(10 μmol/L Go6983 预孵育 30 min,10 μmol/L Go6983与0.1 μmol/L PMA 共孵育 20 min)、Go6976+PMA组(10 μmol/L Go6976 预孵育 30 min,10 μmol/L Go6976 与 0.1 μmol/L PMA 共 孵 育 20 min)、PMA24 h+PMA 组(1 μmol/L PMA预孵育24 h后,0.1 μmol/L PMA孵育 20 min)和PMA24 h+Go6976+PMA组(1 μmol/L PMA预孵育24 h后,10 μmol/L Go6976 预 孵 育 30 min,10 μmol/L Go6976 与 0.1 μmol/L PMA共孵育20 min),每组细胞均以Basal组(未处理)作为对照。
1.3 偶联抗体的吸光度分析法 处理后的C2C12GLUT4myc肌管经多聚甲醛固定,脱脂牛奶封闭后,用多克隆抗myc抗体室温孵育1 h;用偶联过氧化物酶HRP的山羊抗兔IgG室温孵育肌管1 h;加入底物邻苯二胺溶液,反应15~30 min后终止,用酶标仪测定上清液492 nm的吸光度值。
1.4 统计学方法 采用SPSS 13.0统计软件进行统计学分析。计量资料以x±s表示,组间比较采用单因素方差分析,两两比较方差齐时采用LSD-t检验,方差不齐时采用Dunnett’s检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PMA组、Go6983+PMA组及Go6976+PMA组C2C12GLUT4myc肌管GLUT4myc转位比较 PMA组与Basal组相比,GLUT4myc转位增加,差异有统计学意义(P<0.001)。Go6983+PMA组GLUT4myc转位比PMA组降低92%(P<0.01),与Basal组相比差异无统计学意义(P>0.05)。Go6976+PMA组GLUT4myc转位与PMA组相比降低,与Basal组和Go6983+PMA组相比增加,差异均有统计学意义(P<0.05),见表 1。
表1 PMA组、Go6983+PMA组、Go6976+PMA组GLUT4myc 转位 (n=4s)
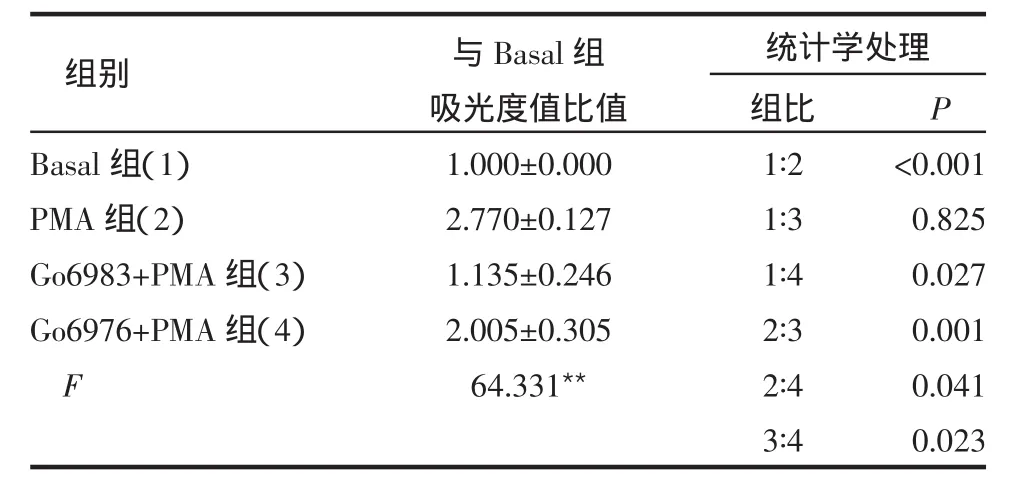
表1 PMA组、Go6983+PMA组、Go6976+PMA组GLUT4myc 转位 (n=4s)
觹觹P < 0.01
组别统计学处理P Basal组(1)PMA 组(2)Go6983+PMA 组(3)Go6976+PMA 组(4)F与Basal组吸光度值比值1.000±0.000 2.770±0.127 1.135±0.246 2.005±0.305 64.331**组比1∶2 1∶3 1∶4 2∶3 2∶4 3∶4<0.001 0.825 0.027 0.001 0.041 0.023
2.2 PMA组、PMA24 h+PMA组、PMA24 h+Go6976+PMA组C2C12GLUT4myc肌管GLUT4myc转位比较 PMA24 h+PMA组GLUT4myc转位比PMA组减少了74%(P<0.001)。PMA24 h+Go6976+PMA 组GLUT4myc转位与PMA组相比降低了89%(P<0.001),与Basal组相比差异无统计学意义(P>0.05),见表 2。
表2 PMA组、PMA 24 h+PMA组、PMA 24 h+Go6976+PMA 组 GLUT4myc转位 (n=4±s)

表2 PMA组、PMA 24 h+PMA组、PMA 24 h+Go6976+PMA 组 GLUT4myc转位 (n=4±s)
觹觹P < 0.01
组别统计学处理P Basal组(1)PMA 组(2)PMA 24 h+PMA(3)PMA 24 h+Go6976+PMA(4)F与Basal组吸光度值比值1.000±0.000 2.745±0.169 1.460±0.155 1.190±0.163 128.243**组比1∶2 1∶3 1∶4 2∶3 2∶4 3∶4 0.001 0.036 0.333<0.001<0.001 0.227
3 讨论
PKC是一种丝氨酸/苏氨酸激酶[5]。PKC家族有3种同工酶,cPKC、nPKC和非典型PKC。nPKC和cPKC可被DAG激活,cPKC还可被升高的Ca2+激活,而aPKC不受DAG和Ca2+的调节[6]。PKC抑制剂钙感光蛋白(Calphostin C)可以作用于nPKC和cPKC的DAG结合位点,抑制骨骼肌收缩刺激的葡萄糖转运[7],推测nPKC或cPKC参与骨骼肌葡萄糖转运。
PMA作为DAG的类似物,是cPKC和nPKC的激活剂。PMA可以与nPKC和cPKC的DAG结合位点结合,从而激活PKC。PMA急性刺激可以增加骨骼肌葡萄糖转运[8]。本实验中,PMA急性刺激C2C12 GLUT4myc肌管(PMA组)的GLUT4myc转位,表明PMA激活nPKC和cPKC后,活化的PKC可以使GLUT4myc从肌浆转位到细胞膜,提示激活PKC(nPKC和cPKC)可调节骨骼肌GLUT4转位。
为了进一步确定nPKC和cPKC在骨骼肌GLUT4转位的信号转导中的作用,本实验应用了PKC抑制剂Go6983和Go6976。Go6983为nPKC和cPKC的抑制剂。Go6983+PMA组C2C12GLUT4myc肌管经Go6983预孵育后,可以完全抑制PMA急性刺激的GLUT4myc的转位,即Go6983抑制了nPKC和cPKC的激活,从而完全抑制了GLUT4myc的转位,说明cPKC和nPKC介导PMA急性刺激的GLUT4myc转位。Go6976为cPKC特异性抑制剂,Go6976+PMA组C2C12GLUT4myc肌管经Go6976预孵育可以部分抑制PMA急性刺激的GLUT4myc转位,即Go6976抑制了cPKC的激活,从而抑制了部分GLUT4myc转位,说明cPKC参与了C2C12 GLUT4myc肌管的 GLUT4转位的信号转导,与Go6983对GLUT4 myc转位的完全抑制相比,其未被Go6976抑制的GLUT4转位部分应为nPKC介导,表明nPKC同样参与了骨骼肌GLUT4转位的信号转导。
高浓度PMA慢性孵育可以下调PKC的表达,特别是在C2C12细胞中,主要下调nPKC(PKCε)的表达[9]。本实验中,PMA 24 h+PMA组C2C12GLUT 4myc肌管经高浓度PMA慢性预孵育后,再应用PMA急性刺激,GLUT4myc转位虽然较Basal组增加,但是幅度比PMA急性刺激的GLUT4myc的转位明显降低,推测是由于慢性孵育下调nPKC的表达,从而部分抑制PMA急性刺激的GLUT4myc转位,说明nPKC参与C2C12GLUT4myc肌管的GLUT 4myc的转位。而另一部分未受抑制的GLUT4myc转位可被cPKC抑制剂Go6976抑制,说明cPKC也参与了C2C12GLUT4myc肌管的GLUT4myc的转位。
综上所述,PMA可以与nPKC和cPKC的DAG结合位点结合,激活PKC,增强骨骼肌GLUT4转位。抑制nPKC或cPKC的活性,降低PMA刺激的骨骼肌GLUT4转位。因此,激活nPKC或cPKC可调节骨骼肌GLUT4转位。本课题组经初步实验发现,收缩刺激C2C12GLUT4myc肌管,可激活PKC,其是否介导收缩调节GLUT4转位的机制有待进一步研究。
[1] Karyowski O,Zeigerer A,Cohen,et al.GLUT4 is retained by an intracellular cycle of vesicle formation and fusion with endosomes[J].Mol Biol cell,2004,15(2):870-882.
[2] Hayashi T,Hirshman MF,Kurth EJ,et al.Evidence for 5'AMP-activated protein kinase mediation of the effect of muscle contraction on glucose transport[J].Diabetes,1998,47(8):1369-1373.
[3]Wright DC,Hucker KA,Holloszy JO,et al.Ca2+and AMPK both mediate stimulation of glucose transport by muscle contractions[J].Diabetes,2004,53(2):330-335.
[4] Cleland PJ,Appleby GJ,Rattigan S,et al.Exercise-induced translocation of protein kinase C and production of diacylglycerol and phosphatidic acid in rat skeletal muscle in vivo.Relationship to changes in glucose transport[J].J Biol Chem,1989,264(30):17704-17711.
[5] Nishizuka Y.Intracellular signaling by hydrolysis of phospholipids and activation of protein kinase C[J].Science,1992,258(5082):607-614.
[6] Newton AC.Regulation of the ABCkinase by phosphorylation:protein kinase C as a paradigm[J].Biochem J,2003,370(Pt 2):361-371.
[7] Ihlemann J,Galbo H,Ploug T.Calphostin C is an inhibitor of contraction,but not insulin-stimulated glucose transport,in skeletal muscle[J].Acta Physiol Scand,1999,167(1):69-75.
[8] Tsiani E,Bogdanovic E,Sorisky A,et al.Tyrosine phosphatase inhibitors,vanadate and pervanadate,stimulate glucose transport and GLUT translocation in muscle cells by a mechanism independent of phosphatidylinositol 3-kinase and protein kinase C [J].Diabetes,1998,47(11):1676-1686.
[9]Cárdenas C,Müller M,Jaimovich E,et al.Depolarization of skeletal muscle cells induces phosphorylation of cAMP response element binding protein via calcium and protein kinase Calpha[J].J Biol Chem,2004,279(37):39122-39130.
