甲基强的松龙鞘内注射治疗多发性硬化疗效观察
2010-07-16董艳玲李吕力李瑶宣滕晓茗肖继东张德敏
董艳玲,李吕力,李瑶宣,梁 浩,滕晓茗,肖继东,张德敏
(广西壮族自治区人民医院,南宁530021)
多发性硬化(MS)是以中枢神经系统(CNS)白质脱髓鞘为特点,主要由T细胞介导的自身免疫性疾病,迄今尚无肯定有效的治愈方法。糖皮质激素是其主要治疗药物,但全身用药血药浓度低,部分患者对激素不敏感,且长期用药可增加不良反应的发生率和激素的依赖性[1]。2008年1月~2009年12月,我们对22例MS患者采用鞘内注射MPS治疗,疗效满意。现报告如下。
1 资料与方法
1.1 临床资料 54例MS急性期患者,均符合Mc-Donald(2005)诊断标准[2],其中男17例,女37例;年龄18~59(35.9±11.5)岁;Kurtzke神经功能障碍量表(EDSS)评分 1.5 ~8.0(4.82 ±1.97)分。CNS受累20例,脊髓受累34例。均排除严重感染、结核及严重脏器功能不全等情况。将54例患者随机分为观察组(22例)和对照组(32例),两组一般情况具有可比性。
1.2 治疗及观察方法 两组均常规腹穿、测压。观察组鞘内缓慢注入甲基强的松龙(MPS)40 mg+生理盐水5 ml。每3 d 1次,治疗3次;从第3次注射次日起改为口服强的松60 mg/d,常规逐渐减量,服用3个月。对照组予MPS 1 000 mg加入生理盐水250 ml中缓慢(2 h内)静滴,连续5 d。后改为口服强的松60 mg/d,常规逐渐减量,服用3个月。治疗前及治疗后5、10、15、30 d 行 EDSS 评分,下降≥2.0分为显效,下降0.5~1.5分为有效,未下降为无效,增加为恶化。有效=显效+有效。观察两组不良反应发生情况。
1.3 统计学方法 采用SPSS 13.0统计软件。计量资料采用±s表示,采用t检验;两组有效率比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
两组患者治疗前后EDSS评分见表1;观察组治疗后5、10、15、30 d 有效率分别为 81.8%、86.4%、90.9%、95.5%,对照组分别为 56.3%、78.1%、90.6%、96.9%,两组治疗后5 d时有效率比较,P<0.05;说明鞘内注入比常规方法见效快。两组均未出现神经精神症状、骨关节病变等,血常规、尿常规、肝功能无异常。观察组1例、对照组2例出现上腹部闷痛。观察组治疗15 d后10例患者出现向心性肥胖及痤疮,对照组30例治疗5 d即出现向心性肥胖及痤疮。
3 讨论
MS是一种由细胞介导的CNS伴炎性改变的自身免疫性脱髓鞘性疾病,其病理特征为CNS白质内多发的神经髓鞘破坏及炎症细胞浸润,病情多呈复发缓解型,每次复发后残留不同程度的后遗症,随着发作次数增多,后遗症逐渐加重,即病情呈阶梯式恶化。目前认为,MS是具有遗传易感性的个体在某种外源介质诱导下产生的有T细胞介导的自身免疫病,可归纳为免疫系统应答过度伴选择性攻击中枢系统白质[3],其特点为时间(复发缓解)及空间(CNS白质内多灶性损害)上的多发性。
表1 两组治疗前后EDSS评分比较(分,±s)
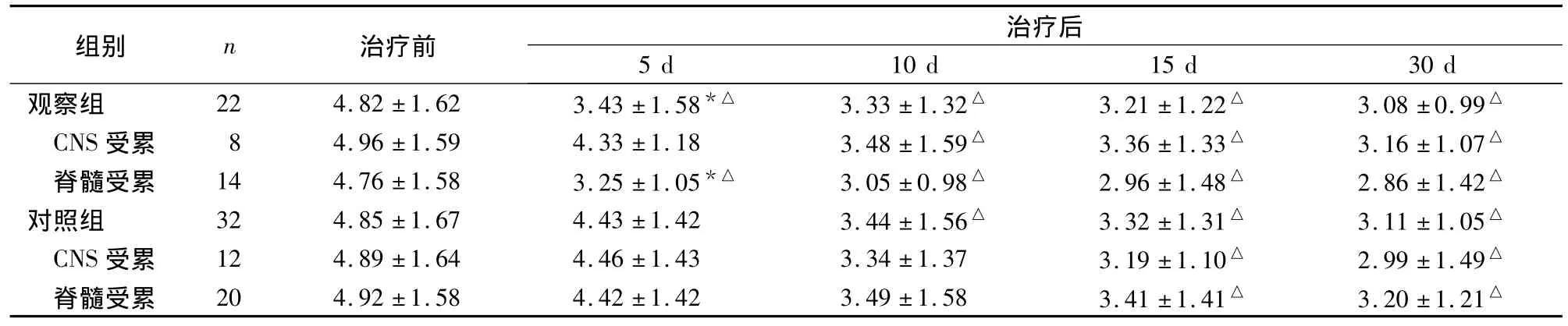
表1 两组治疗前后EDSS评分比较(分,±s)
注:与对照组比较,*P <0.05;与治疗前比较,△P <0.05
治疗后5 d 10 d 15 d 30 d观察组 22 4.82 ±1.62 3.43 ±1.58*△ 3.33 ±1.32△ 3.21 ±1.22△ 3.08 ±0.99组别 n 治疗前△CNS受累 8 4.96 ±1.59 4.33 ±1.18 3.48 ±1.59△ 3.36 ±1.33△ 3.16 ±1.07△脊髓受累 14 4.76±1.58 3.25±1.05*△ 3.05 ±0.98△ 2.96±1.48△ 2.86±1.42△对照组 32 4.85 ±1.67 4.43 ±1.42 3.44 ±1.56△ 3.32 ±1.31△ 3.11 ±1.05△CNS受累 12 4.89 ±1.64 4.46 ±1.43 3.34 ±1.37 3.19 ±1.10△ 2.99 ±1.49△脊髓受累 20 4.92 ±1.58 4.42 ±1.42 3.49 ±1.58 3.41 ±1.41△ 3.20 ±1.21△
目前对MS的治疗方法多样,但尚无特效疗法,临床对急性期患者多采用大剂量MPS冲击疗法[4]。但其长期疗效缺乏足够资料随访证实[5]。MPS的作用机制为:①MPS可诱导外周及浸润中枢神经系统的T细胞凋亡,减少T细胞增殖,从而终止中枢神经系统炎症[6,7];②抑制细胞脱氧核糖核酸的合成和有丝分裂,调节免疫系统的众多环节;③减少IFN-γ分泌细胞,上调IL-4、IL-10水平,恢复CD+4辅助性T细胞Th1/Th2细胞因子的平衡,促进MS修复[7];④增强毛细血管内皮细胞功能,降低基质金属蛋白内切酶及蛋白水解酶的活性;⑤下调黏附分子表达,使进入脑实质的淋巴细胞减少。
本研究结果显示,两组疗程结束时有效率无显著差异,但观察组治疗5 d时有效率及EDSS评分明显高于对照组,尤其是对脊髓受累者。证实鞘内注射MPS起效快,能够很快控制病情进展,并促进恢复。有报道,脊髓型MS对MPS冲击疗法相对不敏感,部分危重患者耐受性较差。本研究发现鞘内注药对于脊髓受累为主的MS疗效较好,可能原因为鞘内注射为局部用药,脑脊液中血药浓度瞬时可达到最高,药物直接进入蛛网膜下腔,参与脑脊液循环,避免了静脉给药的血液稀释以及血脑屏障的阻碍作用,使中枢神经系统内药物浓度显著提高[8];鞘内注药后药物可随脑脊液循环到达各脑室、脑池、脊神经根等各个部位,直接作用于脑和脊髓白质。鞘内注射后由于体位的关系药物较多滞留于脊髓蛛网膜下腔,而大脑、脑干及小脑等白质内病灶不能或较少接触脑脊液内药物,故对CNS受累为主者效果相对较差。值得注意的是本疗法为有创性治疗,需反复腰穿;大剂量应用可产生依赖性,引起血糖升高、骨质疏松、感染等,不适用于糖尿病患者。
综上所述,鞘内注射MPS治疗MS疗程短,起效快,近期疗效显著,操作简便、经济,不良反应相对小,尤适用于MPS冲击效果不理想以脊髓损害为主的MS。但应用时应因人而异,坚持个体化治疗原则。
[1]郭怡青,胡学强.多发性硬化临床免疫干预治疗研究现状[J].中国神经免疫学和神经病学杂志,2001,8(4):228-230.
[2]王捷,杨宏.糖皮质激素不同给药方式治疗急性期多发性硬化的疗效观察[J].中风与神经疾病杂志,2004,21(5):443-445.
[3]Mayr WT,Rodriguez M.Multiple sclerosis update[J].Minnmed,2002,85(6):36-39.
[4]屈新辉,张昆南,龚凌云,等.大剂量甲泼尼龙与免疫球蛋白治疗多发性硬化急性期的疗效观察[J].江西医药,2008,43(8):784-787.
[5]Martinz-Caceres EM,Barrau MA,Brieva L,et al.Treatment with methylprednisolone in relapses of multiple sclerosis patients:immunological evidence of immediate and short-term but not long-lasting effects[J].Clin Exp Immunol,2002,127(1):165.
[6]Schmidt J,Gold R,Schonrock L,et al.T-cell apoptosis in situ in experimental autoimmune encephalomyelitis following methylprednisolone pulse therapy[J].Brain,2000,123(7):1431-1441.
[7]Leussink VI,Jung S,Merschdorf U,et al.High-dose methylprednisolone therapy in multiple sclerosisinduces apoptosis in peripheral blood leukocytes[J].Arch Neurol,2001,58(1):91.
[8]陈跃鸿,林传成,张梅芳.鞘内注入大剂量地塞米松治疗脊髓型多发性硬化5 例[J].脑与神经疾病杂志,2001,9(1):110-112.
