VA菌根对喀斯特草本群落植物根际养分影响研究
2010-07-13王圳张金池崔晓晓王如岩王定胜黄建庭
王圳,张金池,崔晓晓,王如岩,王定胜,黄建庭
1.南京林业大学森林资源与环境学院,江苏 南京 210037;2.连云港市林业技术指导站,江苏 连云港 222001
菌根是真菌和植物根系间建立起来的一种互利共生关系。丛枝菌根真菌是自然界中最常见而且可侵染的寄主范围最广的一种土壤微生物(简称AMF),陆地 90%以上的有花植物都能够与它形成菌根共生体,简称为 VA菌根[1]。研究表明,菌根依靠菌丝在土壤中的扩展和延伸,扩大植物根系的接触面积,能够分泌各种酶类和生长调节物质,促进根系生长和根际微生态的改变,可增强植物对N、P、K等元素和水分的吸收利用,促进植物的生长[1,2]。菌根能够增加植物营养特别是磷素的吸收,提高植物的抗逆性,是促进生态系统可持续发展的生物肥料[3,4]。
土壤立地条件是喀斯特植被恢复过程中重要的限制性因素[5]。根际微生态环境的养分状况直接制约着植物的生长。在喀斯特地区,石灰性土壤对磷有强烈的吸附和固定作用,使土壤中磷素往往以难溶态存在,有效性较低[6],进而制约植物生长。土壤生物学特性是目前喀斯特地区植被演替过程中研究的重点,该地区关于菌根的研究主要集中在菌根真菌资源调查,菌根种类鉴别等[7],对于VA菌根对群落根际土壤的影响研究相对较少。如何正确的认识和评价VA菌根的生物学效应,认识其对宿主植物产生影响的结果和机理,是喀斯特地区植被恢复过程中的重要问题。基于此,本研究拟围绕草本群落几种主要的植物 VA菌根侵染对根际土壤特性影响的结果和机理进行评述,以期为揭示VA菌根、宿主植物和根际土壤之间的关系提供理论依据。
1 材料与方法
1.1 试验地概况
研究区位于黔西南州,关岭县和贞丰县交接处的北盘江花江段花江峡谷腹地的关岭县板贵乡和贞丰县兴北镇。地理坐标是北纬25°39′03.1″,东经105°38′23.3″,海拔925 m。区内地表起伏较大、相对高差悬殊,最高海拔1473 m,最低海拔370 m,地面支裂破碎,石漠化严重,属典型的岩溶山区。气候类型主要为亚热带季风湿润气候,光热资源丰富,年均温18.4 ℃,年日照时数2500 h以上,全年降雨量1205 mm,季节分配极为不均,冬春旱及伏旱严重,地处温热河谷。草本群落的岩石裸露率40%以上。存在较大面积的土面,石沟等。有放牧干扰。
分布的主要植物有禾本科白茅(Imperata cylindrica(Linn.) Beauv.)、桑科地瓜藤(Caulis FiciTikouae)、菊科白苞蒿(Artemisia lactifloraWall.)、菊科紫茎泽兰(Eupatorium adenophorumSpreng.)、蝶形花科马棘(Indigofera pseudotinctoriaMats)、荩草(Arthraxon hispidus)、芒萁(Dicranopteris dichotoma)、猪毛蒿(Artemisia scoparia)、灰苞蒿(Artemisia.roxburghiana)等;木本植物主要有野桐(Mallotus tenuifolius)、青檀(Pteroceltis tatarinowii)、火棘(Pyracantha fortuneana)、构树(Broussonetia papyrifera)等。
1.2 土壤样品采集
1.2.1 土壤采集
在2009年5月植被生长旺盛多雨季节,在试验区草本群落阶段选择分布数量较多且占据生长优势的植物种:白茅、地瓜藤、白苞蒿、紫茎泽兰、马棘。每种植物选择5株进行土壤采样。先去除落叶层,然后用土壤刀从植株基部开始逐段、逐层挖去上层覆土,追踪根系的伸展方向,然后沿侧根找到须根部分,剪下分枝,轻轻抖动后落下的土壤为非根际土壤(标记为S),仍粘在根上的为根际土壤(标记为R),并将5株植物的土壤混合,用毛刷收集到土壤袋保存,供分析用。
1.2.2 根系样品采集
在采集土壤的同时每种植物选择5株作根系采样:选取不同部位一定量的细根,混合后作为该植物的根系样本。置于事先配置好的100 ml瓶装FAA固定液中(95%乙醇50 ml、40%甲醛5 ml、冰醋酸5 ml、蒸馏水35 ml),瓶上做好标记,然后将根系样品放置在冷藏箱内,此根系样品用于菌根侵染率测定。
1.3 样品处理
1.3.1 土壤样品分析
试验所取土壤属于黄棕壤。土壤指标测定[8]:pH测定:用pH计测定;有机质测定:重铬酸钾—硫酸(K2CrO4-H2SO4)氧化法;全氮测定:重铬酸钾容量法-释热法;速效氮测定:扩散法;速效钾测定:火焰光度计法;全磷测定:酸溶-钼锑抗比色法;有效磷测定:0.5 mol·L-1碳酸氢钠溶液浸提法;脲酶:以尿素为基质,比色测定释放的 NH3-N量(以NH3-N表示,单位mg·g-1,37 ℃,24 h);碱性磷酸酶:以磷酸苯二钠为基质,比色测定释放的酚质量分数(以酚质量分数表示,单位mg·g-1,37 ℃,24 h);过氧化氢酶:以H2O2为基质,用0.1 mol·L-1KMnO4滴定法;蔗糖酶:以蔗糖为基质,比色测定释放的葡萄糖质量分数(以葡萄糖质量分数表示,单位 mg·g-1,37 ℃,24 h);
VA菌根指标测定:VA菌根染色:采用曲利苯蓝染色法[9];真菌孢子收集与筛析:蔗糖湿筛倾析法,收集的过筛残留物置于培养皿中,于 XTS 30双目体视显微镜下计数;菌根真菌孢子(AMF)密度定义为1 kg干土所含孢子的多少[10]。
1.3.2 根系样品分析
从固定液中取出根系,选择粗细均匀的颜色较浅的幼根,剪成5 mm长的根段,对根样进行染色处理,每株植物选取200段,进行显微镜观测并统计侵染率。
侵染率(%)=VA菌根侵染的长度(mm)(或视野数)/检查根段的总长度(mm) (或总视野数)×100%。
1.4 数据处理
采用EXCEL及SPSS16.0对获得的数据进行分析处理。
2 结果与分析
2.1 植物根际土壤样品养分指标与菌根侵染的关系
AMF侵染宿主植物后会对植物根际微生态进行调节,影响根际土壤的性质。VA菌根侵染率和土壤AMF孢子密度是衡量植物VA菌根活力的常用指标[1]。对试验区内草本群落阶段的主要植物根际土壤的常见养分指标及 VA菌根侵染率与 AMF孢子密度进行测定,结果见表 1。结果表明:各项指标均表现出较强根际效应;草本群落的根际土壤呈弱碱性,根际土壤(R)pH值均低于草本非根际土壤(S);不同植物根际土壤的有效磷质量分数不同,但均高于非根际土,以白苞蒿值最高,R/S值达1.56;有机质、水解性氮质量分数亦表现出根际效应;不同植物的VA菌根侵染率与孢子密度不同。
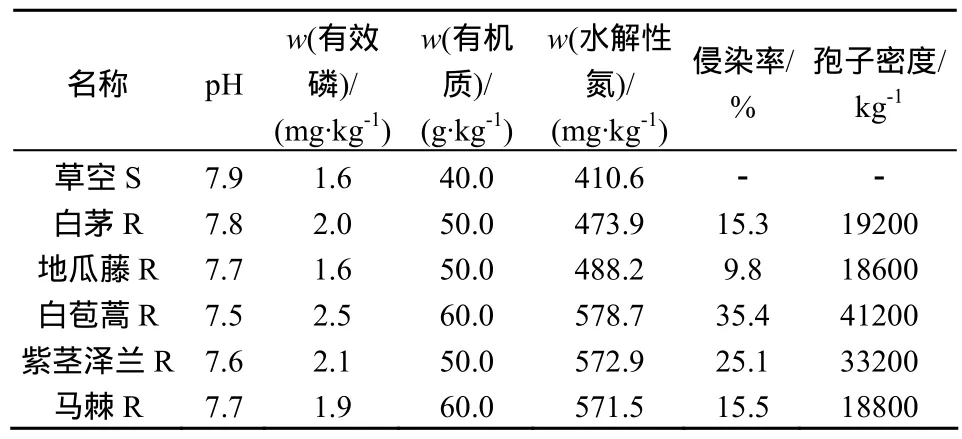
表1 土壤常见养分指标、菌根侵染率及孢子密度Table 1 Soil nutrients /mycorrhizal infection rate and the number of spores
对根际土壤各项因子和侵染率及孢子密度进行相关性分析,令pH为x1,有效磷为x2,有机质为x3,水解性氮为x4,侵染率为x5,孢子密度为x6,得到相关系数矩阵,结果见表 2。研究结果表明,pH值与其它各项因素均存在负相关,与AMF孢子密度存在极显著负相关,说明过高的pH对菌根真菌的孢子的形成有抑制作用,与菌根侵染率存在显著负相关,一方面说明较高的pH能够降低VA菌根的侵染率,另一方面,菌根真菌的感染能够降低土壤 pH,有利于微生物、土壤动物生长繁殖及酶活性,促进根际微生态植物的生长,这与众多研究一致[11-15];有效磷的质量分数与菌根侵染率存在极显著正相关,说明VA菌根能够活化土壤中难溶态的的磷,增加有效磷的质量分数,促进植物对磷素的吸收;VA菌根侵染率与有机质和水解性氮的质量分数也存在较高的相关系数。

表2 各因子相关系数矩阵Table 2 The factor correlation matrix
2.2 植物根际土壤酶活性与VA菌根侵染的关系
研究表明根际土壤是植物与土壤直接进行物质交换的最为活跃的场所,而根际土壤酶在物质交换过程中扮演着重要的角色[16-19]。土壤酶活性是土壤肥力高低的重要指标之一。磷酸酶的酶促作用是能加速有机磷循环速度,从而提高磷素有效性,是评价土壤中磷素生物转化方向和强度的指标;过氧化氢酶能促进过氧化氢的分解,有利于减少或者阻止过氧化氢对生物体的毒害作用,增加土壤的代谢能力,促进有机物的分解;脲酶能催化尿素水解成氨,可用来表征土壤中有机态氮的转化状况;蔗糖酶常用于评价土壤熟化程度和肥力水平,对增加土壤中易溶性营养物质起着重要的作用[16]。
对试验区内草本群落阶段的主要植物根际土壤的四种常见土壤酶活性进行分析(表 3)。结果表明:各种酶活性均表现出极强根际效应,不同植物各种酶活性存在差异;碱性磷酸酶的R/S值以白苞蒿最高,为1.77;各植物根际过氧化氢酶酶和脲酶活性差异不大,地瓜藤两酶活性均稍高;蔗糖酶活性以白苞蒿最高,R/S值为1.63,白茅最低,为1.31。
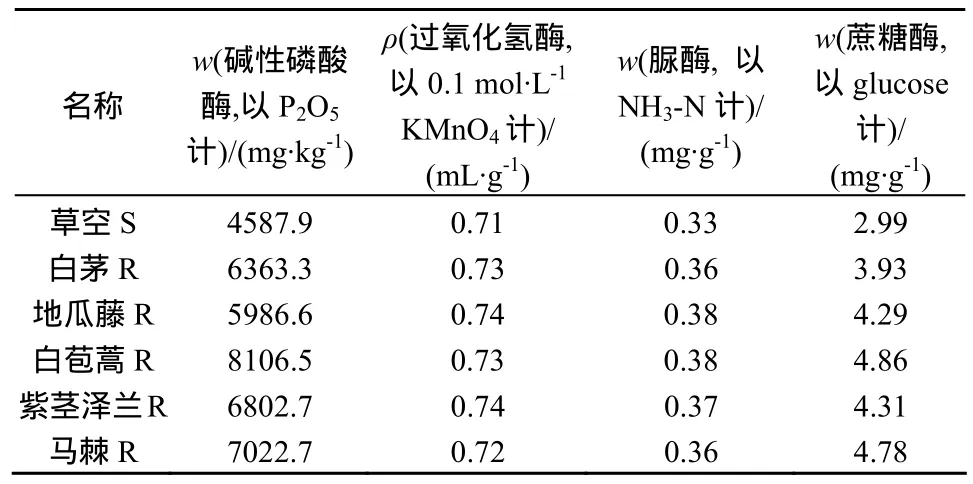
表3 土壤酶活性Table 3 The soil enzyme activity
对VA菌根侵染率和根际各土壤酶活性进行相关性分析,令碱性磷酸酶活性为x1,过氧化氢酶活性为x2,脲酶活性为x3,蔗糖酶活性为x4,侵染率为x5,孢子密度x6得到相关系数矩阵,结果见表 4。结果表明,碱性磷酸酶与菌根侵染率之间存在显著相关性,相关系数为0.90,说明AMF侵染宿主植物后,能够促进根际碱性磷酸酶活性的增加,这与多数研究结论一致[20,21];菌根侵染率与其它酶活性之间存在不显著相关。
3 讨论与结论
根际是植物与土壤物质和能量交换的场所,关系着植物的营养状况进而影响植物的生长。根际生境包括根系生长状况、根际土壤理化性质以及土壤生物学特性,如土壤酶活性、微生物的种类与数量等。植物不仅能够借助根系从土壤中吸收水分和矿物质营养,而且还会通过根系向外界环境释放分泌物。菌根共生对植物具有显著的促进作用,包括影响根际土壤微生物、动物、根系形态和生物酶的分泌等。目前的研究表明:一方面,AMF通过菌丝作用,将根际土壤围成空间网状,物质和能量流动加快,有利于根际土壤性状的改良[1,10];另一方面,菌根能够直接分泌生物酶等多种生物活性物质,促进根际养分元素的循环,对根际环境进行调节,同时根际有机质等质量分数的增加又能够促进根际微生物的生长繁殖,AMF的生长繁殖又能促进土壤酶的释放,进而改良根际土壤[21]。
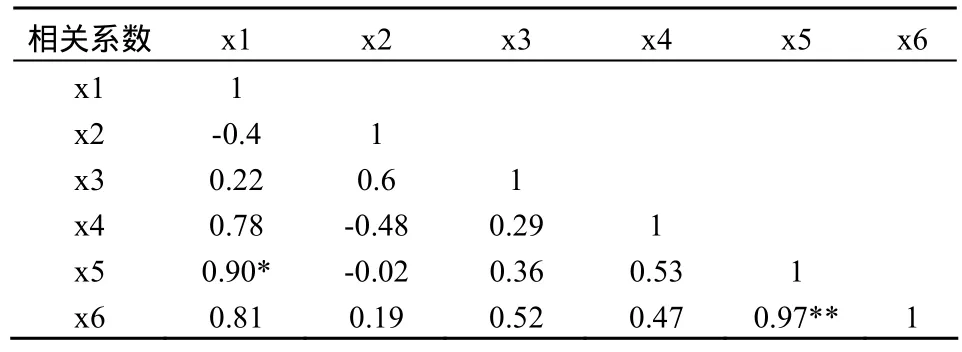
表4 土壤酶活性与菌根侵染相关性Table 4 The correlation between the soil enzyme activity and the mycorrhizal infection
根际微生态的作用是一个复杂的整体。在退化喀斯特地区草本群落阶段,不同植物自身的遗传多样性可能会对AMF种类和数量产生选择进而影响VA菌根的侵染。通过研究得到以下结论:
1)不同植物的菌根侵染率与孢子密度不同,侵染率与AMF孢子密度存在显著相关;
2)不同植物的根际常见化学指标和土壤酶活性均存在较强的根际效应,不同植物的R/S值不同;
3)pH值与菌根侵染间存在显著负相关,较高的pH对菌根侵染有抑制作用;菌根侵染率与有效磷质量分数存在极显著正相关,VA菌根能够有效促进磷素的活化;菌根侵染能够显著的增强碱性磷酸酶的活性,两者存在显著相关关系;菌根侵染能够改善多项根际土壤特征指标。
[1]弓明钦, 陈应龙, 仲崇禄.菌根研究及其应用[M].北京: 中国林业出版社, 1997: 1-10.GONG Mingqin, CHEN Yinglong, ZHONG Chonglu.Applying research of mycorrhiza[M].Beijing: China Foresrty Press, 1997: 1-10.
[2]赵方贵, 贺学礼.VA 菌根与磷素营养[J].西北农业学报, 1999, 8(5):106-108.ZHAO Fanggui, HE Xueli.Vesciualr-arbuscualr mycorrhzias and Palnt nutrition[J].Northwest China Journal of Agrciutlural Sceinces,1999, 8(5): 106-108.
[3]金樑, 赵洪, 李博.我国菌根研究进展及展望[J].应用与环境生物学报, 2004, 10(4): 515-520.JIN Liang, ZHAO Hong, LI Bo.Mycorrhizal studies in China[J].Chin J Appl Environ Biol, 2004, 10(4): 515-520.
[4]王素英, 陶光灿, 谢光辉, 等.我国微生物肥料的应用研究进展[J].中国农业大学学报, 2003, 8(1): 14-18.WANG Suying, TAO Guangcan, XIE Guanghui et al.A review of effects of biofertilizers on crop yield and quality[J].Journal of China Agricultural University, 2003, 8(1): 14-18.
[5]李明琴, 黄辛果, 来楷迪, 等.贵州喀斯特微地貌的成因及其对水土保持影响的研究[J].贵州大学学报: 自然科学版, 2008, 25(4):434-437.LI Mingqin, HUANG Xinguo, LAI Kaidi, et al.Geneses of Karst microland and maintain of water and soil in response to Karst microland[J].Journal of Guizhou University: NaturalSciences, 2008, 25(4):434-437.
[6]黄承玲, 陈训, 范成五.玉米根分泌物对喀斯特地区土壤吸附磷的影响[J].安徽农业科学, 2008, 36(26): 11453-11455.HUANG Chengling, CHEN Xun, FAN Chengwu.Effects of root exudates of maize on the adsorption of phosphorus in soil of Karst area[J].Journal of Anhui Agri Sci, 2008, 36(26): 11453-11455.
[7]王建锋, 谢世友, 许建平.丛枝菌根在石漠化生态恢复中的应用及前景分析[J].信阳师范学院学报: 自然科学版, 2009, 22(1):157-160.WANG Jianfeng, XIE Shiyou, XU Jianping.Application of arbuscular mycorrhizas in ecological restoration of rocky desertification and analysis of its foreground[J].Journal of Xinyang Normal University:Natural Science Edition, 2009, 22(1): 157-160.
[8]鲁如坤.土壤农业化学分析方法[M].北京: 中国农业科技出版社,2000: 212-255.LU Rukun.Chemical analysis of agricultural soil[M].Beijing: China Agricultural Science and Technology Publishing House, 2000:252-255.
[9]陈峥宏.微生物学实验教程[M].上海: 第二军医大学出版社, 2008:56-62.CHEN Zhenghong.Microbiological test tutorial[M].Shanghai: Second Military Medical University Press, 2008: 56-62.
[10]刘润进, 陈应龙.菌根学[M].北京: 科学出版社, 2007: 381-425.LIU RunJin, CHEN Yinglong.Mycorrhizal Science[M].Beijing: Science Press, 2007: 381-425.
[11]DIAMANTIDIS G, EFFOSSE A, POTIER P, et al, Purification and characterization of the first bacterial laccase in the rhizospheric bacterium Azospirillum lipoferum[J].Soil Biology & Biochemistry, 2000,32: 919-927.
[12]ZAK J C., WILLING M R, MOORHEAD D L, et al, Function diversity of microbial communities: A quantitative approach[J].Soil Biology &Biochemistry, 1994, 26: 1101-1108.
[13]王树和, 王晓娟, 王茜等.丛枝菌根及其宿主植物对根际微生物作用的响应[J].草业学报, 2007, 16(3): 108-113.WANG Shuhe, WANG Xiaojuan, WANG Qian, et al.Responses of rhizosphere microorganisms to Arbuscular mycorrhizal fungi and their effects on host plants[J].Acta Prataculturae Sinica, 2007, 16(3):108-113.
[14]梁军, 王媛, 焦一杰, 等.根际微生态调节对杨树根系活力及土壤有效P转化的效应[J].林业科学, 2009, 45(1): 102-106.LIANG Jun, WANG Yuan, JIAO Yijie, et al.Effects of rhizosphere microenvironment on the root vigor of poplars and trans formation of soil available P[J].Scientia Silvae Sinicae, 2009, 45(1): 102-106.
[15]TARAFDAR J C.Vsiual demonsrtaiton of in vivo acid phospha-tase activity of VA mycorrhizal fungi[J].Current Science, 1995, 69(6):541-543.
[16]周礼恺.土壤酶学[M].北京: 科学出版社, 1987, 116-267.ZHOU Likai.Soil enzymology[M].Beijing: Science Press, 1987,116-267.
[17]刘艳, 马风云, 宋玉民等.黄河三角洲冲积平原湿地土壤酶活性与养分相关性研究[J].水土保持研究, 2008, 15(1): 59-61.LIU Yan, MA Fengyun, SONG Yumin, et al.Correlative research on the activity of enzymeand soil nutrient of different wetlands in Yellow River Delta[J].Research of Soil and Water Conservation, 2008, 15(1):59-61.
[18]王灿, 王德建, 孙瑞娟等.长期不同施肥方式下土壤酶活性与肥力因素的相关性[J].生态环境, 2008, 17(2): 688-692.WANG Can, WANG Dejian, SUN Ruijuan, et al.The relationship between soil enzyme activities and soil nutrients by long-term fertilizer experiments[J].Ecology and Environment, 2008, 17(2): 688-692.
[19]周玮, 周运超, 田春.花江喀斯特地区花椒人工林的土壤酶演变[J].中国岩溶, 2008, 27(3): 240-245.ZHOU Wei, ZHOU Yunchao, TIAN Chun.Evolution of soil enzyme of Zanthoxylum Bungeanum woods in Huajiang Karst area [J].Carsologica Sinica, 2008, 27(3): 240-245.
[20]冀永生, 高辉, 顾泳洁, 等.不同生境条件下苦槠丛枝菌根对根际土壤磷酸酶活性的影响[J], 生态环境, 2008, 17(4): 1586-1589.JI Yongsheng, GAO Hui, GU Yongjie, et al.The impaction of the arbuscular mycorrhizae ofCastanopsis sclerophyllaon the phosphatase activity of Rhizosphere in different Habitats[J].Ecology and Environmental Sciences, 2008, 17(4): 1586-1589.
[21]田慧, 刘晓蕾, 盖京苹, 等.球囊霉素及其作用研究进展[J].土壤通报, 2009, 40(5): 1215-1220.TIAN Hui, LIU Xiaolei, GAI Jingping, et al.Review of glomalin-related soil protein and its function[J].Chinese Journal of Soil Science, 2009, 40(5): 1215-1220.
