丛枝菌根真菌对羊草凋落物降解作用的研究
2010-07-13李欢李晓林向丹
李欢,李晓林,向丹
1.中国农业大学资源与环境学院,北京 100193;2.中国科学院生态环境研究中心,北京 100085
凋落物作为草原碳库的重要组成部分,其分解的快慢直接影响到凋落物地表积累碳循环,也制约着氮磷等营养元素及其它物质向土壤的归还和土壤的养分有效性,是草原生态系统物质循环的重要环节[1]。影响凋落物分解和养分释放的因素主要包括植物凋落物质量和数量、分解者群落结构及特性、环境的物理和化学特性等。其中凋落物的质量是影响凋落物分解和养分释放的关键因素[2]。
丛枝菌根(AM)真菌是自然界中分布极其广泛、农业和生态意义十分重大的一类土壤真菌[3],它能与几乎所有的草原草本植物形成稳定的共生关系,是构成草原生态系统中一个重要组成部分。AM真菌能促进植物对养分吸收,改变植物体内养分的含量。如毕银丽等[4]发现接种菌根显著提高了白三叶草(Trifolium repensL)体内氮、磷的含量。另外,植物侵染菌根后,将更多的光合产物运往地下部,增加了碳向地下部的转移[5]。菌根对植物养分和碳含量的可能会影响到凋落物的干物质分解及养分释放过程。Langley和Hungate[6]研究也表明宿主植物凋落物的分解过程与是否侵染菌根有关。目前对菌根化与非菌根化植物凋落物降解特征的研究少有报道。
羊草是内蒙古草原优势植物,植物群落中优势种或多数种的凋落物分解对整个群落具有主导和支配作用[7]。接种菌根是否会影响草原植物凋落物的降解过程,对理解菌根在草原生态系统的物质能量循环中有重要意义。本试验以羊草(Leymus chinensis)为研究对象,采用根袋法研究接种对羊草地上部和根系凋落物的降解特征。
1 材料与方法
1.1 材料和处理
供试土壤:盆栽用土为内蒙古草原土,取自中国科学院内蒙古草原生态系统定位研究站,其地理坐 标 为 43°32′45″- 43°33′10″N , 116°40′30″-116°40′50″E,海拔约1 224 m。土壤类型为栗钙土,养分含量低,土壤风干后过2 mm筛。土壤pH值6.93(水土比,1:2.5,电位法),有机质4.04 g·kg-1(铬酸氧还滴定法),全氮0.398 g·kg-1(半微量开氏法),速效磷3.94 mg·kg-1(0.5 mol·L-1NaHCO3浸提—钼锑抗吸光光度法)。
供试材料:羊草(Leymus chinensis),又名碱草,属多年生根茎性禾草,具有发达的地下横走根茎。在我国北方草原地区羊草多为群落的优势种或速生种,是我国温带草原地带性植物的优势种,也是欧亚草原区东部草原的基本类型。
供试菌种:选用摩西球囊霉Glomus mosseae,简称G.m,BEG167;近明球囊Glomus claroidum,简称G.cBEG194。各菌种由中国农业大学资环学院菌根小组提供。原种以玉米和三叶草为宿主植物盆栽扩繁3个月后,用含有宿主植物根段、菌根真菌孢子及含有根外菌丝体的根际土壤作为接种剂。
试验设计:试验前土壤中各施入底肥NH4NO3100 mg·kg-1(以N计)、K2SO4100 mg·kg-1(以K计)、KH2PO420 mg·kg-1(以P计)。羊草每盆装基质1.2 kg,塑料盆规格是12 cm × 12 cm,接种处理每盆加入接种剂 100 g,不接种处理每盆加经过灭菌处理的接种剂100 g和不灭菌接种剂的滤液20 mL,以保证土壤微生物区系的一致性。将羊草种子在φ=10% H2O2中浸泡10 min进行表面消毒后,置于湿润的滤纸上催芽。发芽后,每盆播20粒,出苗3周后间苗留5株,生长120 d后收获。收获后取不同处理的羊草凋落物为试验材料。取样完毕后将地上和根系分别带回实验室,将根系用清水充分漂洗干净并同叶片一并在 60 ℃下鼓风烘干至恒重。将烘干好的叶片和根系粉碎过筛,使其粒径在 0.5~2 mm之间。分别装入5 cm × 5 cm的凋落物袋(尼龙网材料,孔径为100目)中,凋落物袋三边封口一边开口,装上凋落物后封口。埋入长宽高为10 cm ×10 cm × 8 cm的塑料方盆里,地上部埋深3 cm,每袋1.50 g;根系埋深5 cm,每袋0.70 g。调节盆体中土壤质量含水量约为10%左右,放入25 ℃恒温培养箱中,每隔3~5 d用天平调节水分恒定。试验处理包括接种Glomus mosseae和Glomus claroideum及不接种菌根的羊草凋落物,每个处理3次重复,在第4、7、14、21、28、35和56 d时取地上部样,根系在第4、7、35 d时分3次取样(根系样品较少所以减少了取样次数),测定凋落物分解速率及养分含量变化。
1.2 项目测定和方法
试验结束后将根袋剪开,小心将剩余的凋落物转移到称量纸上称重,使用千分之一天平测量,精确到小数点后3位。植物样品磨碎过0.25 mm筛后用硫酸-双氧水消煮,测定C、N、P成分。C浓度用重铬酸钾和硫酸(K2Cr2O7-H2SO4)氧化法测定;N浓度用半微量凯氏定氮法测定;P浓度用矾钼黄比色法测定[8]。
1.3 数据分析
分解速率采用指数模型计算:
Xt/X0=Bexp(-kt).
其中,B为常数,Xt为凋落物在t时刻的质量,X0为初始质量,k为分解速率,t为分解时间[9]。采用SAS10.0中进行方差分析。
2 结果与分析
2.1 羊草凋落物质量变化
在56 d的培养过程中,地上部和根系凋落物的重量逐渐降低(P<0.01)。羊草凋落物的降解分为两个阶段,一个快速分解阶段和一个较慢分解阶段。凋落物地上部质量的损失率在前4天里较高,达到25.6%~28.3%,随后分解减慢;根系的质量也呈现相同的趋势,在前4 d的损失率达到15.1%~18.4%。接种对地上部凋落物质量的影响未达显著水平(P>0.05),但显著影响根系凋落物的分解速率(P<0.01)。在各个取样时期,接种与不接种羊草地上部凋落物质量变化差异不显著。不接种和接种Glomus mosseae和Glomus claroideum凋落物降解率分别为36.3%,36.9%和37.1%。与地上部不同,各个取样点不接种处理羊草根系质量剩余量均低于接种处理,依次为CK>接种Glomus mosseae>接种Glomus claroideum。CK处理根系的剩余质量为 56.7%,Glomus mosseae和Glomus claroideum则分别为64.1%和 60.1%(图 1)。说明接种降低了羊草根系的分解速度。
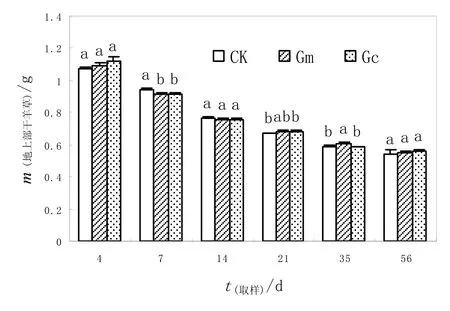
图1 接种和不接种羊草地上部凋落物干质量变化Fig.1 Temporal changes of dry weights of shoot litters of mycorrhizal and non-mycorrhizal Leymus chinensis

图2 接种和不接种羊草根系凋落物干质量变化Fig.2 Temporal changes of dry weights of root litters of mycorrhizal and non-mycorrhizal Leymus chinensis
接种未显著影响地上部凋落物降解系数k值(P>0.05,),但显著影响根系凋落物的降解系数(P<0.05)。接种Glomus mosseae和Glomus claroideum羊草根系k值显著低于CK,且Glomus mosseae羊草k值显著低于接种Glomus claroideum羊草(表1)。
2.2 羊草凋落物N含量变化
在整个培养过程中,地上部和根系凋落物氮含量呈现相同的趋势,均表现为先迅速降低后逐渐升高。分解时间显著影响羊草地上部和根系 N含量(P<0.01)。接种和不接种处理羊草地上部N含量间的差异不显著,但接种和不接种处理根系含N量差异达到显著水平(P<0.01)(表 4)。在最初的 4 d中,各处理羊草地上部凋落物中N量急剧下降,这可能是由于土壤中有效N含量很低,微生物需要从凋落物中矿化 N素来满足自身代谢的需要;在第4~35 d时,凋落物中的N逐渐富集,在第35天时超过了凋落物初始N含量(图3A)。与地上部不同,在35 d培养过程中,接种根系N含量显著低于对照。在最初的4 d中,羊草根系N含量降低到最低点,之后在第4~35 d时出现N的富集,在第7 d时羊草凋落物根系含N量与初始N含量接近,第35天时超过了凋落物初始N含量。说明在本试验条件下,接种羊草根系凋落物N素供应效率显著低于不接种处理。

表1 接种和不接种处理羊草地上部和根系降解系数Table 1 The decay constant k of aboveground and belowground of Leymus chinensis litters

图3 接种和不接种羊草地上部(A)及根系(B)凋落物氮含量变化Fig.3 Temporal changes of N concentrations in shoots and root litters of Leymus chinensis
2.3 羊草凋落物P含量变化
在整个培养过程中,地上部和根系凋落物磷含量表现出先降低后逐渐升高的趋势。分解时间的长短对羊草地上部和根系均产生显著性影响(P<0.01)。接种和不接种处理羊草地上部P含量间的差异不显著,但接种和不接种处理根系含P量差异达到显著水平(P<0.01)(表4)。
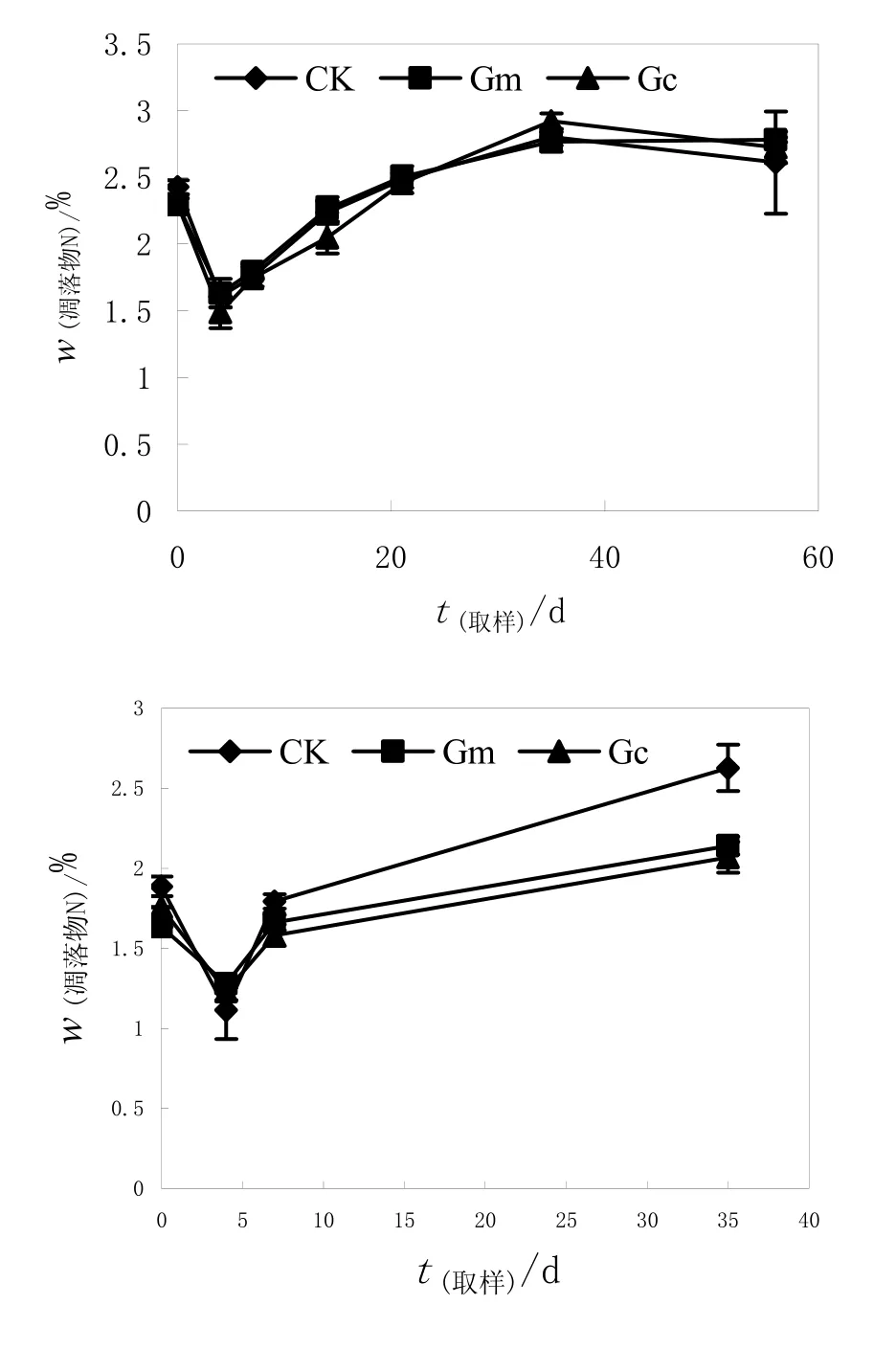
图4 接种和不接种羊草地上部(A)及根系(B)磷含量变化Fig.4 Changes of P concentrations in shoots and roots of Leymus chinensis litters over time
接种与不接种羊草地上部和根系含P量表现出相似的趋势。羊草地上部凋落物含P量在最初的4 d迅速降低,之后又开始回升,在第21 d时达到最高值,并一直持续到第35 d,之后羊草地上部含P量出现下降的趋势。在第7天时,对照处理羊草地上部凋落物含磷量显著高于接种处理,而在第21 d时接种Glomus mosseae羊草凋落物显著高于接种Glomus claroideum处理和CK处理。在其它取样时间对照和两个接种羊草处理地上部P含量间的差异未达显著水平。总体上,对照处理的含P量先急剧下降然后逐渐上升;而接种羊草凋落物含P量一直保持上升的趋势。

表2 接种和培养时间对羊草凋落物地上部和根系重量和NP含量变化的双因素分析Table 2 Significance level of effects of inoculation and time and interaction on variables based on Two-way ANOVA analyses

表3 接种和不接种羊草地上部和根系初始养分含量Table 3 Initial nutrient concentrations in shoots and roots of mycorrhizal and non-mycorrhizal Leymus chinensis litters
3 讨论
Whittaker等[10]对热带雨林、温带草地等 6类主要生态系统的分解过程进行了比较,报道了世界温带草地的年分解指数为 1.5。本研究在室内恒温恒湿度条件下进行,接种与不接种羊草地上部凋落物的分解指数为6.5左右,根系凋落物的分解指数为4.6~5.9之间,均高于世界温带草地分解速率的平均值。羊草凋落物地上部和根系N、P含量都表现出先急剧下降再逐渐上升的规律。Wedin[11]提出凋落物N有效性理论。植物C/N为30是一个临界值,凋落物高于这个值就会发生N的固定,低于它就会发生N的活化。3种处理的羊草凋落物初始养分含量(见表3),地下部的C/N高于30,因此出现N的固定和富集,且比值越大富集的程度越大。
养分含量的高低决定着凋落物的分解速率[12]。羊草地上部和根系干物质分解与养分释放与植物的初始养分含量和 C/N呈显著的正相关关系。Vivanco等[13]通过对美国北部和南部14种草原草的研究发现:植物内在的属性决定了凋落物的质量与降解速率,植物的养分含量与分解速率成正比。接种 AM 真菌未显著影响羊草地上部的初始养分含量,C/N差异不显著(表3),因此未影响地上部的降解与养分释放;相反,接种AM真菌显著降低了羊草根系的初始养分含量,C/N也发生了改变:接种Glomus mosseae>接种Glomus claroideum>不接种的碳/氮,因此降低了根系的降解与养分释放。
理论上认为,菌根真菌能够通过菌丝从基质中吸取 N素并转移给宿主植物[14]并且能从土壤中吸收磷,积累成多聚磷酸盐颗粒,并以该形式转移到丛枝和泡囊里[15],从而提高根系养分含量,进而促进根系凋落物的降解。本结果表明:接种菌根根系的降解速率显著低于不接种处理。一方面是由于:接种对羊草的冠根比产生变化,对照处理羊草的根冠比为2.88,接种Glomus claroideum为2.19,接种Glomus mosseae为2.50。表明AM真菌对羊草地上部和根系分配比例产生影响。接种后根系养分更多地运往地上部,使根系养分含量表现为接种处理低于对照。申鸿等[16]发现当土壤缺锌时,无论是锌浓度还是锌吸收量,根系中均表现为接种处理低于对照。另一方面,AM真菌促进养分吸收的同时也提高了根系的生物量,产生“生物稀释效应”[17]从而使根系养分含量表现为接种处理低于对照。
[1]李雪峰, 韩士杰, 张岩.降水量变化对蒙古栎落叶分解过程的间接影响[J].应用生态学报, 2007, 18 (2): 261-266.LI Xuefeng, HAN Shijie, ZHANG Yan.Indirect effects of precipitation on litter decomposition ofQuercus mongolica[J].Chinese Journal of Applied Ecoligy, 2007, 18 (2): 261-266.
[2]郭彦军, 龙瑞军, 张德罡, 等.利用体外产气法测定高山牧草和灌木的干物质降解率[J].草业学报, 2003, 12(3): 54-60.GUO Yanjun, LONG Ruijun, ZHANG Dezhi, et al.Determination of dry matter degradation of feeding shrubs and forages by gas production method[J].Acta Prataculturae Sinica, 2003, 12 (3): 54-60.
[3]王曙光, 林先贵, 施亚琴.丛枝菌根(AM)与植物的抗逆性[J].生态学杂志, 2001, 20 (3): 27-30.WANG Shuguang, LIN Xiangui, SHI Yaqin.Effects of arbuscular mycorrhiza on resistance of plants to environmental stress[J].Chinese Journal of Ecology, 20 (3): 27-30.
[4]毕银丽, 丁保健, 全文智, 等.VA菌根对白三叶吸收水分和养分的影响[J].草地学报, 2001, 9 (2): 154-158.BI Yinli, DING Baojian, QUAN Wenzhi, et al.Influence of VA mycorrhize on nutrient and water absorption inwhite clover[J].Acta Agrestia Sinica, 2001, 9 (2): 154-158.
[5]MILLER R M, MILLER S P, JASTROW J D.et al.External hyphal production of vesicular arbuscular mycorrhizal fungi in pasture and tall grass prairie communities[J].Oecologia, 1995, 103: 17-23.
[6]LANGLEY J A, HUNGATE B A.Mycorrhizal controls on belowground litter quality[J].Ecology 2003, 84, 2302-2312.
[7]CHEN J, STARK J M.Plant species effects and carbon nitrogen cycling in a sagebrush crusted wheatgrass soil[J].Soil Biology and Biochemistry, 2000, 32: 47-57.
[8]鲍士旦.土壤农化分析 [M].3版.北京:中国农业出版,2000:76-79.BAO Shidan.Soil Agriculturalization Analysis[M].3th edition.Beijing:China Agriculture Press, 2000: 76-79.
[9]OLSON J A.Energy storage and the balance of producers and decomposers in ecological systems[J].Ecology, 1963, 44(2): 322-332.
[10]WHITTAKER R H.Communities and ecosystems[M].New York :MacMillan, 1975.
[11]WEDIN D A.Nitrogen availability, plant–soil feedbacks and grassland stability[C]// ELDRIDGE D, FREUDENBERGER D, eds.Proceedings of the VI International Rangeland Congress on People and Rangelands Building the Future.Townsville, Australia, 1999: 193-197.
[12]SWIFT M J, HEAL O W, ANDERSON J M.Decomposition in terrestrial ecosystems[N].University of California Press, Berkeley, CA 1979.
[13]VIVANCO L, AUSTIN A T.Intrinsic effects of species on leaf litter and root decomposition: a comparison of temperate grasses from North and South America[J].Oecologia , 2006, 150: 97-107.
[14]ALLEN M F.The Ecology of Mycorrhizae[M].New York: Cam-bridge University Press, 1991: 1-8, 113-118.
[15]刘润进, 陈应龙.菌根学[M].北京: 科学出版社, 2007: 128-169.LIU Runjin, CHEN Yinglong.Mycorrhiza[M].Beijing: Science Press,2007: 128-169.
[16]申鸿, 陈保东, 冯固, 等.锌污染土壤接种丛枝菌根真菌对玉米苗期生长的影响[J].农业环境保护, 2002, 21(5): 399-402.SHEN Hong, CHEN Baodong, FENG Gu, et al.Influence of arbuscular mycorrhizal fungi on maize growth in a zinc polluted soil[J].Agro-environmental protection, 2002, 21 (5):399-402.
[17]LEYVAI C.Effect of heavy metal pollution on mycorrhizal colonization and function: physiological, ecological and applied aspects[J].Mycorrhiza, 1997, 7: 139-153.
