吡咯烷酮三溴氢化物在药物合成中的应用
2010-07-13彭惺蓉段宏泉
秦 楠,彭惺蓉,段宏泉
(天津医科大学药学院,基础医学研究中心,天津 300070)
α-溴代酮作为一种重要的药物合成中间体在有机合成化学和药物化学中有着广泛而重要的应用。在各类亲核反应当中,溴原子作为一个良好的离去基团,在碱性条件下碳溴键很容易被极化,从而提高了α碳的反应活性。因此,这类中间体常被用于构建碳-碳键和碳-氧键的形成[1-2]。本课题组前期研究发现,具有肉桂酰基的一类天然产物具有较好的降血糖活性[3]。在对其肉桂酰基片段进行改造的时候需要大量的α-溴代酮中间体。对于酮类化合物α-位溴代反应目前已报道了很多方法。常用的溴代方法有液溴/乙酸体系[4],该方法可以对含有碱敏感基团的化合物进行溴代;N-溴代丁二酰亚胺 (NBS)/四氯化碳体系则因其成本低廉易于操作而被广泛的应用[5]。使用这些常规的方法对这种具有共轭不饱和双键的酮类化合物进行α-位溴代反应时,因其发生加成反应而往往很难得到目标产物。Goud等[6]使用CuBr2在氯仿/乙酸乙酯作溶剂回流的条件下也可以实现α-位的溴代,但是反应条件相对剧烈且产率较低。Chih等[7]在进行天然产物的结构修饰中使用了吡咯烷酮三溴氢化物(pyrrolidone hydrotribrornide,PHT)对饱和酮类化合物α-位进行了溴代。本文在此文献的基础上使用吡咯烷酮三溴氢化物作为溴代试剂成功完成了具有共轭双键的不饱和酮类化合物的α-位溴代反应。另外,还以PHT和CuBr2为溴代试剂分别考察几种不同底物在不同溴代条件下的反应情况。
1 实验方法
1.1 主要试剂与仪器 Advance 2B/400核磁共振仪(Bruker公司,TMS为内标)。JEOL JMS-SX102A 质谱仪(日本电子)。85-2型恒温磁力搅拌器,SHZ-D(Ⅲ)循环水式真空泵,薄层层析硅胶,柱层析硅胶300-400目(青岛海洋化学公司)。4-羟基苯甲醛、苯甲醛、4-氯苯甲醛、4-三氟甲基苯甲醛、4-甲基苯甲醛、吡咯烷酮三溴氢化物购自百灵威化学技术有限公司;石油醚、乙酸乙酯、四氢呋喃、溴化铜购自天津基准化学试剂公司;所有试剂均为分析纯。
1.2 合成方法 称取中间体于干燥的100 ml茄型瓶中,室温下加入无水四氢呋喃。称取1.2当量的吡咯烷酮三溴氢化物溶于适量无水四氢呋喃中,在氮气保护的条件下,于1h内在室温下缓慢滴加到反应瓶中。滴毕后在氮气保护的条件下于室温搅拌24h。然后过滤除去白色不溶物,收集滤液。在减压状态下除去滤液中的四氢呋喃,浓缩物经硅胶柱层析后得纯品。
1.2.1 (E)-1-溴-4-苯基-3-烯-2-丁酮的合成 以4-苯基-3-烯-2-丁酮为原料,粗产物经硅胶柱层析,石油醚-乙酸乙酯(60∶1)洗脱,得淡黄色油状物,产率 76%。1H NMR(400 MHz,CDCl3)δ 7.72(d,1H,J=16.1Hz,β-CH=),7.63-7.58(m,2H,Ar-H),7.47-7.39(m,3H,Ar-H),6.97(d,J=1H,16.0Hz,α-CH=),4.11(s,2H,CH2-Br)。EI-MS,m/z:221(M+)。
1.2.2 (E)-1-溴-4-(4-氯苯基)-3-烯-2-丁酮的合成 以4-(4-氯苯基)-3-烯-2-丁酮为原料,粗产物经硅胶柱层析,石油醚-乙酸乙酯(20∶1)洗脱,得淡黄色油状物,产率73%。1H NMR(400 MHz,CDCl3)δ7.65(d,1H,J=16.1Hz,β-CH=),7.51(d,2H,J=8.0 Hz,H-3,5),7.38 (d,2H,J=8.0 Hz,H-2,6),6.92(d,1H,J=16.0 Hz,α-CH=),4.06(s,2H,CH2-Br)。EI-MS,m/z:259(M+)。
1.2.3 (E)-1-溴-4-(4-甲基苯基)-3-烯-2-丁酮的合成 以4-(4-甲基苯基)-3-烯-2-丁酮为原料,粗产物经硅胶柱层析,石油醚-乙酸乙酯(50∶1)洗脱,得淡黄色固体,产率71%。1H NMR(400 MHz,CD Cl3)δ 7.69(d,1H,J=16.0Hz,β-CH=),7.49(d,2H,J=8.1Hz,H-3,5),7.23(d,2H J=8.0Hz,H-2,6),6.91(d,1H,J=16.0 Hz,α-CH=),4.09 (s,2H,CH2-Br),2.40(s,3H,CH3-Ar)。EI-MS,m/z:239(M+)。
1.2.4 (E)-1-溴-4-(4-三氟甲基苯基)-3-烯-2-丁酮的合成 以4-(4-三氟甲基苯基)-3-烯-2-丁酮为原料,粗产物经硅胶柱层析,石油醚-乙酸乙酯(40∶1)洗脱,得淡黄色固体,产率72%。1H NMR(600 MHz,CDCl3)δ 7.72(d,1H,J=16.0 Hz,β-CH=),7.69(m,4H,Ar-H),7.04(d,1H,J=16.0Hz,α-CH=),4.10(s,2H,CH2-Br)。EI-MS,m/z:293(M+)。
1.2.5 (E)-1-溴-4-(4-羟基苯基)-3-烯-2-丁酮的合成 以4-(4-羟基苯基)-3-烯-2-丁酮为原料,粗产物经硅胶柱层析,石油醚-乙酸乙酯(5∶1)洗脱,得淡黄色固体,产率75%。1H NMR(400 MHz,DMSO-d6)δ 7.65 (d,1H,J=16.2Hz,β-CH=),7.58(d,2H,J=8.6Hz,H-3,5),6.84(d,2H,J=8.6Hz,H-2,6),6.78(d,1H,J=16.2Hz,α-CH=),4.46(s,2H,CH2-Br)。EI-MS,m/z:241(M+)。
1.2.6 (E)-1-溴-4-(4-苄氧基苯基)-3-烯-2-丁酮的合成 以4-(4-苄氧基苯基)-3-烯-2-丁酮为原料,粗产物经硅胶柱层析,石油醚-乙酸乙酯(15∶1)洗脱,得白色固体,产率73%。1H NMR(400 MHz,CDCl3)δ 7.68(d,1H,J=16.0 Hz,β-CH=),7.56(d,2H,J=8.7Hz,Ar-H),7.48-7.39(m,4H,Ar-H),7.36(d,1H,J=7.1Hz,Ar-H),7.06-6.98(m,2H,Ar-H),6.85(d,1H,J=15.9Hz,α-CH=),5.13(s,2H,Ar-CH2),4.08(s,2H,CH2-Br)。 EI-MS,m/z:331(M+)。
2 结果
本文分别以4-苯基-3-烯-2-丁酮为底物考察了几种溴代反应条件。结果发现,使用Br2/AcOH体系和NBS/DMSO体系均能得到新的产物。经1HNMR测试表明,没有得到所期望的α-溴代产物,而是获得了双键加成的产物。同时还尝试了NBS/CCl4体系,结果表明回流7 d并未发生反应。而使用PHT作为溴代试剂能够成功进行α-溴代反应。通过实验发现,在该反应中使用未经无水处理的四氢呋喃作为溶剂也能得到同样的产物,只是产率稍低。这说明PHT这种溴代试剂对反应体系中的水含量要求并不苛刻,市售分析纯四氢呋喃完全可以作为反应溶剂。另外,还尝试了CuBr2作为溴代试剂进行反应,结果发现虽然有目标产物的生成,但副产物较多,产率较低。随后,又分别考察了PHT和CuBr2这两种溴代试剂对不同底物的反应收率,具体结果见表1。
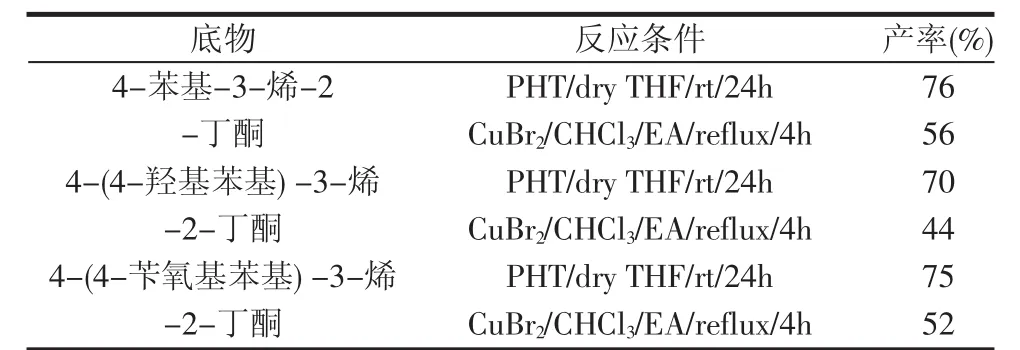
表1 PHT和CuBr2对不同底物进行溴代反应的收率比较
在反应过程中通过TLC对反应进行了监测,结果表明,使用CuBr2作为溴代试剂时,当温度达到55℃的时候即有少量产物生成,随着反应时间的延长,伴随产物不断生成的同时则产生了更多的副产物。当底物完全反应后,往往还会产生4种以上的副产物,这给后续的纯化工作带来了一定的难度,因此产率也不高。
3 讨论
在大多数情况下,羰基α-氢原子被卤素取代的反应属于卤素的亲电取代历程。对于酸催化的机制中,决定反应速率的步骤往往是烯醇式中间体的形成,而在烯醇形成的过程中加入少量碱有助于氢质子的离去。不饱和酮在形成中间体的时候,同时具有烯醇结构和双键结构。虽然烯醇的活性比双键的活性大,但是,烯醇的卤素取代反应是可逆的,尤其是在溴化氢作用下易还原成原来的酮,或发生烯丙位双键的移位等。与此同时,卤素却能与双键慢慢发生不可逆的加成。因此,如果实现酮的选择性取代,一方面必须将卤素浓度降低到卤代所需的水平,使其不能与双键发生反应;另一方面还需设法加入某些物质以中和生成的卤化氢,但还不能影响酮的烯醇化[8]。因此推测吡咯烷酮三溴氢化物的可能作用机制为:
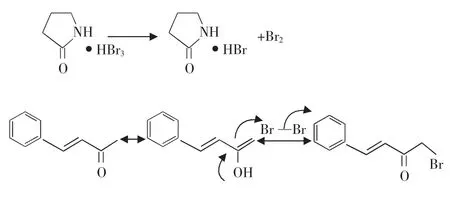
吡咯烷酮三溴氢化物可以缓慢的释放溴,使得反应体系中的溴浓度维持在一个较低的水平。同时,吡咯烷酮作为弱碱可以中和反应中产生的溴化氢,促进烯醇式中间体的形成,抑制双键加成的副反应。
本文以吡咯烷酮三溴氢化物为溴代试剂成功实现了具有4-苯基-3-烯-2-丁酮结构的化合物α-位溴代反应,并对其可能的作用机制进行了初步的分析。同时比较了CuBr2为溴代试剂的反应体系。通过实验发现,以CuBr2为溴代试剂的反应产物较为复杂,不易纯化,且产率较低。相比之下,以吡咯烷酮三溴氢化物为溴代试剂的反应条件温和,TLC显示只生成一个副产物,因此后续纯化工作简单易行,且产率较高。研究表明使用该方法进行溴代反应,方便可行,值得推广,适合工业化生产,有一定的应用开发价值。
[1]Kusama H,Yamabe H,Onizawa Y,et al.Rhenium(I)-catalyzed intramolecular geminal carbofunctionalization of alkynes:tandem cy clizationof-acetylenicdienolsilylethers[J].AngewChemIntEdEngl,2005,44(3):468
[2]Schmidt A,Snovydovycha B,Gjikaj M,et al.N-heterocyclic carbenes of indazole:ring enlargement reactions by α-halo ketones and dehalogenations of vicinal dihalides[J].Synthesis,2008,2008(17):2798
[3]赵川,乔卫,段宏泉,等.委陵菜抗糖尿病有效部位及有效成分的研究 [J].中国中药杂志,2008,33(6):185
[4]Vagdevi HM,VaidyaIndian VP,Latha KP,et al.Synthesis and pharmacological examination of some thiazolidinone derivatives of naphtho[2,1-b]furan[J].J Pharm Sci,2006,68(6):719
[5]Arbuj SS,Waghmocle SB,Romaswamy AV,et al.Photochemical αbromination of ketones using N-bromosuccinimide:a simple,mild and efficient method[J].Tetra Lett,2007,48(8):1411
[6]Goud PM,Sheri A,Desai PV,et al.Design,synthesis and evaluation of trisubstituted thiazoles targeting plasmodium falciparum cysteine proteases[J].Med Chem Res,2005,14(2):74
[7]Yun C,Tu J,Lednicer D.Total synthesis of 4-demethoxy-13-dihydro-8-nordaun-omycin[J].J Org Chem,1987,52(25):5624
[8]闻韧.药物合成反应[M].第2版.北京:化学化工出版社,2002:23-25
