罗格列酮对人脂肪组织瘦素及抵抗素分泌的影响
2010-07-04董莉妮屈晓冰
董莉妮 屈晓冰 徐 静
1 中南大学湘雅二医院老年病科(410011)
2 湖南省人民医院急诊科(410005)
研究证实,脂肪组织不仅仅是储存脂质的“仓库”,也是重要的内分泌器官。可分泌如瘦素(Leptin,LP)、脂联素(Adiponectin,APN)、抵抗素(Resistin)、胰岛素样生长因子(IGF-1)等多种生物活性物质[1,2]。罗格列酮(Rosiglitazone,RSG)为高度选择性过氧化物酶体增殖激活受体(peroxisone prolife activated receptor-γ,PPARγ)激动剂,有增加组织对胰岛素的敏感性、降低血糖、纠正血脂紊乱、抗炎、减少动脉内膜厚度等多种药理作用。为此,我们通过体外培养观察人体腹部皮下脂肪组织及内脏脂肪组织LP及Resistin的分泌情况,并用不同浓度罗格列酮作为干预因素作用于脂肪组织,了解其对脂肪组织LP及Resistin分泌的影响,旨在为研究与脂肪组织相关如胰岛素抵抗、肥胖和动脉粥样硬化等疾病的预防和治疗提供新的思路。
1 对象与方法
1.1 标本采集及分组培养
脂肪组织样本(n=90)来源于15例于2009年11月至2010年6月于泌尿外科行择期肾结石手术的男性住院患者,术前签署知情同意书。术中严格按无菌原则分别切取腹部皮下及肾脏周围脂肪组织,浸泡于装有DMEM/F12培养基的无菌培养皿中,试验分为干预组与对照组(生理盐水),每组均包括腹部皮下脂肪组和内脏脂肪组,干预组以不同浓度罗格列酮(10、50μmol/L)干预,分别培养6h。
1.2 LP及Resistin检测
用夹心酶联免疫吸附测定法(Enzyme Linked-Immuno Sorbent Assay,ELISA),试剂盒(人Leptin试剂盒、人Resistin试剂盒)购买于深圳晶美生物制剂公司。
1.3 统计方法
统计学处理使用SPSS13.0统计软件包进行分析。各计量资料以均数±标准差(±s)表示,计量资料的组间比较采用独立样本t检验。多个样本间比较采用Oneway ANOVA 检验,LSD方法进行。以α=0.05为检验水准(双侧)。
2 结 果
2.1 基础状态脂肪组织LP及Resistin分泌的情况
基础状态下,体外培养6h后,腹部皮下脂肪组织LP分泌浓度为(80.27±7.47)pg/g组织,明显高于内脏脂肪组织(59.16±3.59pg/g组织,P<0.05);内脏脂肪组织Resistin分泌浓度为(85.50±6.13)pg/g组织,明显高于腹部皮下脂肪组织(53.92±4.91 pg/g组织,P<0.05)。结果见表1。

表1 基础状态下人腹部皮下和内脏脂肪组织分泌LP及Resistin的水平
2.2 不同浓度罗格列酮干预对人脂肪组织LP及Resistin分泌的影响
体外培养6h后,罗格列酮低浓度干预组腹部皮下及内脏脂肪组织分泌LP浓度各为(61.08±5.06)和(43.21±3.45)pg/g组织,Resistin浓度各为(35.97±8.32)和(60.65±4.35)pg/g组织,分别较对照组的降低(P<0.05);罗格列酮高浓度干预组腹部皮下及内脏脂肪组织分泌LP浓度为(52.39±3.57)和(37.56±2.30)pg/g组织,Resistin浓度为(19.58±9.62)和(26.84±1.92)pg/g组织,分别较对照组及低浓度干预组的明显降低(P<0.05)。结果见表2。
3 讨 论
3.1 脂肪组织LP及Resistin分泌的特征
本实验观察到腹部皮下脂肪组织LP的分泌活性高于内脏脂肪组织,与Fain等[3]及Wajchenberg[4]研究结果相符。有研究表明,皮下脂肪组织LP的mRNA 表达水平明显高于大网膜脂肪组织,是LP的最主要来源。另外,本实验还观察到内脏脂肪组织分泌Resistin活性高于皮下脂肪组织。Banerjee等[5]指出内脏脂肪组织分泌Resistin水平为皮下脂肪组织的4~5倍。不同部位脂肪组织分泌LP及Resistin的活性存在差异,原因尚不十分明确,推测与不同脂肪库之间功能上的异质性有关。经研究证实,LP的分泌与脂肪细胞的数量及大小呈正相关,而皮下脂肪细胞体积比网膜脂肪细胞大50%左右。此外,皮下及内脏脂肪组织之间仍存在代谢方面的差异,可能对其分泌活性产生影响。内脏脂肪组织与皮下脂肪组织相比,对胰岛素不敏感,糖利用率较低。不同部位脂肪组织分泌功能差异性,提示脂肪组织可能不单单是一个内分泌器官,而是一组相似但各有特征的内分泌器官,可更好的解释代谢综合征的发病机制。
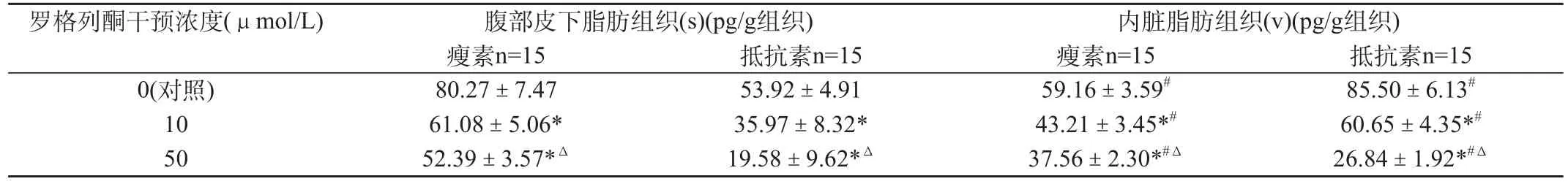
表2 不同浓度罗格列酮干预对人脂肪组织LP及Resistin分泌的影响
3.2 罗格列酮对脂肪组织分泌LP及Resistin的影响
罗格列酮为高度选择性PPARγ激动剂,具有增加组织对胰岛素的敏感性,改善β细胞产生胰岛素的能力,纠正血脂紊乱、抗炎、减少动脉内膜厚度等多种作用。本实验结果显示以罗格列酮干预腹部皮下和内脏脂肪组织后,脂肪组织LP及Resistin的分泌水平均降低,且呈明显的剂量-效应关系。郭晓珍等[6]研究发现,罗格列酮可降低2型糖尿病患者血浆LP水平,另有学者证实罗格列酮可降低胰岛素抵抗大鼠抵抗素的血浆水平及其表达。
罗格列酮降低脂肪组织LP及Resistin的分泌水平,机制尚不完全明确,可能的机制有以下几个方面:①通过激活PPARγ来调节脂肪组织分化及蛋白基因表达。PPARγ被誉为脂肪细胞分化和分泌蛋白基因表达的内在调定点。Wiesenberg等在体外实验中证实,罗格列酮BRL249653能够诱导PPARγ介导的基因激活。Rieusset进行的体外试验发现罗格列酮激活 PPARγ后,增强p85磷脂酰肌醇 3-激酶(p85alphaPI-3K)水平,并降低LP的表达,而p85alphaPI-3K是胰岛素的主要组成部分之一。Resistin基因表达的正调控机制是由于C/EBPa激活p300和CBP,提高了抵抗素启动子的组蛋白乙酰化。罗格列酮在成熟脂肪细胞内减少组蛋白乙酰化和C/ EBPα的结合[7]。②罗格列酮的抗炎作用。研究发现炎症状态下LP及Resistin水平明显增高,由此,我们可推测罗格列酮通过其抗炎作用能降低LP、Resistin水平。③脂肪源性细胞因子分泌的相互调节。Bruun等发现TNF-α等能通过旁分泌或自分泌的方式增强LP及Resistin基因启动子的活性从而提高脂肪细胞LP及Resistin分泌,而罗格列酮已证实可降低TNF-α水平。
由此可见,罗格列酮可降低脂肪组织LP及Resistin的分泌,而后二者又与代谢综合征及动脉粥样硬化性疾病密切相关,由此可推测罗格列酮可通过此途径起到改善胰岛素抵抗和动脉粥样硬化的作用,具有降糖以外的更广泛的临床应用价值。
[1] Laza MA.How obesity causes diabetes:not a tall tale[J].Science,2005,307(5708):373-375.
[2] Hutley L,Prins JB.Fat as endocrine organ: relationship to the metabolic syndrome[J].Am J Med Sci,2005,330 (6) : 280-289.
[3] Fain JN,Madan AK,Hiler ML,et al.Comparison of the release of adipokines by adipose tissue,adipose tissue matrix,and adipocytes from visceral and subcutaneous abdominal adipose tissues of obese humans[J].Endocrinology,2004,145(5):2273-2282.
[4] Wajchenberg BL.Subcutaneous and visceral adipose tissue:their relation to the metabolic syndrome[J].Endocr Rev,2000,21(6):697-738.
[5] Banerjee RR,Lazar MA.Resistin: molecular history and prognosis[J].J Mol Med,2003,81(4):218-226.
[6] 郭晓珍,愈海燕.罗格列酮对2型糖尿病肥胖患者24例瘦素水平的影响[J].南通大学学报(医学版),2006,26(2):119-121.
[7] Hartman HB,Hu X,Tyler KX,et al.Mechanisms regulating adipocyte expression of resistin[J].J Biol Chem,2002,277(22):19754-19761.
