推荐一个设计性综合化学实验*
——己二酸的绿色合成
2010-07-02曹小华徐常龙张康华柳闽生陶春元
曹小华徐常龙张康华柳闽生陶春元
(1九江学院化学化工学院 江西九江332005;2南京晓庄学院化学系 江苏南京211171)
推荐一个设计性综合化学实验*
——己二酸的绿色合成
曹小华1徐常龙1张康华1柳闽生2*陶春元1
(1九江学院化学化工学院 江西九江332005;2南京晓庄学院化学系 江苏南京211171)
设计了一个综合实验——己二酸的绿色合成。分别用H3PW12O40·n H2O、H6P2W18O62·n H2O、H3PW6Mo6O40·n H2O催化H2O2氧化环己酮半微量合成己二酸,用红外光谱分析了催化剂和产物的结构。
己二酸(简称ADA)是一种重要的化工原料和合成中间体,主要用于合成尼龙-66(盐)、聚氨酯和增塑剂等[1]。在高校有机化学实验中,己二酸的合成是有典型性和代表性的实验之一。然而,现行实验教材中大多采用浓HNO3或KMnO4直接氧化法制备己二酸。这些方法都存在实验内容和形式单一,以及会产生一定程度的污染等不足[2],不利于提高学生综合能力。为适应实验课教学改革要求,特别是适应绿色化学[3]和素质教育发展趋势,教师应不断设计出能激发学生创新潜能的创新实验。这样的新实验应该是前沿性与基础性、新颖性以及易操作性相结合,且难度适中。
杂多酸(简称HPA)是一类性能优异的环境友好催化新材料,具有催化活性高、选择性好、反应条件温和等优点,可作为酸性、氧化性或双功能催化剂[4]。作为绿色化学工艺,HPC催化H2O2氧化合成有机化合物已经成为当前催化研究热点[4],已有用于本反应的成功尝试[5]。
基于以上情况,本文结合作者科研工作开发了设计性综合实验——己二酸的绿色合成,使有机合成实验系列化、综合化,既巩固了理论知识和实验操作技能,又提高了学生实验的兴趣,同时还有利于让学生了解科研的有关过程。
1 实验目的及实验前的准备
1.1 实验目的
(1)掌握氧化反应的一般操作方法、产物分离及分析方法;(2)了解绿色化学及杂多酸的概念,掌握几种典型杂多酸的制备和表征方法;(3)锻炼学生查阅文献资料、设计实验及写作论文的能力;(4)培养综合分析问题和解决问题的能力。
1.2 实验前准备
在开始本实验前,要求学生做好以下准备工作:(1)检索国内外有关己二酸的合成文献,了解研究现状和基本操作方法。(2)查阅有关杂多酸制备、表征及应用等相关内容的资料,做好记录。(3)根据以上文献知识,综合已学的理论知识,设计绿色合成己二酸的实验步骤。
2 实验试剂及仪器
(1)试剂:环己酮、钨酸钠、磷酸、钼酸铵、磷酸二氢钠、30.0%(质量分数)H2O2、草酸、氢氧化钠、酚酞等。
(2)仪器:半微量实验仪器,JJ-1型增力电动搅拌器,SXHW型电热套,MAGN-550型IR仪,X-4A型显微熔点测定仪(控温型),电子天平,温度计等。
3 实验内容
3.1 实验方案设计
按表1优化设计实验方案。

表1 己二酸绿色合成实验优化实验方案设计
3.2 催化剂的制备
为比较不同结构 HPA的催化性能,本实验制备 Keggin结构的H3PW12O40·n H2O和H3PW6Mo6O40·n H2O以及Dawson结构的H6P2W18O62·n H2O 3种不同催化剂。
3.2.1 H3PW12O40·n H2O的制备[8]
将5.0g Na2WO4·2H2O、0.8g Na2HPO4溶解于20mL热水(60~70℃)中,继续加热,同时边搅拌边用移液管加5mL浓HCl,继续加热30s,此刻溶液呈淡黄色,冷却至40℃。将此溶液转移到分液漏斗中,待溶液降至室温后,向分液漏斗中先加入7mL乙醚,再加入2mL 6mol/L HCl,振荡15min,静止后分出下层油状物,放入蒸发皿中。水浴蒸除乙醚,直至液体表面有晶膜出现为止。冷却得到淡黄色H3PW12O40·n H2O晶体,真空干燥,收率约为88%。
3.2.2 H3PW6M o6O40·n H2O的制备[5]
将15.00g Na2WO4·2H2O、7.95g(NH4)6Mo7O24·4H2O和2.38g NaH2PO4溶解于66.7mL去离子水中,控制一定酸度,在80℃下搅拌反应3h后浓缩到27mL,加入33.5mL 24%HCl,转移到250mL分液漏斗中,用等体积的乙醚萃取。溶液分成3层,取最下层亮黄色油状杂多酸醚合物,80℃下水浴蒸除乙醚,真空干燥,即得H3PW6Mo6O40·n H2O,收率约为87%。
3.2.3 H6P2W18O62·n H2O的制备[5]
将15.00g Na2WO4·2H2O溶解于15mL热蒸馏水中,然后在强烈搅拌下加入12.5mL 85%浓H3PO4和3mL蒸馏水,加热回流5h,随时补加蒸馏水使体积保持在25 mL。为防止还原,可向浅黄色溶液中加入少量HNO3。将溶液蒸发至出现结皮,冷却至0℃并过滤出沉淀,将析出物溶于3mL水中并在室温进行重结晶,产品用乙醚萃取,在水中重结晶,抽滤、真空干燥得黄色结晶的H6P2W18O62·n H2O,收率约为80%。
3.3 己二酸的合成
向装有温度计和回流冷凝管的50mL三颈烧瓶中加入0.10g催化剂和25.0mL 30.0% H2O2溶液,室温下搅拌5min,然后加入5.0mL(4.9g,约50mmoL)环己酮,在100℃下回流反应3h。反应结束以后,将反应液置于冰箱中冷藏12h,使结晶完全,抽滤并以6mL蒸馏水洗涤2~3次,得到白色己二酸晶体。干燥后,称重并计算收率。
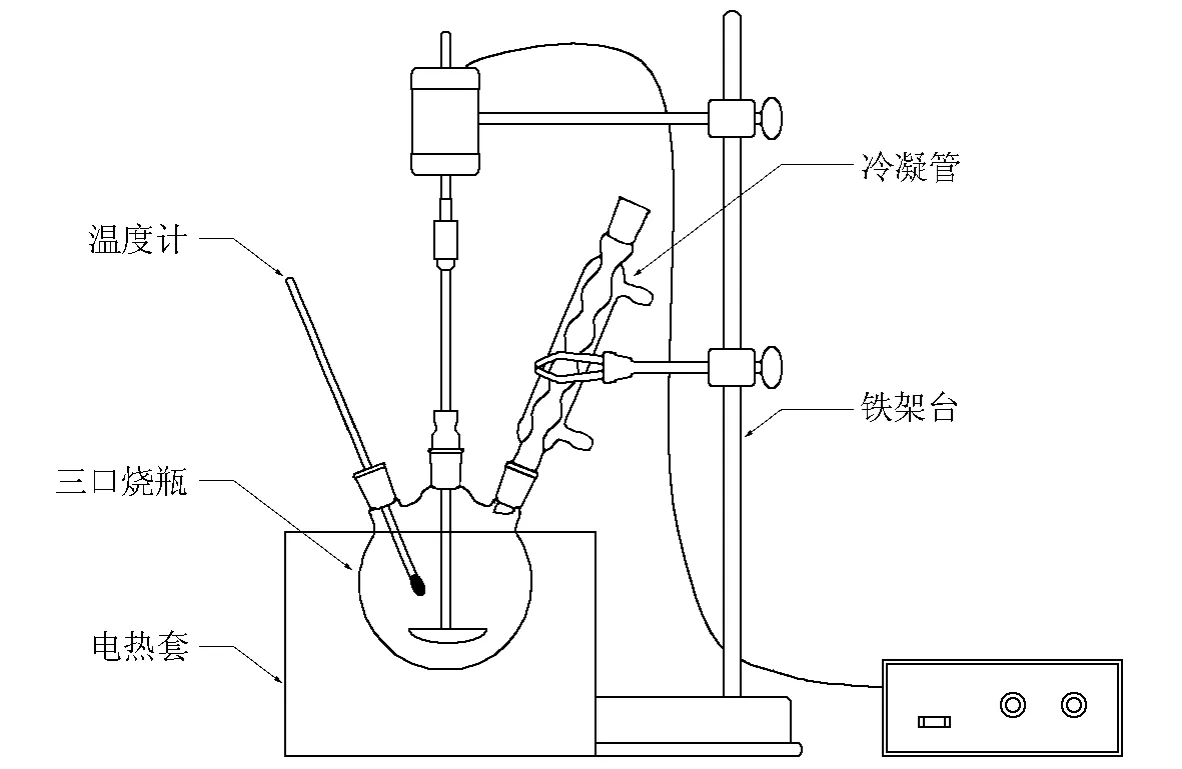
图1 反应装置示意图
如时间允许,可按以上实验步骤,进一步改变不同的实验条件,分别探讨催化剂用量、过氧化氢用量、反应时间和温度对己二酸产率的影响,探索最佳实验条件,并推测可能的反应机理。
3.4 己二酸产品纯度测定
将实验制得的产物用容量分析法进行纯度分析。具体做法是称取0.2g产物(准确至0.0001g),置于250mL锥形瓶中,加入50mL二次蒸馏水(除CO2),摇动使产物完全溶解,冷置室温,加入2滴酚酞指示剂,用0.1000mol/L的NaOH标准溶液滴定至微红色即为终点。己二酸的质量分数(w)按下式计算:

式中V为滴定所消耗NaOH标准溶液体积,单位mL。采用显微熔点测定仪(也可以用b型管法)测定熔点、通过IR测定产物的结构。
4 结果与讨论
4.1 催化剂的结构表征
合成催化剂经IR(KBr压片)表征,主要吸收峰数据(cm-1)为,H3PW12O40:1080(P—O)、991( =W O)、890(W—O—W)、810(W—O—W);H6P2W18O62·n H2O:1091.3(P—O)、962.1 ( =W O)、914.5(W—Ob—W)、782.0(W—Oc—W);H3PW6Mo6O40·n H2O:1074.1(P—O)、976.9( =M O)、878.3(M—Ob—M)、799.2(M—Oc—M)(M为W或Mo)。
4.2 实验效果比较分析
所选择的几种催化剂(H3PW12O40·n H2O、H3PW6Mo6O40·n H2O、H6P2W18O62·n H2O)在上述条件下表现出来的催化活性相差不大,ADA平均收率约为78%,与常量实验平均产率80%接近[5]。在A.I.Vogel的A Text-book of Practical Organic Chemistry书中,半微量固体化合物用量为0.1~1g,液体用量约为1~5g。与常量实验相比,半微量实验操作减少了药品用量,节约了能源,缩短了反应时间,减少了环境污染。但如进一步减少试剂用量,进行小量或微型实验,则己二酸的收率下降(<60%),实验效果不佳。
4.3 己二酸产品分析
实验结果表明多数条件下产物无须重结晶,纯度就可达99.0%以上;产物熔点在149~152℃(文献值151℃);产物IR(见图2,KBr压片)数据(cm-1)为:3000~2500(羧基上O—H的伸缩振动),1700( =C O的伸缩振动),930(羧基上C—OH的弯曲振动)与标准谱图一致。
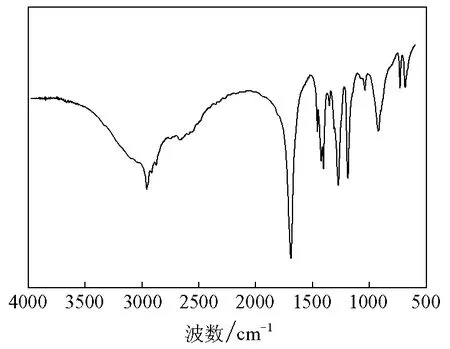
图2 己二酸的红外光谱图
5 时间安排
(1)第1次实验(6学时):将学生分为A、B、C 3组,分别制备下列催化剂的一种: H3PW6Mo6O40·n H2O、H3PW12O40·n H2O、H6P2W18O62·32H2O,并对催化剂进行IR表征。
(2)第2次实验(6学时):己二酸的制备(使用自制催化剂)、产品的分离和干燥。
(3)第3次实验(6学时):测定产品的纯度和熔点,测定产物的红外光谱。
(4)思考题(课外):要求每位学生在完成上述实验后,按科研论文格式提交实验小论文,内容包括:通过实验数据共享,比较己二酸各种合成方法的效果,指出实验中存在的问题及注意事项,推测可能的反应机理等。
6 总结
本实验涉及知识面广,需要综合利用无机化学、有机化学、分析化学和物理化学中的基础理论知识,有利于学生对四大化学的融会贯通。同时对常规实验进行了半微量改进,操作难度较大,对实验者实验技能要求较高。实验过程中应用到基础化学实验中的一系列基本操作方法,还要使用多种分析仪器,可以综合锻炼学生的实验技能。学生在查阅文献和设计实验过程中,必须具有一定的分析问题和解决问题的能力,有利于开阔学生视野,提高科研潜能。在实验教学过程中,教师要注意加强引导,实施开放式教学,给学生创建一个独立工作的环境。这种教学过程不但丰富了实验课内容,也为学生提供了广阔的思维空间,有利于激发学生的创新热情和培养学生的创新精神及绿色化学意识,培养学生独立工作能力,拓宽知识,缩短了学与用的距离。
[1] Sato K,AokiM,Noyori R.Science,1998,281:1646
[2] 宫红,杨中华,姜恒.大学化学,2003,18(2):53
[3] Anastas P T,Warner JC.Green Chemistry Theory and Practice.New York:Oxford University Press,1998
[4] Kozhevnikov IV.精细化学品的合成:多酸化合物及其催化.唐培,李祥高,王世荣,译.北京:化学工业出版社,2005
[5] 曹小华.钨催化剂的制备及在己二酸绿色合成等反应中应用.南昌大学硕士毕业论文,2007
[6] Scharder S,Dehmlow E V.Org Prep Proced Int,2000,32:123
[7] 陈长水,刘汉兰,关光日.微型有机化学实验.北京:化学工业出版社,1998
[8] 姚志强.分析实验室,1999,16(4):432
江西省教改课题(No.JXJG-08-17-44);九江学院教研课题(XJY09-20);九江学院青年教师建功立业项目
