对教材中摩尔气体常数测定实验原理误解的更正
2010-07-02林源为迟瑛楠
林源为 迟瑛楠
(北京理工大学理学院 北京100081)
对教材中摩尔气体常数测定实验原理误解的更正
林源为 迟瑛楠*
(北京理工大学理学院 北京100081)
摩尔气体常数的测定是高等院校无机化学课程中的一个重要实验。然而,现行实验教材对该实验的实验原理分析中却出现了两处误解,即没有正确理解实验中有关理想气体状态方程式和道尔顿分压定律的应用。本文对这两处误解进行了分析和解释。
摩尔气体常数(R)的测定是高等院校无机化学课程中的一个重要实验,在实验教学过程中普遍被采纳。本实验的目的是通过实验设计和操作,加深对理想气体状态方程和道尔顿分压定律的理解。
目前,实验教材都是采用置换法来测定摩尔气体常数R,即采用图1所示装置,使用定量的镁条与稀硫酸反应置换出氢气,通过测量反应前后量气筒内气体体积变化,结合理想气体状态方程和道尔顿分压定律,进而计算出R的数值。理想气体状态方程式和道尔顿分压定律为该实验原理的核心。虽然现行教材中最终运用正确的数据处理方法求出了R值,但是关于为何采用这样数据处理方法没有给出正确合理的解释[1-5]。我们认为现行实验教材在该实验原理理解方面出现了两处误解。由于此类错误隐蔽性很强,因而很难引起教学工作者的注意。
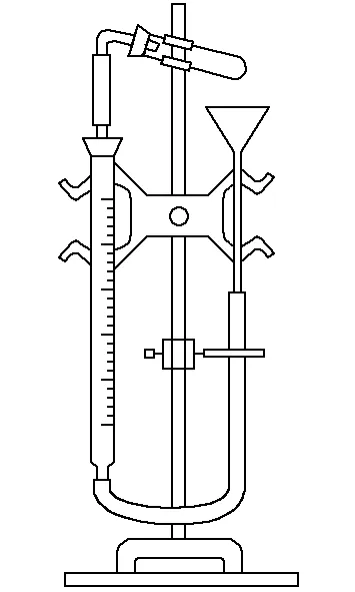
图1 摩尔气体常数测定装置
1 教材中对实验原理的大致叙述
在教材中,对于摩尔气体常数测定实验原理的描述大致如下[1-5]:
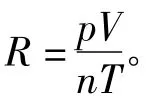
因此,对一定量的气体,若能在一定温度、压力下测出其体积,则可求出R值。即准确称取一定质量的镁条,与过量的稀硫酸作用,在一定温度T(可由温度计读出)和压力p(由气压计读出)下,用量气管前后读数之差测得被置换出来的氢气的体积,而氢气的物质的量可通过镁条的质量算出。但由于氢气是在水面上收集的,故混有水汽,若查得实验温度下水的饱和蒸气压,则根据分压定律,氢气的分压可由下式求得:
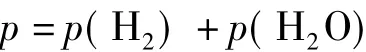
则
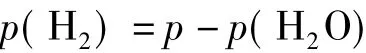
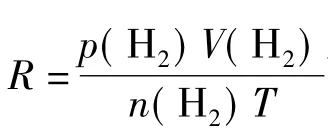
在以上关于实验原理的叙述中,出现了两处误解:一处是关于氢气产生前后量气管读数之差(V2-V1)所代表的意义;另一处是关于理想气体状态方程式在混合气体体系下的应用。
2 更正分析

图2 反应前后体积变化示意图
(1)先分析第一处误解。现行教材普遍认为发生置换反应前后量气管内的体积之差为生成的氢气体积。但事实上,前后体积之差并不完全是氢气的体积,而是氢气和水蒸气的总体积。这是由于水蒸气的特性造成的:当达到饱和蒸气压且有液态水存在时,水蒸气的体积会随着其存在空间的增大而增大。如图2所示,该图表示了置换反应发生前后量气管内气体体积的变化。具体到该实验,置换产生氢气的反应发生前,量气管的读数V1包括空气的体积 V(空气)与水蒸气的体积 V1(H2O),即V1=V(空气)+V1(H2O);而置换产生氢气的反应发生后,量气管的读数 V2为空气的体积 V(空气)、氢气的体积V(H2)、原有水蒸气的体积V1(H2O)、新增水蒸气的体积V2(H2O)的总和,即V2=V(空气)+V(H2)+V1(H2O)+ V2(H2O)。这样V2-V1=V(H2)+V2(H2O),而不是教材所理解的V2-V1=V(H2)。
(2)现行教材的第二处错误出现在对混合气体体系下的理想气体状态方程式的使用方面。教材中认为对于氢气和水蒸气的混合体系存在piVi=niRT,根据道尔顿分压定律应该有piV总=niRT或者p总Vi=niRT(其中下标i的物理量表示混合气体体系中i组分气体的对应物理量,下标为“总”的物理量表示整个混合气体体系所对应的物理量)[6-7]。我们可以对后两个公式的正确性作简单的推导,从而证明教材所理解的piVi=niRT是不成立的:
①piV总=niRT

②p总Vi=niRT
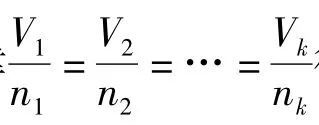

3 结论
笔者认为,在有关教材再版时应该更正这两处误解,用正确的实验原理来支持实验的数据处理和计算。即在实验原理中,作如下修正:①将V(H2)=V2-V1改为V总=V2-V1,并加以简单阐述;②对混合气体体系的理想气体状态方程式进行合理表述。
[1] 徐伟亮.基础化学实验.北京:科学出版社,2005
[2] 徐家宁,门瑞芝,张寒琦.基础化学实验(上册)无机化学和化学分析实验.北京:高等教育出版社,2006
[3] 中山大学,辽宁大学,北京大学,等.无机化学实验.第3版.北京:高等教育出版社,1992
[4] 大连理工大学无机化学教研室.无机化学实验.第2版.北京:高等教育出版社,2004
[5] 朱湛,傅引霞.无机化学实验.北京:北京理工大学出版社,2007
[6] 宋天佑,程鹏,王杏乔.无机化学(上册).北京:高等教育出版社,2004
[7] 彼得勒塞,哈伍德,赫林.普通化学原理与应用.第8版(影印版).北京:高等教育出版社,2004
* 通讯联系人,E-mail:cyn7887@yahoo.com.cn
