白蛋白联合低氧对NRK-52E细胞凋亡的影响
2010-06-20刘章锁梁献慧石新慧
王 沛,刘章锁,梁献慧,骆 红,马 瑨,石新慧
郑州大学第一附属医院肾内科;河南省高等学校临床医学重点学科开放实验室郑州450052
持续存在的白蛋白尿是慢性肾脏病(chronic kidney disease,CKD)进展到终末期肾衰竭的危险因素[1-2]。肾小球滤过的白蛋白几乎100%在肾小管重吸收并被分解而回到血液循环,这种重吸收过程会消耗大量的能量,而由于肾脏本身结构的因素,肾小管区域的氧分压又比较低,因此临床上低氧张力常同白蛋白过负荷同时存在[3]。另外,白蛋白诱导肾小管上皮细胞(tubular epithelial cell,TEC)凋亡是造成肾脏纤维化的起始因素[4-5]。白蛋白过负荷与低氧张力在促进肾脏纤维化方面是否存在某些联系尚未见报道。作者观察了白蛋白联合低氧刺激对TEC凋亡的影响,以探讨白蛋白促进肾脏损伤的机制,为临床干预提供实验依据。
1 材料与方法
1.1 试剂及仪器 去脂的小牛血清白蛋白(美国Sigma公司),AnnexinⅤ-FITC/PI凋亡检测试剂盒(南京凯基生物公司),Trizol(Invitrogen公司),bax和bcl-2 PCR扩增引物、DNA Marker、AMV逆转录试剂盒及PCR扩增试剂盒(上海生工生物工程技术服务有限公司),DMEM/F12 1∶1培养基(美国Hyclone公司),2.5 g/L胰蛋白酶(杭州吉诺生物公司)。CO2培养箱(德国Heraeus Instruments公司),MCO-18M Multigas Incubator(日本三洋公司),IX40型荧光显微镜(日本Olympus公司)。
1.2 细胞培养 大鼠肾小管上皮细胞(NRK-52E,由中山医科大学第一医院余学清教授惠赠)NRK-52E细胞用含体积分数为10%胎牛血清(FBS)的DMEM/F12 1∶1培养基培养,同时加入100 kU/L青霉素、100 U/mL链霉素,以2.5 g/L胰蛋白酶消化后置37℃、体积分数为5%CO2培养箱中培养,并按1∶3进行传代。传代后的细胞均匀接种,生长至亚融合状态时加人无血清培养基同步化12 h,随后使用第3~6代细胞进行实验。
1.3 NRK-52E细胞凋亡的 AnnexinⅤ-FITC/PI双染流式细胞技术检测 以不同质量浓度(0、10、20、30和40 g/L)白蛋白下常氧(含体积分数为5%CO2的空气)条件下孵育NRK-52E细胞24 h后,流式细胞技术检测的各组细胞的凋亡率,得到最适合白蛋白质量浓度;然后NRK-52E细胞在最适合白蛋白质量浓度和低氧(体积分数为1%O2、5%CO2和94%N2)联合条件下刺激24 h,同对设常氧对照组、低氧对照组和常氧+30 g/L白蛋白培养组。以2.5 g/L胰蛋白酶(不含EDTA)消化收集各处理组细胞,用冷 PBS液(pH=7.0)漂洗 2 次,用 200 μL 结合缓冲液重悬并调整成1×106mL-1的单细胞悬液。取100 μL细胞悬液,加入AnnexinⅤ-FITC和PI各5 μL,混匀后室温避光反应 10 min,再加入 300 μL Binding Buffer,1 h内上机检测细胞凋亡率。
1.4 NRK-52E细胞 bax和 bcl-2 mRNA表达的RT-PCR法检测 各组细胞分别加入1 mL Trizol,细胞悬液移入EP管,剧烈振荡,加入氯仿静置分层,取水相,异丙醇沉淀抽提总RNA。采用上海生工生物工程技术服务有限公司的AMV第一链cDNA合成试剂盒,取总RNA 5 μg,参照操作步骤反转录成cDNA,取1 μL作为模板进行PCR扩增,反应体系为 20 μL。bax上游引物 5’-ACCAAGAAGCT GAGCGAGTGTC-3’,下游引物 5’-ACAAAGATGGT CACTGTCTGCC-3’,扩增产物大小为365 bp。bcl-2上游引物 5’-CACCCCTGGCATCTTCTCCTTC-3’,下游引物 5’-CACAATCCTCCCCCAGTTCACC-3’,扩增产物大小为303 bp。内参 GAPDH上游引物5’-AATGCATCCTGCACCACCAA-3’,下游引物序列:5’-GTAGCCATATTCATTGTCATA-3’,扩增产物大小为516 bp。PCR反应条件:预变性94℃3 min;94℃变性45 s,退火温度bcl-2为67℃,bax为58℃,72℃延长45 s,共30个循环;反应结束前72℃ 5 min以充分延伸。取PCR产物10 μL经15 g/L琼脂糖凝胶电泳,紫外灯下观察,经凝胶扫描系统进行吸光度积分扫描,计算bcl-2和bax与内参照GAPDH灰度值的比值。实验重复3次。
1.5 统计学处理 采用SPSS 11.0进行统计分析,应用单因素方差分析比较不同质量浓度白蛋白对常氧条件下NRK52E细胞凋亡的影响以及不同处理组NRK-52E细胞凋亡率、bax mRNA和bcl-2 mRNA表达的差异,检验水准α=0.05。
2 结果
2.1 不同质量浓度白蛋白对常氧条件下NRK-52E细胞凋亡的影响 在常氧条件下,随着白蛋白质量浓度的增加(0、10、20、30 和40 g/L),NRK52E 细胞的凋亡率也逐渐增高[(5.23±3.24)%、(9.08±3.67)%、(15.70 ± 3.43)%、(25.59 ± 3.32)% 和(29.12 ±4.29)%],差异有统计学意义(F=55.748,P <0.001)。
2.2 不同处理组 NRK-52E细胞凋亡率、bax和bcl-2 mRNA表达的比较 见图1、表1。
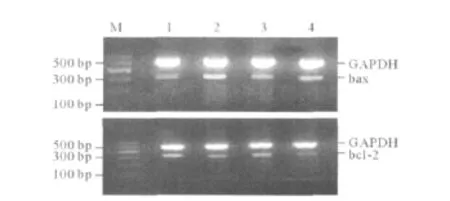
图1 不同处理组NRK-52E
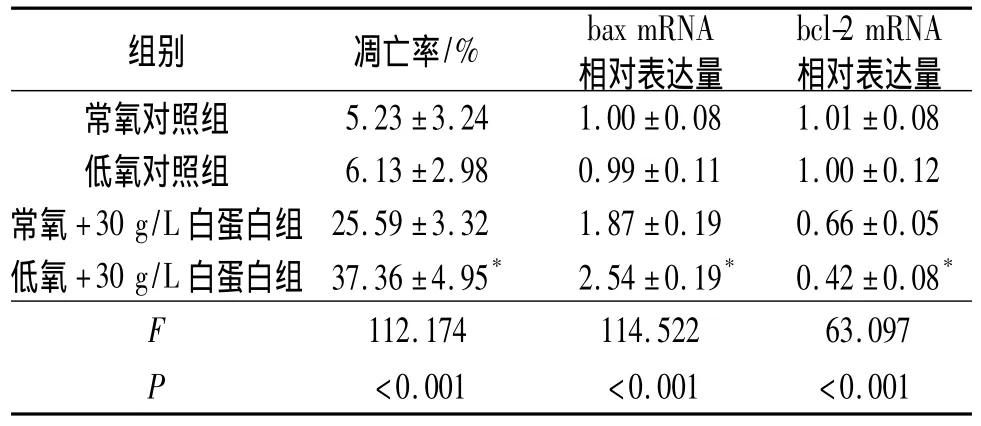
表1 不同处理组NRK-52E细胞凋亡率、bax和bcl-2 mRNA表达的比较(n=3)
3 讨论
Erkan等[6]用不同质量浓度的白蛋白培养肾小管上皮细胞LLC-PK1,发现LLC-PK1细胞在摄取白蛋白的同时出现了凋亡增加,并且凋亡的细胞与摄取白蛋白的细胞一致。Thomas等[7]应用白蛋白腹腔注射造成白蛋白过负荷大鼠模型,发现这些大鼠在出现大量蛋白尿的同时出现了TEC凋亡。作者的研究结果显示白蛋白可诱导NRK-52E凋亡,与上述文献报道相符。
Bcl家族凋亡蛋白在调控细胞凋亡中发挥重要作用[8-9]。有研究[10]认为低氧可促进 TEC 凋亡,其机制可能与低氧直接降低凋亡蛋白Bcl-2表达或Bcl-2/Bax比值有关,但另一些研究[11]认为低氧对细胞凋亡无直接影响。作者的研究结果显示低氧本身不增加大鼠TEC的凋亡,但可增强白蛋白诱导细胞凋亡的作用,其机制可能与进一步促进Bax高表达和Bcl-2低表达有关。
[1]Hemmelgarn BR,Manns BJ,Lloyd A,et al.Relation between kidney function,proteinuria,and adverse outcomes[J].JAMA,2010,303(5):423
[2]Pavkov ME,Knowler WC,Hanson RL,et al.Predictive power of sequential measures of albuminuria for progression to ESRD or death in Pima Indians with type 2 diabetes[J].Am J Kidney Dis,2008,51(5):759
[3]Heyman SN,Khamaisi M,Rosen S,et al.Renal parenchymal hypoxia,hypoxia response and the progression of chronic kidney disease[J].Am J Nephrol,2008,28(6):998
[4]Birn H,Christensen EI.Renal albumin absorption in physiology and pathology[J].Kidney Int,2006,69(3):440
[5]Ohse T,Inagi R,Tanaka T,et al.Albumin induces endoplasmic reticulum stress and apoptosis in renal proximal tubular cells[J].Kidney Int,2006,70(8):1 447
[6]Erkan E,Devarajan P,Schwartz GJ.Mitochondria are the major targets in albumin-induced apoptosis in proximal tubule cells[J].J Am Soc Nephrol,2007,18(4):1 199
[7]Thomas ME,Brunskill NJ,Harris KPG,et al.Proteinuria induces tubular cell turnover:a potential mechanism for tubular atrophy[J].Kidney Int,1999,55(33):890
[8]杨国杰,李运伟,曾秋棠,等.缺血后处理对兔缺血再灌注心肌细胞凋亡及Bcl-2和Bax蛋白表达的影响[J].郑州大学学报:医学版,2008,43(1):57
[9]汲振余,赵立群,张聚真,等.食管早期癌和癌前病变组织中HIF-1α、Bax和Survivin的表达对光动力学疗效的影响[J].郑州大学学报:医学版,2008,43(2):205
[10]Yamamoto K,Tomita N,Yoshimura S,et al.Hypoxia-induced renal epithelial cell death through caspase-dependent pathway:role of Bcl-2,Bcl-xL and Bax in tubular injury[J].Int J Mol Med,2004,14(4):633
[11]Box AH,Yuen C,Ponjevic D,et al.Signaling and apoptosis differences between severe hypoxia and desferoxamine treatment of human epithelial cells[J].Biochem Cell Biol,2008,86(5):425
