自分泌运动因子对EC9706、Eca109及EC-1细胞丝切蛋白磷酸化的影响*
2010-06-20陆玉成闫红霞王莉莉薛乐勋
陆玉成,闫红霞,王莉莉,薛乐勋
郑州大学生物系细胞生物学研究室郑州450001
1986年Liotta等[1]从人黑色素瘤细胞株A2058血清培养基中分离、纯化出一种由肿瘤细胞产生和分泌的细胞因子,该细胞因子能刺激细胞的迁移和运动,故被命名为自分泌运动因子(autocrine motility factor,AMF)。已有研究[2-3]发现,AMF 与许多实体瘤细胞的侵袭和转移密切相关。磷酸化丝切蛋白是普遍存在于真核细胞的一种肌动蛋白结合蛋白,参与调节肌动蛋白骨架的重组,从而影响细胞运动能力。作者克隆人食管鳞状细胞癌细胞AMF基因,构建真核表达载体并转染食管鳞状细胞癌细胞,观察转染细胞磷酸化丝切蛋白的表达情况,探讨AMF的表达与丝切蛋白磷酸化之间的关系。
1 材料与方法
1.1 材料 食管鳞状细胞癌细胞株EC9706由中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室惠赠,Eca109和EC-1由郑州大学生物系细胞生物学研究室保存。pEGFP-C1和pcDNA 3.1(+)购自大连宝生物工程公司,PCR引物由上海生工生物工程有限公司合成,RPMI 1640培养基、胎牛血清和胰蛋白酶购自美国Hyclone公司,丝切蛋白抗体购自美国Santa Cruz公司,抗His的单克隆抗体购自Sigma公司,β-actin多克隆抗体购自美国Santa Cruz公司,Trizol试剂及 LipofectamineTM2000购自美国Invitrogen公司。
1.2 真核表达载体 pEGFP-C1-AMF及 pcDNA 3.1(+)-AMF 的构建
1.2.1 AMF基因的扩增 根据GenBank登录序列(NM_001184722.1),利用 Primier primer 5.0 软件设计引物,AMF引物序列:上游5'-AGCTAAGCTTATG CATCATCATCATCATCATGCCGCTCTCACCCGGGAC C-3 ',下 游 5 '-ATCGGAATTCTTATTGGACTCTGGC CTCGCGCTGC-3',产物大小1 700 bp。反应条件:94℃预变性5 min;94℃ 30 s,68℃ 3 min 30 s,循环30次;72℃延伸10 min,4℃终止。10 g/L琼脂糖凝胶电泳分析PCR结果,并送上海生工生物工程有限公司测序。
1.2.2 重组质粒的构建与鉴定 pEGFP-C1、pcDNA3.1(+)和AMF目的片段同时用HindⅢ和EcoRⅠ双酶切,纯化酶切产物,将酶切后的AMF目的片段和载体片段以3∶1(物质的量比)连接,转化感受态大肠杆菌DH5α后,挑选单个菌落并提取质粒,获得 pEGFP-C1-AMF 和 pcDNA3.1(+)-AMF,HindⅢ和EcoRⅠ双酶切鉴定重组质粒,并送上海生工生物工程有限公司测序。
1.3 重组质粒的表达
1.3.1 细胞培养及转染 EC9706、Eca109和EC-1细胞生长于含体积分数10% 胎牛血清的RPMI 1640培养基中,在37℃、体积分数5%CO2饱和湿度的温箱中培养。待细胞达到90%~95%融合时,采用LipofectamineTM2000分别转染pEGFP-C1-AMF和pcDNA3.1(+)-AMF,具体操作按说明书进行。
1.3.2 转染pEGFP-C1-AMF细胞融合蛋白EGFPAMF的定位 pEGFP-C1-AMF转染EC9706、Eca109和EC-1细胞48 h后,以蓝光激发,用显微荧光摄像/照相系统检测EGFP-AMF融合蛋白的表达。
1.3.3 转染 pcDNA3.1(+)-AMF 细胞 AMF mRNA检测 应用Trizol试剂提取转染前后细胞总RNA,取2 μg进行逆转录,PCR扩增出目的基因片段,以β-actin为内参,每个样本重复3次。AMF引物同1.2.1;β-actin 引物序列:上游 5'-ACCAACTGGGACGACATGGAGAAAATC-3 ',下 游 5 '-GTAGCCGCGCTCGGTGAGGATCTTCAT-3',产物大小 409 bp。反应条件:94℃预变性5 min;94℃ 30 s,55℃ 40 s,72℃1 min,循环30次;72℃延伸10 min,4℃终止。产物经10 g/L琼脂糖凝胶电泳,凝胶成像系统摄像,以目的基因与β-actin条带灰度值的比值表示目的基因的相对表达量。
1.3.4 转染 pcDNA3.1(+)-AMF 细胞 AMF 蛋白的检测 采用Western Blot法测定。用蛋白裂解液提取重组质粒pcDNA3.1(+)-AMF转染前后细胞的总蛋白,用Bradford法测定蛋白浓度。制备SDS-聚丙烯酰胺凝胶,每孔上样量60 μg,常规电泳、转膜、封闭,用鼠抗组氨酸标签的抗体作为一抗,山羊抗小鼠IgG抗体作为二抗进行Western Blot分析,同时用β-actin作阳性对照。一抗(稀释度1∶200)4℃过夜孵育及相应二抗(稀释度1∶10 000)37℃孵育1 h,ECL发光液处理后暗室内曝光胶片。
1.4 转染pcDNA3.1(+)-AMF细胞磷酸化丝切蛋白的检测 采用Western Blot法,操作同1.3.4。
1.5 统计学处理 采用SPSS 13.0进行分析。转染pcDNA3.1(+)-AMF、未转染及转染 pcDNA 3.1(+)的3种细胞中AMF mRNA及磷酸化丝切蛋白的相对表达量经正态性和方差齐性检验后,采用单因素方差分析,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1 重组质粒的鉴定 AMF基因PCR结果见图1。重组质粒经双酶切鉴定及测序分析证实,重组质粒含有大小、方向和读码框均正确的插入片段(图2)。

图1 AMF基因PCR结果
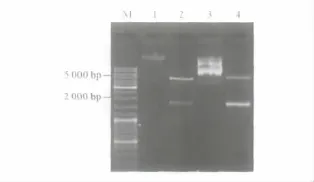
图2 重组质粒双酶切鉴定结果
2.2 EGFP-AMF在转染细胞中的定位 见图3。蓝光激发后,高倍镜下可见转染pEGFP-C1空载体的EC9706、Eca109和EC-1细胞绿色荧光分布于整个细胞,而转染pEGFP-C1-AMF的细胞绿色荧光主要分布于细胞质。
2.3pcDNA3.1(+)-AMF 转染细胞中 AMF mRNA及蛋白测定结果 见图4、5和表1。
2.4 pcDNA3.1(+)-AMF转染细胞中磷酸化丝切蛋白的表达 见图6、表2。
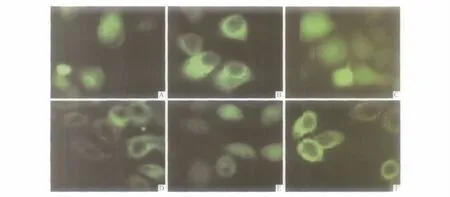
图3 EGFP-AMF在转染细胞中的定位(×400)

图4 pcDNA3.1(+)-AMF转染细胞中AMF mRNA的表达
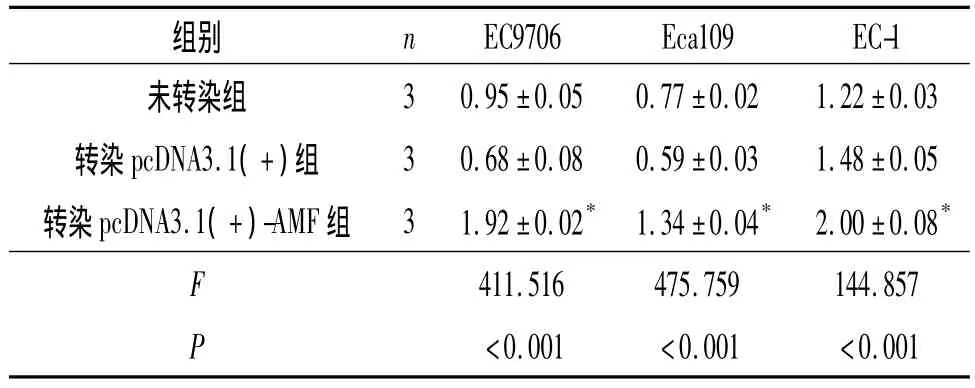
表1 3组细胞中AMF mRNA的表达
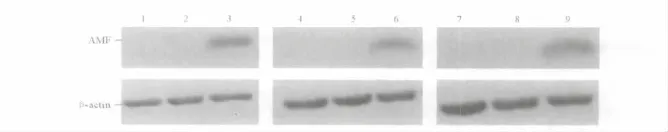
图5 pcDNA3.1(+)-AMF转染细胞中AMF蛋白检测结果

图6 pcDNA3.1(+)-AMF转染细胞中磷酸化丝切蛋白检测结果

表2 3组细胞中磷酸化丝切蛋白的表达
3 讨论
AMF是一个多功能蛋白,也可被称为磷酸己糖异构酶(phosphoglucose isomerase,PGI)[4],催化葡萄糖-6-磷酸异构化为果糖-6-磷酸,PGI特异性抑制剂不仅可以抑制该酶的活性,也可以抑制细胞的运动。AMF在细胞内集中于像细管一样的囊泡中,遍布于整个胞质,而不是完全集中于某个特殊的细胞骨架网[5]。正常细胞和肿瘤细胞均能表达AMF,但在肿瘤细胞中存在AMF的过度表达并伴有蛋白选择性分泌。研究[6-7]发现,AMF促进肿瘤细胞运动的功能是通过与肿瘤细胞上的自分泌运动因子受体(AMFR)结合并活化Rho信号途径来实现的[8]。作者构建pEGFP-C1-AMF重组质粒,转染3种食管鳞状细胞癌细胞,观察到AMF蛋白均定位于细胞质。
恶性肿瘤的侵袭和转移包括了基质降解、细胞迁移及血管生成等一系列步骤,其中肿瘤细胞在基质中的迁移以及突破基底膜进入血管是肿瘤发生远处转移的重要途径。在肿瘤转移过程中,虽然细胞类型和分化程度的不同使癌细胞具有不同的转移方式,但最终都是通过调节改变细胞骨架从而影响细胞的运动。微丝微管的解离聚合由Rho家族的小GTP激酶调节,这些小GTP激酶将细胞外化学信号传导至下游信号分子,最终作用于细胞骨架蛋白,影响微丝微管的解离聚合状态,从而影响细胞的运动能力[9]。丝切蛋白的活性依赖于Ser-3位点的磷酸化和去磷酸化,Ser-3位点的磷酸化使丝切蛋白失活、肌动蛋白微丝聚集,并增强细胞运动能力;反之,去磷酸化则激活丝切蛋白,解聚肌动蛋白微丝的活性[10]。作者构建了 pcDNA3.1(+)-AMF 真核表达载体,转染食管鳞状细胞癌细胞,发现3种细胞转染后,磷酸化丝切蛋白表达水平提高,提示AMF可以促进丝切蛋白磷酸化,有利于进一步提高癌细胞的运动能力。
综上所述,对AMF的进一步研究将有助于阐明食管鳞状细胞癌的发生及转移机制,在此基础上,抑制AMF的表达或活性可能为食管鳞状细胞癌的防治提供一种新的治疗模式[11]。
[1]Liotta LA,Mandler R,Murano G,et al.Tumor cell antocrine motility factor[J].Proc Natl Acad Sci USA,1986,83(10):3 302
[2]Takanami I,Takeuchi K,Watanabe H,et al.Significance of autocrine motility factor receptor gene expression as a prognostic factor in non-small-cell lung cancer[J].Int J Cancer,2001,95(6):384
[3]Kawanishi K,Doki Y,Shiozaki H,et al.Correlation between loss of E-cadherin expression and overexpression of autocrine motility factor receptor in association with progression of human gastric cancers[J].Am J Clin Pathol,2000,113(2):266
[4]Fairbank M,St-Pierre P,Nabi IR.The complex biology of autocrine motility factor/phosphoglucose isomerase(AMF/PGI)and its receptor,the gp78/AMFR E3 ubiquitin ligase[J].Mol Biosyst,2009,5(8):793
[5]Niinaka Y,Paku S,Haga A,et al.Expression and secretion of neuroleukin/phosphohexose isomerase/maturation factor as autocrine motility factor by tumor cells[J].Cancer Res,1998,58(12):2 667
[6]周峻,何勇,金岩,等.口腔鳞状细胞癌中Rho的表达及作用[J].口腔医学,2008,28(3):113
[7]韩志强,张阿丽,陈彩虹,等.ROCK-Ⅰ蛋白表达或活性的改变对人卵巢癌细胞运动表型的影响[J].现代妇产科进展,2007,16(8):561
[8]Funasaka T,Hogan V,Raz A.Phosphoglucose isomerase/autocrine motility factor mediates epithelial and mesenchymal phenotype conversions in breast cancer[J].Cancer Res,2009,69(13):5 349
[9]Yamazaki D,Kurisu S,Takenawa T.Regulation of cancer cell motility through actin reorganization[J].Cancer Sci,2005,96(7):379
[10]Moriyama K,Iida K,Yahara I.Phosphorylation of Ser-3 of cofilin regulates its essential function on actin[J].Gene Cells,1996,1(1):73
[11]Wang W,Yang LY,Yang ZL,et al.Elevated expression of autocrine motility factor receptor correlates with overexpression of RhoC and indicates poor prognosis in hepatocellular carcinoma[J].Dig Dis Sci,2007,52(3):770
