siRNA对体外培养红系细胞α-珠蛋白基因表达的影响*
2010-06-15赖永榕刘容容
罗 琳,赖永榕,刘容容
(广西医科大学第一附属医院血液内科,南宁530021)
对重型β-珠蛋白生成障碍性贫血,目前临床上缺乏有效的治疗手段。基因治疗是珠蛋白生成障碍性贫血治疗的希望。基因治疗靶向首选的是调控β珠蛋白基因,其次是减少α/β珠蛋白链的不平衡。减少α珠蛋白链的合成,改善α与非α链珠蛋白的合成失衡,减少红细胞内包涵体的形成,减少溶血,改善β-珠蛋白生成障碍性贫血症状,这一新的治疗方式引起了人们的兴趣。RNA干扰(RNA interference,RNAi)是近年来新发现的一种重要的基因表达调控方式,自1998年发现RNAi以来[1],其机制研究和应用突飞猛进。本研究设计靶向α-珠蛋白基因的小分子干扰 RNA(siRNA),经脂质体(Oligofectamine,Invitrogen,Ca.t No.12252-011)转染体外培养的红系前体细胞,从分子水平部分抑制α-珠蛋白基因表达,减少α珠蛋白肽链合成,筛选获得有效抑制α-珠蛋白基因的siRNA及最佳作用浓度,为后期选取适宜的siRNA作用于体外培养的重型β-珠蛋白生成障碍性贫血患者的红系细胞提供实验依据。
1 材料与方法
1.1 体外液体培养正常人外周血红系细胞 用CS-3000 plus血细胞分离机采集rhG-CSF动员的正常移植供者外周血0.5~1 mL,制备单个核细胞(MNC)悬液。调整细胞浓度至5~6×106个/mL,参照 Wojda等[2]方法,加入 RPMI-1640培养基,内含1%牛血清清蛋白、10-4mol/L 2-巯基乙醇、2 mmol/L L-谷氨酰胺、10-6mol/L地塞米松、30%胎牛血清和3 u/mL rhEpo、总体积为10 mL、混匀后放入37℃、5%CO2培养箱中连续培养,每4天更换全部旧培养基1次,加入等体积新鲜培养基(含相同浓度的上述成分)。换液同时取部分细胞,制片染色,观察培养的红系细胞形态学特征。
1.2 siRNA设计、合成 从基因库获得α-珠蛋白基因mRNA全序列(GenBank:NM000517),应用 Ambion公司的在线 siRNA序列设计工具,选择3条siRNA,并用前期预实验进行分析和筛选;获得最佳 siRNA:Sense 5′-AGG UUA AGG GCC ACG GCA ATT-3′,Antisense 5′-UUG CCG UGG CCC UUA ACC UGG-3′。siRNA由上海 Genepharma公司合成、纯化、分装,并在5′端标记荧光(FAM),以检查转染效率。同时合成与目的基因序列无同源性的阴性对照组及GAPDH阳性对照组。
1.3 siRNA的脂质体转染 按照脂质体说明书的步骤操作,在转染前1 d将红系细胞按5×105个/mL在无血清条件下接种于24孔培养板,脂质体、siRNA均用Opti-MEM IMedium(Invitrogen,Ca.t No.31985-062)溶解,siRNA组设定5个终浓度:40、80、120、160、200 nmol/L。同时设阴性对照组、空白对照组。置于37℃、5%CO2、饱和湿度的培养箱中培养72 h。
1.4 流式细胞仪检测脂质体转染效率 分别于siRNA作用24、48、72 h后,取部分细胞,经 PBS洗涤 2次,应用流式细胞仪(Beckman Coulter公司产品,Epics XL型)进行检测,数据采用Cell Quest软件分析。
1.5 RT-PCR法检测红系细胞中α-珠蛋白基因表达
1.5.1 RNA提取 参照TRIzoL试剂说明书分别提取上述各细胞中的总RNA。用紫外分光光度计测RNA浓度(RNA浓度=A260×40 μ g/mL×1/光径 ×稀释倍数)及纯度(A260/A280比值在1.8~2.0),再用2%琼脂糖凝胶电泳确定RNA质量,而后将RNA储存于-80℃备用。
1.5.2 cDNA合成 根据TaqMan逆转录试剂盒[RNA PCRKit(AM V)Ver.3.0,CatNo.DRR019A]说明书,把 1μ g 总RNA反转录成为单链cDNA,反应获得cDNA储存于-20℃备用。样品准备,PCR加样和PCR产物检测分析均在相互独立的环境中完成。
1.5.3 RT-PCR iCycler iQTM荧光实时PCR仪为美国Bio-Rad公司产品。SYBR GreenⅠ(for QPCR)购自捷瑞生物工程(上海)有限公司(Code:RS0976),PCR反应体系20 μ L含cDNA模板1 μ L,引物各5 pmol。PCR反应条件为:95℃预热3 min,紧接着35个循环的 95℃变性30 s、60℃退火30 s和 72℃延伸30 s,热循环完成后进行55~95℃的溶解曲线测定。PCR反应结束后由电脑自动分析出定量结果。所有样品检测实验均包含1个无模板的阴性对照以排除假阳性结果,见表1。每个样品中α-珠蛋白基因的相对mRNA表达水平可以用公式计算 :相对 mRNA 表达 =2-ΔΔCt[3]。

表1 引物序列及扩增片断长度
1.6 台盼兰拒染率检测细胞存活 分别于转染24、48、72 h后取部分细胞,检测台盼兰拒染率,了解细胞存活情况。
2 结 果
2.1 体外液体培养体系中红系细胞形态学特征 培养4 d时,体系中部分细胞呈现出原始红细胞特征,核为圆形或椭圆形,核染色质为紫蓝色,较细致,可见1~2个核仁,胞浆量少,无颗粒;培养第8天时(转染siRNA当天),上述细胞进一步分化,核染色质开始凝集,核仁消失,胞浆量增多,见图1。
2.2 流式细胞仪检测脂质体转染siRNA效率 红系细胞用Oligofectamin转染带有FITC荧光素的 siRNA后24、48、72 h分别收集部分细胞,流式细胞仪检测FITC细胞百分率分别为61.2%、44.3%、33.7%。检测结果显示,转染效率随作用时间的递增而逐渐减低,见图2。
2.3 脂质体转染siRNA作用后α-珠蛋白基因的表达 结果表明,siRNA对α-珠蛋白基因表达的抑制效应在一定范围内具有浓度及时间依赖特性。浓度越高,抑制效应越高。不同浓度siRNA的α-珠蛋白基因相对表达量之间相互比较:120、160、200 nmol/L组相对表达量低于 40、80 nmol/L组(P<0.05),80、40 nmol/L 组之间,200、160、120 nmol/L 组之间比较差异无统计学意义(P>0.05)。各时间点的α-珠蛋白基因相对表达量之间比较:200、160、120 nmol/L 3组的相对表达量在48、72 h低于24 h(P<0.05),但48、72 h之间比较差异无统计学意义(P>0.05),见表 2、图3。

图1 培养的红系细胞形态学特征
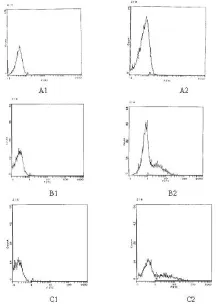
图2 流式细胞仪检测脂质体转染siRNA效率
表 2 不同浓度siRNA作用后α-珠蛋白基因相对表达量(±s)

表 2 不同浓度siRNA作用后α-珠蛋白基因相对表达量(±s)
时间(h)siRNA浓度(nmol/L)40 80 120 160 200 24 0.67±0.01 0.61±0.02 0.55±0.02 0.52±0.01 0.51±0.01 48 0.60±0.02 0.54±0.01 0.42±0.02 0.39±0.02 0.38±0.01 72 0.57±0.01 0.52±0.02 0.39±0.01 0.36±0.02 0.34±0.02
2.4 台盼兰拒染率检测细胞存活 不同浓度siRNA作用后,红系细胞台盼兰拒染率的差异有统计学意义(P<0.05),浓度越高,台盼兰拒染率越低;且作用时间越长,台盼兰拒染率也越低,见表3。

图3 不同浓度siRNA作用后α-珠蛋白基因相对表达量
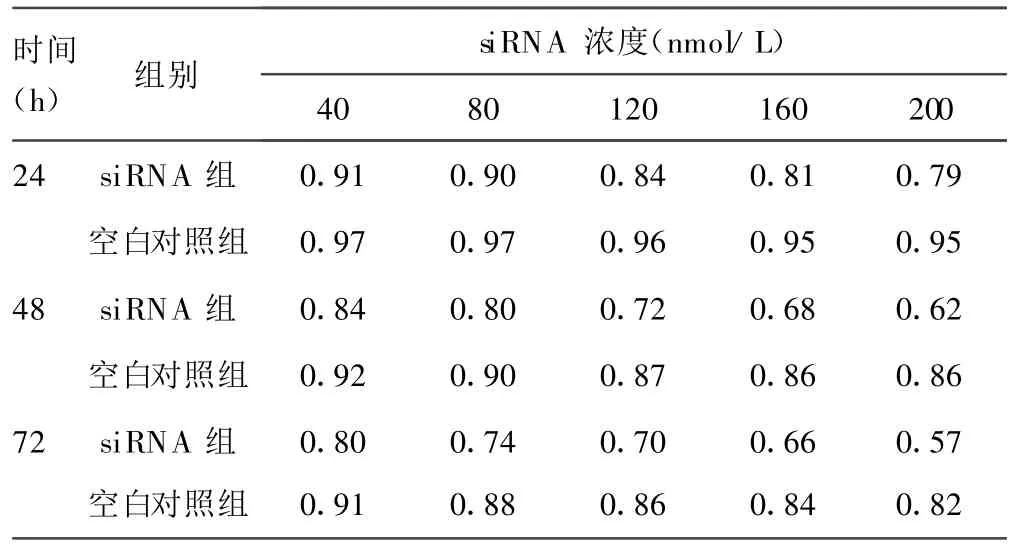
表3 不同浓度siRNA作用后细胞台盼兰拒染率
3 讨 论
部分血液系统疾病是由于基因缺陷或变异造成的,而RNAi技术可以高效特异地抑制异常基因的表达,故RNAi技术在研究血液疾病在基因分子水平上的发病、致病机制、探讨血液疾病的基因治疗方法等领域有广阔的应用前景。目前在血液系统肿瘤、肿瘤多药耐药、血红蛋白病等方面都有较深入的研究[4-8]。在RNAi过程中起关键作用的物质就是siRNA,为了保证实验的顺利进行,作者选择了质量可靠、纯度高并且可以修饰的化学合成法制备siRNA。在前期的预实验中,作者已筛选出最佳的siRNA序列。
相比其他的转染试剂,脂质体Oligofectamine对悬浮细胞有较高的转染效率[9]。本研究采用脂质体Oligofectamine作为转染试剂,流式细胞术检测转染细胞后 24、48、72 h的荧光表达,分别为 61.2%、44.3%、33.7%,转染效果较为满意,能满足实验的进行。
本研究选用了 40、80、120、160、200 nmol/L作为测试浓度,结果显示不同浓度siRNA作用于红系细胞后其α-珠蛋白基因相对表达量的差异有统计学意义,浓度越高,抑制效应越大,但不同浓度siRNA之间比较提示在一定范围内,siRNA的作用存在浓度依赖,但达到一定浓度后,即使增大浓度也不再提高抑制效应。各时间点的α-珠蛋白基因相对表达量之间比较提示siRNA作用后可在48 h或72 h观察干扰效果。
王海燕等[10]应用不同浓度的dsRNA转染大鼠的神经干细胞,发现50~200 nmol/L浓度转染组细胞均能正常生长,但形态存在明显差异。0.5%锥虫蓝法检测培养细胞活力及统计结果表明,各浓度组之间差异有统计学意义,浓度与细胞活力呈负相关,相关系数为-0.9。作者在研究中也观察了siRNA不同浓度、不同时间对培养细胞存活情况的影响。发现不同浓度siRNA作用后,随着作用浓度增加,培养的红系细胞台盼兰拒染率越低,细胞死亡越多。而且作用时间越长,台盼兰拒染率也越低,细胞死亡越多。提示虽然高浓度siRNA能更有效地抑制靶基因的表达,但是高浓度对细胞的毒性也不可低估,低浓度的siRNA则更有利于细胞存活。
对于β-珠蛋白生成障碍性贫血,目前国内外学者主要侧重于对β珠蛋白链的研究,而甚少关注α珠蛋白链。不同于以往国内外的研究,本研究设计针对α-珠蛋白基因的 siRNA,通过封闭部分α-珠蛋白基因,抑制相应的α珠蛋白链合成,改善α与非α珠蛋白链的比例失衡状况,减少红细胞内包涵体的形成,减轻或缓解红细胞溶血,达到治疗β-珠蛋白生成障碍性贫血的目的,为探讨基因调控治疗β-珠蛋白生成障碍性贫血寻找新的靶点。
[1] Fire A,Xu S,Montgomery M K,et al.Potent and specific geneti interference bydouble-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806.
[2] Wojda U,Nopel P,Miller JL,et al.Fetal and adult hemoglobin production during adult erythropoiesis:coordinate expression correlates with cell proliferation[J].Blood,2002,99(8):3005.
[3] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2[-Delta Delta C(T)]method[J].Method,2001,25(4):402.
[4] Koldehoff M,Steckel NK,Beelen DW,et al.Therapeutic application of small interfering RNA directed against bcrabl thanscripts to a patient with imatinib-resistant chronic myeloid leukaemia[J].Clin Exp Med,2007,7:47.
[5] Ortega-Paino E,Fransson J,Ek S,et al.Functionally associated targets in mantle cell lymphoma as defined by DNA microarrays and RNA interference[J].Blood,2008,111(3):1617.
[6] 赵珍珍,徐酉华,郑改焕,等.靶向ABCG2基因的 RNA干扰提高K562细胞的化疗敏感性[J].肿瘤,2009,29(10):929.
[7] Lim M N,Lau NS,Chang KM,et al.Modulating multidrug resistance gene in leukemia cells by short interfering RNA[J].Singapore Med J,2007,48(10):932.
[8] Xie SY,Ren ZR,Zhang JZ,et al.Restoration of the balanced α/β-globin gene expression in β654-thalassemia mice using combined RNAi and antisense RNA approach[J].Hum Mol Genet,2007,16(21):2616.
[9] Cioca DP,Aoki Y,Kivosawa K.RNA interference is a functional pathway with therapeutic potential in human myeloid leukemia cell lines[J].Cancer Gene Ther,2003,10(2):125.
[10]王海燕,徐如祥,姜晓丹,等.dsRNA阻断大鼠骨髓源性神经干细胞Hes5表达的实验研究[J].第一军医大学学报,2004,24(1):35.
