雌激素与人尿酸盐转运子(hUAT)基因表达的相关性研究
2010-06-15卢彦敏付正菊李长贵付爱荣
卢彦敏,王 霞,付正菊,宋 娓,李长贵,付爱荣
(1.青岛经济技术开发区第一人民医院保健科,山东266555;2.青岛大学医学院附属医院内分泌科,山东266003)
近年来随着人们生活水平的提高,原发性高尿酸血症的患病率明显上升,人尿酸盐转运子(human urate transporter,hUAT)是调节肾尿酸分泌的关键物质,进入肾近端小管上皮细胞内的尿酸盐50%由其介导分泌到管腔,经肾脏排出体外[1]。推测hUAT基因低表达或功能降低可能是原发性高尿酸血症的重要发病原因。目前,对雌激素在尿酸排泄中的作用研究发现,绝经后合并高尿酸血症的女性应用雌激素替代疗法可使血尿酸水平明显下降[2-3]。本实验对雌激素通过何种机制降低血尿酸水平进行研究。
1 材料与方法
1.1 材料 肾小管上皮细胞(HK-2细胞,购自中国典型培养物收藏中心CCTCC细胞库),雌激素(Merck公司),T rizol RNA抽提试剂(Takara公司),DMEM培养基(美国Invitrogen GIBCO公司),hUAT、甘油醛 3-磷酸脱氢酶(GAPDH)和 Taqman荧光探针、引物(宝生物工程大连有限公司)等。
1.2 实验方法
1.2.1 HK-2细胞的培养和分组 细胞培养于DM EM培养基中,外加10%胎牛血清,每3~4天换液1次,至细胞生长达90%汇合后进行传代。实验所用的细胞为第3~5代细胞(将从液氮中复苏的未知代细胞定为第1代)。取汇合达90%的细胞经胰酶/EDTA消化制成细胞悬液,继续培养24 h,使细胞生长达汇合,弃去含血清的培养液,用PBS清洗3遍后换无血清培养液,继续培养24 h,使细胞同步处于G0期。以后所有实验均在无血清条件下进行。
取培养后同步处于G0期的HK-2细胞,按继续培养条件的不同分为5组:B0组(DMEM+乙醇对照组)、B1组(DMEM+10-12mol/L雌激素+0.5%乙醇)、B2(DMEM+10-10mol/L雌激素+0.5%乙醇)、B3组(DMEM+10-8mol/L雌激素+0.5%乙醇)、B4组(DM EM+10-6mol/L雌激素+0.5%乙醇),每组均培养6瓶细胞。上述细胞在不同培养液中分别培养48 h,用胰酶消化,离心后抽提总RNA及总蛋白。
1.2.2 HK-2细胞总RNA抽提及cDNA制备 应用Trizol试剂抽提细胞总RNA,采用紫外分光光度计测定其浓度。按照逆转录试剂盒说明进行逆转录,制备cDNA。反应体系如下:2 μ L的 5×primer buffer、0.5 μ L prime enzyme mixI、0.5 μ L oligo dT primer和 0.5μ L random 6 mers,终体积为 20 μ L。 向反应体系中加入 0.5 μ g/μL 的 RNA 1 μ L,37 ℃水浴 15 min,85 ℃加热5 s。逆转录所得的cDNA用作PCR反应的模板,-20℃保存备用。
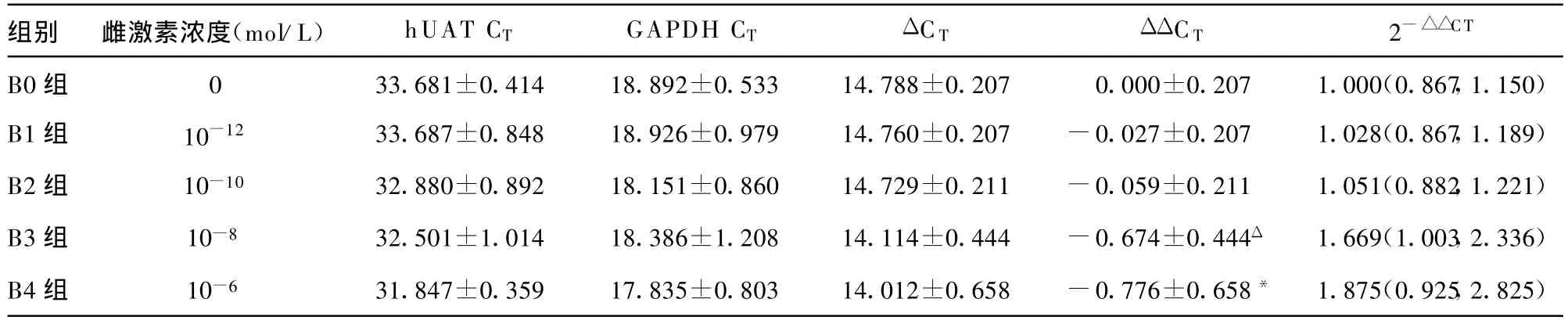
表1 不同浓度雌激素对hUAT基因表达的影响(x ±s)
1.2.3 hUAT mRNA表达的检测 hUAT、甘油醛-3-磷酸脱氢酶(GAPDH)基因引物与探针均由宝生物工程(大连)有限公司设计合成,采用看家基因GAPDH进行标化。hUAT上游引物:5′-ATG GTC AGC ACC TGT T TG AAT AC-3′,下游引物 :5′-CAG GAA GCC GCC TA T GTC TG-3′;TAQMAN探针 5′-ACC ATC GCC TGA GGA ACC TGC CCA-3′,扩增片段长度为115 bp。内参GAPDH 上游引物:5′-GGA CCT GAC CTG CCG TCT AG-3′,下游引物:5′-TAG CCC AGG ATG CCC TTG AG-3′;TAQMAN 探针 5′-CCT CCG ACG CCT GCT TCA CCA CCT-3′,扩增片段长度 99 bp。取同一个cDNA为模板进行hUAT、GAPDH的 PCR反应。反应体系如下:2 μ L cDNA 、1.6 μL 探针 引物 、10 μ L Premix ExTaq、0.4 μ L ROXⅡ和6 μ L 超纯水,终体积为 20 μ L。 按如下程序扩增:96孔反应板置于荧光定量PCR扩增仪,反应参数如下:95℃、10 s,95℃、5 s,60℃、45 s,40个循环。应用 SDS软件自动分析,给出各反应的扩增曲线和Ct值。依照文献[4-8]的方法进行定量PCR的检测与分析。荧光定量PCR的结果以Ct值显示。Ct值为每个反应管内的荧光信号达到设定区域值时所经历的循环数。每个样本重复检测3次,取平均值为Ct值,用SPSS11.5软件计算出各段各基因表达的平均Ct值,采用相对定量2-△△Ct法比较各基因的表达差异[4-6]。以 B0组表达量为1,2-△△Ct值,即为目的段较正常段基因表达的倍数。
1.3 统计学方法 采用SPSS11.5统计软件进行分析。所有数据均以±s表示,两组间比较采用非配对 t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
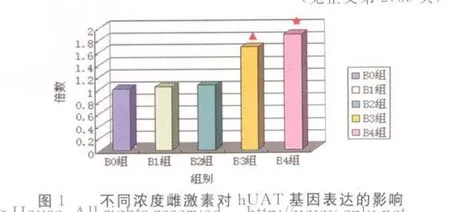
不同浓度雌激素对hUAT基因表达的影响见表1、彩插Ⅰ图1。加入不同浓度激素培养48 h的各组 HK-2均上调hUAT基因的表达。随雌激浓度增加,hUA T mRNA水平明显升高。与B0组比较,B3、B4组hUAT mRNA水平明显升高(P<0.05),B1、B2组hUAT mRNA水平变化不明显(P>0.05)。与B1、B2组比较,B3和B4组hUAT mRNA水平明显升高(P<0.05)。B3组与B4组比较差异无统计学意义(P>0.05)。B1组与B2组比较差异无统计学意义(P>0.05)。B4组hUAT mRNA水平最高,是 B0组的1.87倍。
3 讨 论
高尿酸血症目前已成为严重危害人类健康的常见病、多发病,对高尿酸血症防治的研究已成为国内外学者关注的焦点。
hUAT是近年来发现的与尿酸排泄有关的管道蛋白,是尿酸由细胞内到细胞外的关键转运子,hUAT广泛分布于各种组织细胞中。乳糖和葡萄糖可调节其活性,尿酸酶特异阻断剂——OxOnate、抗结核药物——吡嗪酰胺(PZA)、腺苷在胞浆外侧均可阻断重组hUAT的通道活性,影响hUA T对尿酸盐的转运[9]。进入肾近端小管的尿酸盐50%由其介导分泌到细胞外,排出体外。因此,推测其功能降低将导致肾脏对尿酸的排泄减少[9-10],导致高尿酸血症。Hong等[11]研究发现,高尿酸环境中,人肾小管上皮细胞hUA T mRNA水平明显上调。提示hUAT在尿酸转运过程中发挥重要作用。hUAT与高尿酸血症的关系有待进一步深入研究。
流行病学调查结果显示女性在绝经前血尿酸水平明显低于男性,绝经后血尿酸水平与男性相似,因此,世界卫生组织对女性高尿酸血症的定义为:绝经前血尿酸水平大于357 μ mmol/L即可诊断为高尿酸血症,绝经后与男性相同,即大于416μ mmol/L才可诊断为高尿酸血症。此外,大量临床资料及近期对山东沿海地区高尿酸血症和痛风的流行病学调查资料也显示女性痛风和高尿酸血症患病率明显低于男性。提示性激素在维持机体尿酸的平衡中发挥重要作用。但性激素通过何种机制降低血尿酸水平,目前仍不清楚。
本研究结果显示,雌激素可直接调节hUAT基因的表达,雌激素水平越高,hUAT mRNA水平越高。该结果说明雌激素通过上调hUAT基因的表达,促进肾脏尿酸排泄,是女性维持机体尿酸水平稳定的保护因素,可能是绝经前、后女性高尿酸和痛风发病率明显不同的重要原因。本研究发现雌激素达到一定浓度后对hUAT基因的表达差异有统计学意义,因此,作者认为在尿酸代谢的过程中存在雌激素的作用“阈值”,正常生理状态下,体内雌激素浓度高于该阈值时,雌激素发挥正相调节功能,体内尿酸水平得以维持正常;而在女性绝经后或是某些病理状态下,体内雌激素水平降低,达不到其作用阈值,雌激素对相关尿酸基因的正向调节功能减弱,尿酸排泄减少,血尿酸水平升高。同时,参与肾脏尿酸排泄的尿酸盐转运蛋白还包括阴离子交换器1(URAT1)、有机阴离子转运子1(OAT1)和OA T3等,因此,可对上述基因的表达进行检测,以提供更全面的资料,从而进一步研究雌激素对尿酸排泄的影响。
[1] Enomoto A,Kimura H,Chairoungdua A,et al.Molecular identification of a renal urate anion exchanger that regulates blood urate levels[J].Nature,2002,417(4):447.
[2] Alderman M,Redfern JS.Serum uric acid-a cardiovasular risk factor[J].Ther Umsch,2004,61(9):547.
[3] Sundstrom J,Sullivan L,D′Agostino RB,et al.Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence[J].Hypertension,2005,45(1):28.
[4] 李爱武,张文同,刘春喜,等.先天性巨结肠层粘连蛋白的表达及与RET基因相关性的研究[J].中华小儿外科杂志,2006,27(5):237.
[5] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-2-△△C(T)C(T)method[J].Methods,2001,25(4):402.
[6] 杨扬,何威,吴军,等.脂溢性角化病皮损中Smad4 mRNA表达水平的变化[J].重庆医学,2008,37(8):833.
[7] 唐家宏,徐兵,宋小燕,等.荧光定量PCR方法检测急性髓系白血病FLT3基因mRNA的表达[J].广东医学,2008,29(3):377.
[8] 吴华,曹骥,杨春,等.荧光定量 RT-PCR检测肝细胞肝癌中B-myb的表达及其临床意义[J].广西医学,2007,29(11):1663.
[9] Leal-Pinto E,Cohen BE,Lipkowitz MS,et al.Functional analysis and molecular model of the human urate transporter/channel,hUAT[J].Am J Physiol Renal Physiol,2002,283(1):150.
[10]Lipkowitz MS,Leal-Pinto E,Rappoport JZ.Functional reconstitution,membrane targeting,genomic structure,and chromosomal localization of a human urate transporter[J].J Clin Invest,2001,107(9):1103.
[11]Hong Q,Wu D,Chen XM,et al.Cloning and sequence analysis of human uric acid transporter gene[J].Di Yi Jun Yi Da Xue Xue Bao,2005,25(6):623.