三叶因子1和环氧合酶-2在66例胃癌组织中的表达*
2010-06-15赖铭裕廖晓霞梁志海黄杰安唐国都
赖铭裕,廖晓霞,梁志海,石 磊,黄杰安,唐国都
(广西医科大学第一附属医院:1.老年消化内科;2.消化内科,南宁530021)
环氧合酶-2(cyclooxygenase-2,COX-2)是前列腺素合成过程中一个重要的限速酶,其高表达与肿瘤发生、发展密切相关。近年来,关于胃癌发病机制的研究中,三叶因子(trefoil factors,TFFs)与胃癌的发生、发展逐渐引起研究者的关注。三叶因子1(trefoil factor 1,TFF1)是三叶因子家族成员之一,其分子中具有特定的三叶草结构域,这种结构的稳定性使其具有明显的抗酸、抗蛋白酶和抗热分解特性,对胃肠道黏膜有保护和修复作用。TFF1与胃癌之间的关系尚不十分明确,因此,用免疫组化方法研究TFF1和COX-2在正常胃黏膜组织、癌旁组织和胃癌组织中的表达情况,初步探讨其在胃癌发生、发展中的作用。
1 材料与方法
1.1 材料 选取广西医科大学第一附属医院2005年1月至2007年9月接受胃大部切除术的胃癌标本66例,均经组织病理学检查证实。所有标本术前均未接受非甾体抗炎药治疗及放、化疗。其中男44例,女 22例,年龄 29~74岁,平均55.9岁。高、中分化腺癌18例,低、未分化腺癌48例;未侵及浆膜层者26例,侵及浆膜层及浆膜外者40例;发生局部淋巴结转移者29例,无局部淋巴结转移者37例。同时取距癌缘3~5 cm的癌旁组织66例、正常胃黏膜组织42例作为对照组。试剂采用鼠抗人TFF1单克隆抗体(即用型)、链霉菌抗生素蛋白-生物素-过氧化物酶(S-P)免疫组化试剂盒和二氨基联苯(DAB)显色剂,均购自福建迈新生物技术开发公司;兔抗人COX-2单克隆抗体(工作浓度1∶200)购自美国Santa Cruz公司。
1.2 检测方法 所有标本均经10%甲醛固定,常规脱水、透明、渗蜡、包埋,4 μ m厚连续切片。常规脱蜡、水化,采用免疫组化染色超敏2步法(SP染色),DAB显色,苏木素复染,吹干,具体操作按S-P试剂盒说明书进行。阴性对照采用生理盐水磷酸盐缓冲液(PBS)代替一抗,其余步骤相同。
1.3 评判标准 阳性信号为细胞胞浆和胞膜上出现黄色或棕黄色染色。每例取5个高倍视野(400倍),用病理图像分析仪测定阳性信号平均灰度值,灰度值越高,TFF1和COX-2表达越弱。
1.4 统计学方法 使用SPSS11.5统计软件进行分析,采用χ2检验,以 P<0.05为差异有统计学意义。
2 结 果
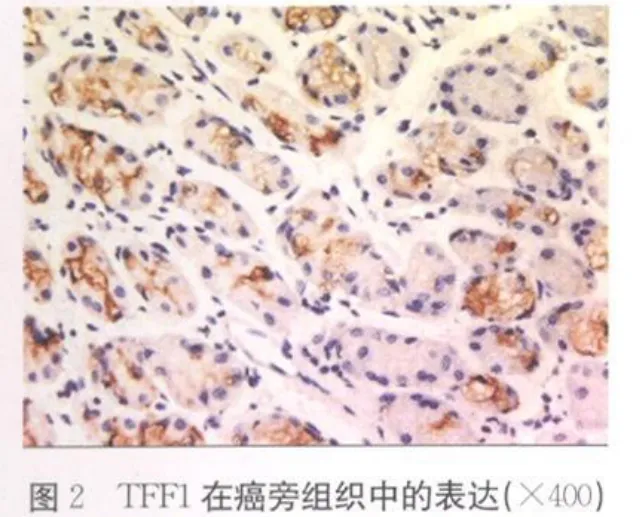
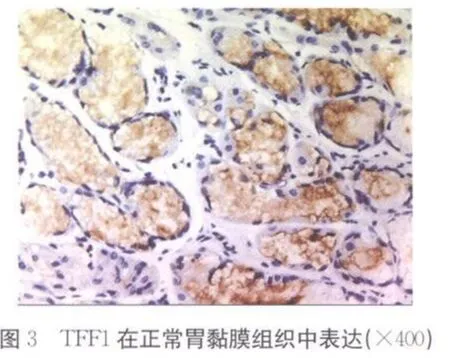
2.1 TFF1在不同胃组织中的表达 TFF1在胃癌组织、癌旁组织和正常胃黏膜组织中的阳性信号平均灰度值分别为(209.40±16.00)、(199.12±16.68)和(189.17±16.20),各组间两两比较,差异均有统计学意义(P<0.01),见表 1、彩插Ⅱ图1~3。
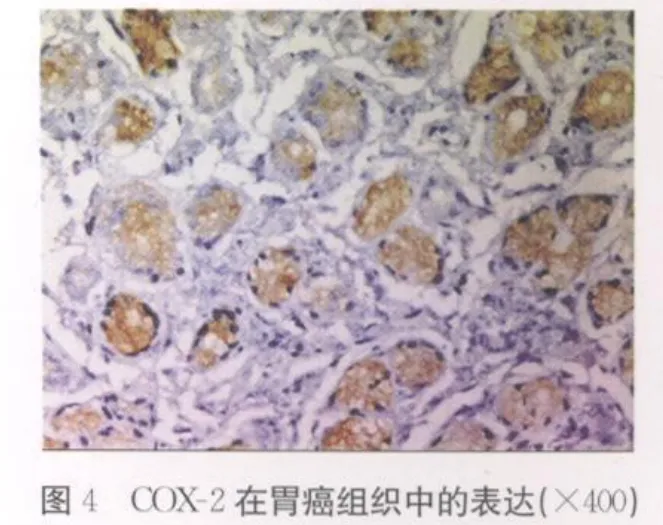
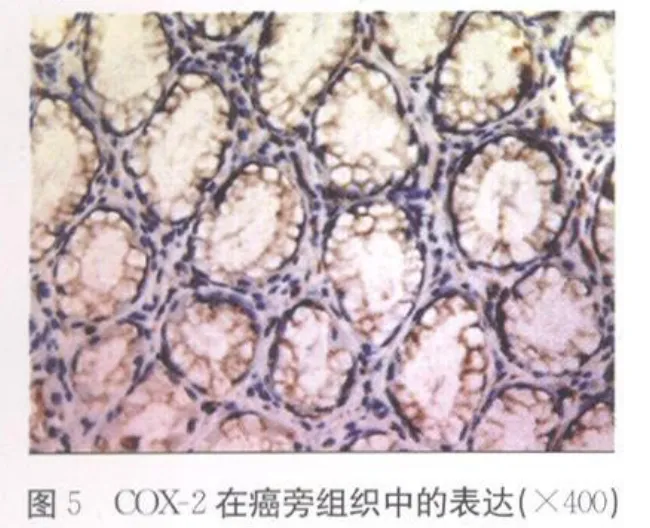
2.2 COX-2在不同胃组织中的表达 COX-2在胃癌组织、癌旁组织和正常胃黏膜组织中的阳性信号平均灰度值分别为(191.21±10.19)、(209.91±4.85)和(214.23±5.85),各组间两两比较,差异均有统计学意义(P<0.01),见表 2、彩插Ⅱ图4~ 6。
表1 TFF1在不同胃组织中的表达(±s)

表1 TFF1在不同胃组织中的表达(±s)
与胃癌组织比较,▲:P<0.01;与癌旁组织比较,△:P<0.01。
组织 n 平均灰度值胃癌组织 66 209.40±16.00癌旁组织 66 199.12±16.68▲正常胃黏膜组织 42 189.17±16.20△
表2 COX-2在不同胃组织中的表达(±s)

表2 COX-2在不同胃组织中的表达(±s)
与胃癌组织比较,▲:P<0.01;与癌旁组织比较,△:P<0.01。
组织 n 平均灰度值胃癌组织 66 191.21±10.19癌旁组织 66 209.91±4.85▲正常胃黏膜组织 42 214.23±5.85△
2.3 TFF1与COX-2的相关性分析 TFF1与COX-2的表达呈负相关(r=-0.891,P<0.01)。
3 讨 论
COX-2是前列腺素合成过程中一个重要的限速酶。生理状态下,COX-2基因在绝大多数组织细胞中不表达,只有在细胞内外广泛的刺激下才呈诱导性表达。近年来研究发现COX-2高表达与肿瘤发生、发展密切相关。COX-2在肿瘤细胞的增殖、凋亡过程中起重要作用[1-2],它的表达延长了癌细胞的生存期,有利于癌细胞发生浸润与转移,同时在正常组织细胞中COX-2的表达则有利于细胞基因突变的累积,增加细胞癌变的可能性;肿瘤细胞中COX-2的表达可通过上调黏附因子、基质金属蛋白酶等促进肿瘤细胞发生浸润与转移[3]。马丹等[4]研究发现COX-2在胃癌组织中的表达阳性率为76.74%,COX-2蛋白的表达可作为反应胃癌侵袭转移的生物学指标。本研究结果显示在正常胃黏膜组织、癌旁组织、胃癌组织中,COX-2表达呈逐渐上升趋势,差异有统计学意义(P<0.01)。提示随着COX-2表达的不断增加,促进细胞的无限增殖、分化,抑制细胞凋亡,最终发展成为胃癌。
TFF1于1982年由Masiakowski等[5]在雌激素诱导的人乳腺癌细胞系MCF-7中获得。TFF1在正常组织中主要由胃窦和胃体的隐窝及表层上皮的黏膜细胞产生,而在食管、结肠、胰腺、肝脏、前列腺、卵巢等组织中低水平表达甚至不表达。大量研究发现TFF1表达于正常胃黏膜,在胃黏膜肠化、不典型增生到胃癌的发展过程中TFF1表达逐渐降低,50%甚至更多的胃癌组织TFF1表达缺失[6-7]。提示TFF1进行性缺失参与了早期胃癌的发生。Park等[8]对基因图谱分析时发现,原发性胃癌发生时,人染色体21q22常有复位基因的缺失,而此位点正是TFF1的基因所处位置,表明TFF1在胃癌发生的早期起作用,进而可能影响相关癌基因及抑癌基因的改变,促进胃癌的发生。本研究结果显示在正常胃黏膜组织、癌旁组织、胃癌组织中,TFF1表达呈逐渐减弱趋势,差异有统计学意义(P<0.01)。
Milne等[9]研究发现在传统胃癌组织中COX-2过表达而TFF1表达缺失,提示2种分子之间可能存在相互作用并引起TFF1的下调、COX-2的上调以及通过2种分子所特有的途径共同在胃癌的发生、发展中发挥作用。Regalo等[10]研究证实,C/EBP-β作为COX-2的一个转录因子,通过其与 COX-2的关系而在胃癌的发生中扮演重要角色。而现已知C/EBP-β是TFF1下调的一个转录因子[11]。有研究发现TFF1可通过依赖src的自体活化环调控前列腺素和TXA-2表达,抑制COX-2能阻断 TXA-2R途径,抑制 TFF1诱导的侵袭和血管生成[12]。本研究相关性分析显示TFF1与COX-2的表达呈负相关(r=-0.891,P<0.01),可认为在胃癌的发生过程中,TFF1和COX-2之间可能存在相互作用或是通过2种分子共有的途径引起TFF1的下调、COX-2的上调。COX-2的表达增加可抑制TFF1的表达,使TFF1表达减弱,细胞增殖与凋亡失衡,最终导致胃癌的发生。
[1] Tsujii M,DuBois RN.Alteration in cellular adhesion and apoptosis in epithelial cells overexpressing prostaglandin endoperoxide synthase 2[J].Cell,1995,83(3):493.
[2] Jones M K,Wang H,Peskar BW,et al.Inhibition of angiogenesis by non-steroid anti-inflammatory drugs:insight into mechanisms and implications for cancer growth and ulcer healing[J].Nat Med,1999,5:1418.
[3] Tsujii M,Kawano S,Du Bois RN,et al.Cyclooxygenase-2 expression in human colon cancer cells increases metastatic pontentia[J].Proc Natl Acad Sci USA,1997,94(7):3336.
[4] 马丹,刘敏,梁平,等.COX-2在人胃癌中的表达及与胃癌临床病理特征的关系[J].重庆医学,2009,38(3):290.
[5] Masiakowski P,Breathnach R,Bloch J,et al.Cloning of cDNA sequences of hormone-regulate genes form the MCF-7 human breast cancer cell line[J].Nucleic Acids Res,1982,10(24):7895.
[6] Luqmani Y,Bennett C,Paterson I,et al.Expression of the pS2 gene in normal,benign and neoplastic human stomach[J].Int J Cancer,1989,44(5):806.
[7] Leung WK,Yu J,Chan FK,et al.Expression of trefoil peptides(TFF1,TFF2,TFF3)in gastric carcinomas,intestinal metaplasia,and non-neoplastic gastric tissues[J].J Pathol,2002,197(5):582.
[8] Park WS,Oh RR,Park JY,et al.Mapping of a new target region of allelic loss at 21q22 in primary gastric cancers[J].Cancer Lett,2000,159(1):15.
[9] Milne AN,Carvalho R,M orsink FM,et al.Early-onset gastric cancers have a different molecular expression profile than conventional gastric cancers[J].M od Pathol,2006,19(4):564.
[10]Regalo G,Canedo P,Suriano G,et al.C/EBP beta is overexpressed in gastric carcinogenesis and is associated with COX-2 expression[J].J Pathol,2006,210(4):398.
[11]Sankpal NV,Moskaluk CA,Hampton GM,et al.Overexpression of C/EBP beta correlates with decreased TFF1 in gastric cancer[J].Oncogene,2006,25(4):643.
[12]Rodrigues S,Nguyen QD,Faivre S,et al.Activation of cellular invasion by trefoil peptides and src is mediated by cyclooxygenase-2 and thromboxane A2 receptor-dependent signaling pathways[J].FASEB J,2001,15(9):1517.