首次脑梗死患者血清超敏C反应蛋白与动脉硬化指数的相关性分析
2010-06-14秦晓凌蔚志刚黄文娟曹培卫杨承志孟新颜
秦晓凌 蔚志刚 张 侠 黄文娟 曹培卫 杨承志 孟新颜
研究表明,炎症在动脉粥样硬化的发生、发展中起着重要的作用。超敏C-反应蛋白(high sensitivity C-reactive protein,hsCRP)是临床应用广泛的炎症标记物,其水平的升高与严重的血管事件发生有关,这些事件包括心肌梗死、脑卒中、心源性死亡、周围血管病以及代谢综合征和糖尿病,血清hsCRP的水平可能是个良好的预测和评估脑血管事件危险性的新指标。本研究通过检测首次脑梗死患者发病3 d内hsCRP和血脂水平,计算动脉硬化指数,分析其相关性,探讨其临床意义以及炎症在脑梗死中的可能作用机制。
1 对象与方法
1.1 研究对象
1.1.1 脑梗死组(ACI组) 系本院神经内科2008年7月~2009年9月住院患者,均为首次急性脑梗死患者,共60例,其中男36例,女 24例,年龄40~81岁,平均年龄(62.27±10.45)岁,病程在72 h之内。诊断标准:严格按照1995年全国第四届脑血管病学术会议修订的诊断标准[1],并经头颅MRI检查证实。参照美国国立卫生院神经功能缺损评分(NIHSS)标准,所有入选患者NIHSS评分<5分。
1.1.2 对照组 系同期体检健康者,共35例,其中男20例,女15例,年龄 44~77岁,平均年龄(60.08±10.10)岁。对照组无神经功能缺损症状,头颅MRI检查证实无脑梗死病灶。2组均询问有无高血压病史、糖尿病病史及吸烟、饮酒史。
1.1.3 排除标准 所有脑梗死患者均为首次发病,每组均排除明显肝肾功能不全或心功能衰竭;严重的感染或恶性疾病;近4周有潜在的感染体征及症状、外科手术和外伤史。半月内未服用过阿司匹林、他汀类降脂药及ACEI类降压药。
1.2 方法
1.2.1 标准采集 首次急性脑梗死患者于发病3 d内,于清晨空腹抽取肘静脉血2m l,置于含有0.2 m l的EDTA抗凝管中,离心10 min(1 500 r/min),分离血清并将其储存于2~8℃环境中,2 d内测定hsCRP浓度。体检健康者于清晨空腹安静状态下采血。
1.2.2 hsCRP水平测定 利用SIEMENS BNⅡ全自动特定蛋白分析系统,采用免疫比浊法检测。系统采用多点定标方式建立标准曲线,最低检测底线为0.15 mg/L;系统自动对标本进行1∶20稀释后检测;当检测结果>5 mg/L时,系统自动对标本增加稀释倍数后复查;试剂采用Dade-Behring试剂盒,抗体液、辅助试剂/沉淀剂、标准品、Dade-Behring校正液,以上试剂均由Dade-Behring公司提供。
1.2.3 其他实验室检查 入院后分别利用雅培3700全自动血细胞分析仪测定白细胞(WBC)和血小板计数(PLT),日立7600全自动生化分析仪检测空腹血糖及餐后 2 h血糖、胆固醇(cholesterol,TCH)、高密度脂蛋白(high density lipoprotein,HDL-C)、低密度脂蛋白(low density lipop rotein,LDL-C)、甘油三酯(Triglyceride,TG)等。
1.2.4 体重指数(Body M ass Index,BM I)以体重/身高平方(kg/m2)表示。
1.2.5 血浆致动脉硬化指数(atherogenic index of plasma,AIP)以log(TG/HDL-C)表示。
2 结 果
2.1 脑梗死组与对照组一般临床资料的比较 脑梗死组的年龄和性别构成比、体重指数、吸烟及饮酒史、高血压病史、糖尿病史、白细胞计数及血小板计数等情况与对照组相比均无明显差异(P>0.05)(表 1)。

表1 ACI组和对照组一般临床资料比较
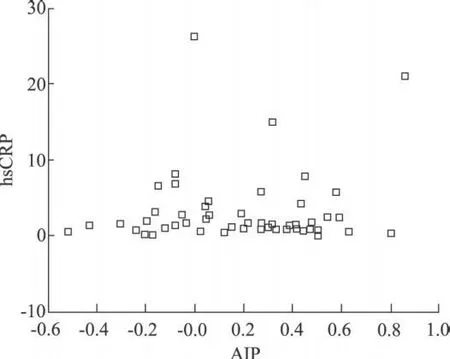
图1 脑梗死组血清hsCRP浓度与A IP的相关性

图2 对照组血清hsCRP浓度与A IP的相关性
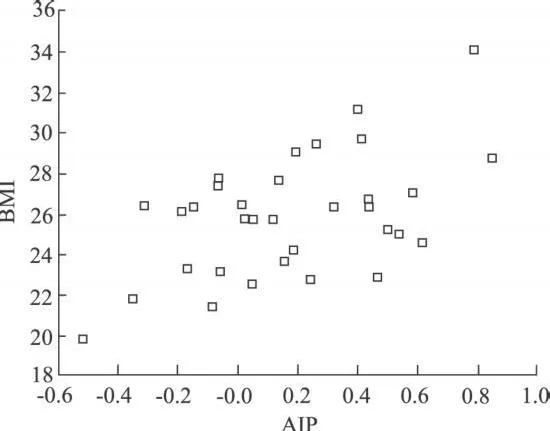
图3 脑梗死组A IP与BM I的相关性
表2 2组血清hsCRP浓度、血脂水平及动脉硬化指数的比较(±s)

表2 2组血清hsCRP浓度、血脂水平及动脉硬化指数的比较(±s)
注:与对照组比较,*P=0.007,△P=0.03,▲P=0.01
组别 例数 hsCRP(mg/L)TCH(mmol/L)TG(mmol/L)HDLC(mmol/L)LDLC(mmol/L)动脉硬化指数(AIP)脑梗死组 60 3.03±4.76* 4.98±0.77 1.82±1.12*△ 1.03±0.27 2.92±0.77 0.20±0.30*▲对照组 35 1.38±1.33 4.55±0.82 1.59±0.68 1.07±0.20 2.85±0.71 0.14±0.20

图 4 对照组 AIP与BM I相关性
2.2 2组血浆hsCRP浓度、血脂水平及动脉硬化指数比较 脑梗死患者发病3 d内血浆hsCRP浓度高于对照组(P=0.007)。2组间TG与AIP亦存在显著性差异,P值分别为0.03和0.01(表2)。
2.3 2组血清hsCRP浓度与动脉硬化指数(A IP)的相关性分析 2组患者血清hsCRP浓度与AIP均无相关性(r=0.101,P=0.45;r=0.110,P=0.53)。2组AIP与体重指数呈正相关(r=0.487,P=0.03;r=0.661,P=0.007)。
3 讨 论
C反应蛋白(C-reactive protein,CRP)是人体血浆中的一种正常蛋白组分,含量甚微,最早因发现其和肺炎球菌细胞壁的C多糖相结合而得名。当组织损伤或炎症发生时,CRP在肝脏的合成和分解率增加,血清中的CRP浓度会显著上升。在临床上CRP浓度的测定非常有助于炎症和感染的检测,是最敏感的炎症指标之一。当CRP呈低浓度升高(10 mg/L以下)时,只能用超敏CRP(简称hsCRP或hCRP)来检测(普通CRP检测低限为8~10 mg/L),不能检测低浓度)。超敏C反应蛋白是急性期低水平组织炎症的标记物。
研究表明,动脉粥样硬化(A therosclerosis,AS)作为缺血性脑卒中的主要病因,不仅由脂质沉积、血液动力学负荷、遗传和感染所致,而且始终是一个慢性炎症过程,炎症反应贯穿了其形成、发展及血栓形成破裂的全过程[2]。作为慢性炎症的标志物,CRP可刺激单核细胞释放组织因子,加强局部血栓的形成;CRP还可与脂蛋白结合,由经典途径激活补体系统,后者可产生大量攻击复合物和终末蛋白C5b,造成血管内膜受损;CRP还可经其受体活化粒细胞、单核细胞,通过直接(浸润、聚集)或间接(产生细胞因子)作用,造成血管损伤。以上CRP的作用均可促成炎症反应及斑块破裂[2]。因此,炎症过程在AS及其并发症的发生与发展过程中起着重要作用。
动脉硬化指数(A therogenic Index of Plasma,AIP)的概念由 Fobiasova和Frohlich等于 2001年提出,定义为 log(TG/HDL-C)。A IP与 HDL部分脂化率(fractional esterification rate of HDL,FERHDL)呈正相关(r=0.803)。FERHDL,A IP与LDL颗粒大小呈负相关(r=-0.82;r=-0.78)。FERHDL预测LDL,HDL颗粒大小,与心血管事件相关。因此同时应用TG和HDL-C可以预测心血管事件风险,评价动脉硬化形成(atherogenicity)[3]。临床研究中AIP是评价临床实验结果的重要工具,用于评价脂蛋白谱的变化,对干预性治疗反应进行量化评价;它理论上反映了风险性脂蛋白和保护性脂蛋白之间的平衡与否[4]。
本研究结果发现,ACI患者发病 3 d内血清hsCRP水平明显高于对照组(P=0.007),并且无论是脑梗死组还是对照组,hsCRP水平与 TCH、A IP之间无相关性,提示hsCRP与脑梗死的发生有密切关系,并且可能是独立于TG和HDL-C,TCH和LDLC以外的脑梗死相关危险因素。ACI组动脉硬化指数明显高于对照组(P=0.01),说明高AIP患者更易发生脑梗死,因此A IP也可以作为缺血性脑卒中风险评价因素。同时2组动脉硬化指数与体重指数均呈正相关(r=0.487;r=0.661),查阅相关资料,未发现有类似报道。
hsCRP作为炎症标记物临床应用广泛,它是独立有效的心血管事件和脑卒中的预测因子,重要性等同于传统危险因素如 LDL-C,HDL-C,血压,吸烟等[5,6]。一项针对女性健康者的研究(The Women's Health Study,WHS)通过对15 632名健康女性进行完整脂质谱分析(含Non-HDLC,HDL-C,LDL-C,TC)及hsCRP测定并随访发现,脂质水平对未来缺血性脑卒中事件的决定性弱于对心血管事件的决定性,而hsCRP则与缺血性脑卒中的关系更为密切[7]。Rost等对入组Framingham Study的人员随访12~14年发现,高CRP水平与未来首次缺血脑卒中和短暂性脑缺血发作(transient ischemic attack,TIA)事件发生有密切的线性关系,血清CRP水平处于高四分位数的男性和女性人群患病的相对危险度分别增加2倍和2.7倍[8]。hsCRP的升高不是缺血事件导致的结果,而是加速心血管事件发生的始动因素[9]。本研究对象为首次发病的脑梗死患者,其发病3 d内血清hsCRP浓度明显高于对照组,在一定程度上提示hsCRP与脑梗死的发生亦存在关系。究其原因,可能与hsCRP参与脂质斑块破裂致脑梗死形成有关。Muir等观察了26 000例不同病情严重程度的脑梗死患者hsCRP水平,发现hsCRP水平与疾病的严重程度呈正相关,是缺血性脑卒中存活率和病死率的独立预测因子[10]。A renillas等则指出CRP对再次发生脑卒中可能具有预警作用[11]。因此,hsCRP不仅可能是脑卒中发生、发展的独立危险因素,而且对于预测预后具有重要价值。
1 中华神经科学会中华神经外科学会.各类脑血管疾病诊断要点.中华神经科杂志,1996,29(6):379-380.
2 Libby P,Ridker PM,Maseri A.Inflammation and atherosclerosis.Circu lation,2002,105(9):1135.
3 Dobiasova M,Frohlich J.The plasma parameter log(TG/HDLC)as an atherogenic index:correlation w ith lipop rotein particle size and esterification rate in aboB-lipoprotein-depleted plasma(FERHDL).Clin Biochem,2001,34(7):583-588.
4 Tan MH,Johns D,Glazer NB.Pioglitazone reducesatherogenic index of plasm a in patients w ith type 2 diabetes.Clin Chem,2004,50(7):1184-1188.
5 Ridker PM,G lynn RJ,H ennekens CH.C-reactive p rotein adds to the predictive value of total and HDL cholesterol in determ ining risk of first m yocardial infarction.Circulation,1998,97(20):2007-2011.
6 Cook NR,Buring JE,Ridker PM.The effect of in cluding C-reactive protein in cardiovascular risk prediction m odels for w omen.Ann Intern Med,2006,145(1):21-29.
7 Brendan ME,Tobias Kurth,Ju lie E,et al.The reelative Relative streng th ofC-reactive protein and lipid levelsas determ inan ts of ischem ic stroke com pared w ith coronary heart disease in w omen.JAm Coll Cardiol,2006,48(11):2235-2242.
8 Rost NS,W olf PA,Kase CS,et al.Plasm a concen tration of C-reactive p rotein and risk of ischemic stroke and transien t ischem ic attack:the framingham study.Stroke,2001,32(11):2575-2579.
9 Kuller LH,T racy RP,Shaten J,et al.Relation of C-reactive protein and coronary heart disease in the M RFIT nested casecontrol study.Am JEpidem iol,1996,144(6):537-547.
10 Muir KW,W eir CJ,A lw an W,et al.C-reactive p rotein and outcome after ischem ic stroke.Stroke,1999,30(5):981-985.
11 A renillas JF,A lvarez-Sabin J,MolinaCA,et al.C-reactivep rotein predicts fu rther ischemiceven ts in first-ever transien t ischemic attack or stroke patients w ith intracranial large-artery occlusive disease.Stroke,2003,34(10):2463-2468.
