心肌细胞系H9c2缺氧上清诱导人脐静脉内皮细胞ICAM-2的表达
2010-06-13娄利霞王硕仁张冬梅高永红孙逸坤
娄利霞,王硕仁,张冬梅,高永红,孙逸坤
心肌供血不足能够造成心肌损伤,产生心肌细胞功能障碍,甚至坏死。心肌缺血时心肌细胞发生代谢的改变,以及心肌细胞内离子平衡紊乱等。缺血心肌还会发生功能和结构的变化。近来研究发现内皮细胞的变化及其炎症反应参与了心肌缺血时损伤或适应性的改变,如缺血后微循环障碍、血管新生的发生等[1]。但是现在内皮炎症反应的机制不清楚。炎症反应是慢性心肌缺血的病理损伤的重要机制,可以刺激免疫细胞,调节神经体液因素参与缺血性损伤[2]。
前期的基因芯片研究工作提示,炎症因子细胞间黏附分子-2(ICAM-2)在缺血心肌细胞与内皮细胞间相互作用研究中被证实表达上调。因此,本实验研究缺氧培养的心肌细胞培养上清对人脐静脉内皮细胞ICAM-2表达的影响及其分子机制,阐明缺氧心肌细胞和内皮细胞间的分子调控,有利于从旁分泌角度认识心肌缺氧条件下内皮细胞因子的表达调控机制。
1 材料与方法
1.1 材料 大鼠心肌细胞系H9c2由北京大学分子医学研究所赠,人原代脐静脉内皮细胞株(HUVEC,货号C-003-5C)及其培养基M200(货号M-200-500)、低血清生长添加剂LSGS(货号S-003-10)购自美国Cascade Biologics公司。DM EM、胎牛血清以及胰蛋白酶购自美国Gibeco公司。
细胞因子 PDGF-AA、AB、BB,肿瘤坏死因子-α(TNF-α),白介素(IL)-1β,IL-6,VEGF,FGF-2购自美国Peprotech公司(NewJersey,USA)。引物由北京奥科生物技术有限公司合成:ICAM-2上游引物:5'-CCGTGGCAA TGAGACTCTGCACTA-3',ICAM-2下游引物:5'-ATGGTTGCTATGGCCGGAAGG-3',GAPDH上游引物:5'-CATCTCTGCCCCCTCTGCTG-3',GAPDH下游引物:5'-CGACGCCTGCTTCACCACCT-3'。oligo(dT)15和M-MuLV反转录酶购自美国Promega公司(MO,USA),Taq DNA聚合酶购自大连宝生物。ICAM-2小鼠单克隆抗体(sc-9987)多克隆兔抗β-actin抗体(sc-1616)购自美国 Santa Cruz公司(CA,USA)。大鼠PDGF-ABELISA试剂盒(EK0485)购自武汉博士德生物工程有限公司,大鼠PDGF-BB ELISA试剂盒(3R123c)购自美国 RapidBio Lab公司(CA,USA)。
1.2 细胞培养 大鼠心肌细胞系H9c2在含有10%胎牛血清,100 U/mL青霉素和100 μ g/mL四环素的 DMEM培养基中培养。HUVEC在含有100 U/mL青霉素,100 μ g/mL四环素以及LSGS添加剂的专用培养基M200中培养。HUVEC长到90%~95%时,转入无血清和添加剂的培养基中过夜培养,然后进行实验。
1.3 缺氧培养上清的制备 H9c2细胞37℃,5%CO2培养,长至80%~90%时去上清,PBS洗3次,加入无血清无抗生素的DMEM培养基,放入氧气浓度为1%的缺氧培养箱(Mini Galaxy A-500,UK)。缺氧培养24 h后收集上清,用于HUVEC培养。
1.4 细胞因子刺激实验 取4代或5代的 HUVEC细胞,长至90%后更换无因子添加剂的M200中过夜培养。参考文献[3]制备,各细胞因子的刺激浓度为:PDGF-AA 20 ng/mL,PDGFAB 20 ng/mL,PDGF-BB 20 ng/mL,TNF-α20 ng/mL,IL-1β 5 ng/mL,IL-6 20 ng/mL,VEGF 20 ng/mL,FGF-2 25 ng/mL。
1.5 RNA提取和RT-PCR 加氯仿室温震荡3min,4℃12 000 r/min离心15 min,取上清加异丙醇冰上放置5 min后4℃12 000 r/min离心10 min,弃上清加75%乙醇洗沉淀,4℃12 000 r/min离心10 min后弃上清,室温晾干,加入DEPC处理过的H2O冰上溶解,紫外分光光度计测定RNA浓度和纯度。
取1 μ g总 RNA,在 oligo(dT)15和M-MuLV 反转录酶作用下反转录为cDNA。PCR反应体系为25μL∶1μ L cDNA,5 μ mol/L上下游引物各1μL,2.5 mmol/L dNTP混合物 1μ L,1.5 mmol/L MgCl21.5 μ L,10×PCR 缓冲液 2.5 μ L,1.25 U Taq DNA聚合酶。反应条件为:94℃变性5 min,然后进行30次扩增反应:94℃30 s,57℃30 s,72℃延伸 40 s,最后72℃延伸10 min。
1.6 Western Blot检测蛋白表达 处理后细胞甩掉上清,PBS洗3次,最后吸干所有液体,加裂解缓冲液,冰浴条件下吹打裂解细胞,或行超声破碎,4℃ 13 000 r/min离心10 min,取上清进行蛋白定量,等体积加入2x蛋白上样缓冲液,100℃煮沸20 min。将样本蛋白行SDS-PAGE(10%)电泳,电转移于硝酸纤维素(NC)膜上,5%脱脂奶粉室温封闭1 h,以含0.05%吐温的PBS(TBS)洗涤 3次,1∶1 000的 ICAM-2抗体,4℃孵育过夜,TBS冲洗3遍,加入辣根过氧化酶标的羊抗兔IgG抗体(1∶6 000)。室温孵育1h,以TBS液冲洗3次,ECL(北京Applygen公司)化学发光法显影。
1.7 细胞培养上清细胞因子的测定 每孔加入100μ L样品和标准品,37℃反应90 min,甩去酶标板内液体,不洗。每孔加100 μ L生物素标记的抗体,37℃反应60 min。0.01 mol/L PBS洗涤3次。每孔加100 μ L亲和素-过氧化物酶复合物(ABC)工作液,37℃反应30 min。0.01 mol/L PBS洗涤5次。每孔加入90 μ L TMB显色液,37℃避光反应6 min~10 min。每孔加入100 μ L TMB终止液,用酶标仪在450 nm测定OD值。
2 结 果
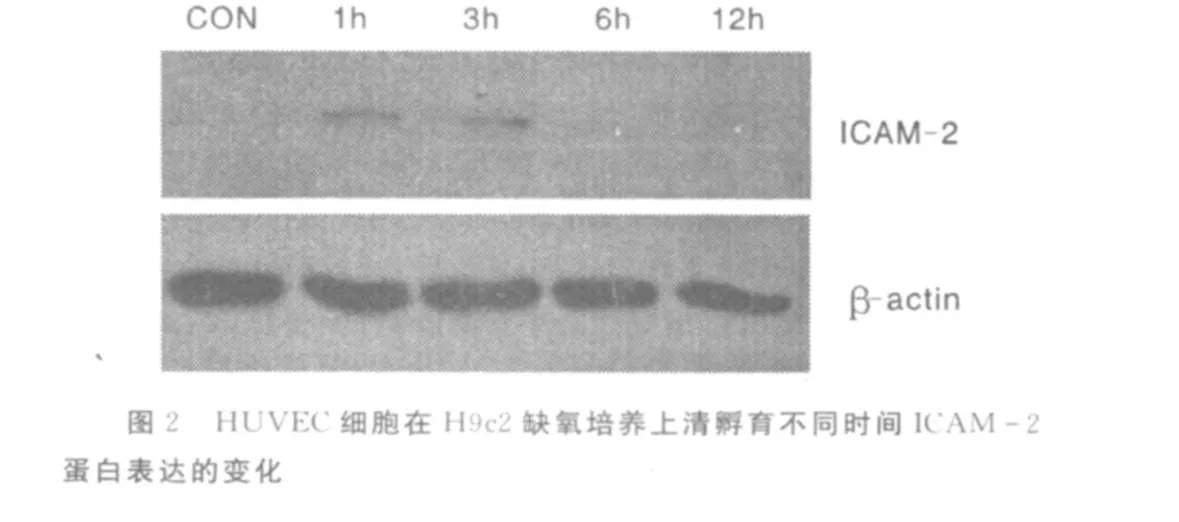
2.1 心肌细胞系缺氧培养上清诱导HUVEC的ICAM-2表达 通过H9c2心肌细胞系缺氧培养,得到心肌细胞系缺氧培养上清。在37℃,5%CO2条件下对HUVEC孵育,不同时间点收集细胞检测发现:在mRNA水平,缺氧上清孵育1 h后ICAM-2的表达明显升高,孵育 3 h后达到最高,在 6 h、12 h有所下降(见图1)。通过Western Blot检测发现,缺氧培养上清孵育后,在蛋白水平,HUVEC表达 ICAM-2在 3 h、6 h表达明显增高,而在15 h、21 h表达有所下降,趋于正常对照(见图2)。

2.2 细胞因子在H9c2缺氧培养上清诱导的ICAM-2表达中的作用 为了寻找是H9c2缺氧培养上清中含有的哪种细胞因子刺激了HUVEC细胞ICAM-2的表达,选择了多种已知的细胞因子进行了细胞因子刺激实验。在37℃,5%CO2条件下对 HUVEC刺激6 h后,收集细胞进行Western Blot检测发现,细胞因子 PDGF-BB和 PDGF-AB可以使 HUVEC表达ICAM-2显著增加(见图 3)。因此推测,可能PDGF-BB和PDGF-AB是H9c2缺氧培养上清中能刺激ICAM-2表达的有效成分。为进一步验证事实,我们对H9c2缺氧培养上清中PDGF-BB和PDGF-AB的含量进行了检测,并与H9c2常氧培养上清相比较。
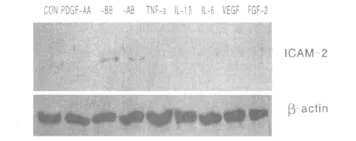
图3 HUVEC细胞在不同细胞因子刺激6 h后ICAM-2的蛋白表达
2.3 H9c2的缺氧培养上清中PDGF-BB和PDGF-AB的含量(见表1)ELISA方法检测H9c2的缺氧培养上清中PDGF-BB和PDGF-AB的含量,结果发现与常氧上清中的含量相比,在缺氧上清中PDGF-BB有显著性增加(P<0.05),而缺氧上清中的PDGF-AB却有显著减少(P<0.01)。在缺氧培养时PDGF-BB的分泌为(64.1±7.6)pg/104细胞,较常氧培养时PDGF-BB的分泌量(55.7±4.7 pg/104)细胞增加15%。这个结果表明,缺氧条件下PDGF-BB的分泌量的增加,可能是缺氧上清诱导HUVEC细胞表达ICAM-2的原因。
表1 H9c2的常氧培养上清和缺氧培养上清中PDGF-BB和PDGF-AB的含量(±s)pg/104细胞

表1 H9c2的常氧培养上清和缺氧培养上清中PDGF-BB和PDGF-AB的含量(±s)pg/104细胞
项目 n 常氧 缺氧PDGF-BB 6 55.7±4.7 64.1±7.61)PDGF-AB 6 66.9±10.3 46.9±7.72)与常氧上清比较,1)P<0.05,2)P<0.01
3 讨 论
心肌细胞的缺氧可以导致心肌细胞损伤甚至凋亡,是冠心病、心肌梗死发生的重要病理环节。缺氧发生后,常会在缺血组织发生炎症反应以及小血管数目的增加。其中的机制涉及心肌细胞与内皮细胞间的相互作用。但是迄今为止,它们之间的相互作用还不是很清楚。
本研究发现,心肌细胞系H9c2的缺氧培养上清可以诱导内皮细胞HUVEC表达ICAM-2。通过细胞因子刺激实验以及测定两种因子的含量发现,PDGF-BB和PDGF-AB可以刺激HUVEC表达ICAM-2,同时PDGF-BB在缺氧上清中较正常培养上清中增高,而 PDGF-AB相反。上述结果提示,H9c2在缺氧条件下产生的因子PDGF-BB是其中起作用的物质。
ICAM-2在内皮细胞和血小板高表达,最初是以白细胞整合素、淋巴细胞功能相关抗原-1(LFA-1)的反受体被克隆发现的。同时它也是树突细胞特异ICAM结合非整合素蛋白(DC-SIGN)的反受体[4]。近来研究发现 ICAM-2在血管发生中有重要作用。在内皮细胞ICAM-2的表达能被细胞间接触和生长因子调节,体内和体外实验表明ICAM-2的缺失导致血管生成减少,ICAM-2集中分布在细胞间连接处,通过同分子相互作用参与内皮形成管状结构和血管生成。同时,ICAM-2通过抑制内皮细胞凋亡的发生,调节Rac活化,促进血管生成[5]。但是,在心肌梗死后的血管生成中内皮细胞表面的ICAM-2是如何受到细胞间相互作用调节的尚不清楚。在人脐静脉内皮细胞,研究发现 TNF-α和IL-1β可以在转录水平下调ICAM-2的表达[6]。在人虹膜微血管内皮,内皮素和TNF-α刺激下可以被缓慢下调ICAM-2的表达[7]。本研究结果提示,缺氧心肌细胞产生的PDGF-BB可能刺激ICAM-2的表达。
PDGF-BB是血小板衍生生长因子(PDGF)的一种亚型。PDGF有同源双聚体(PDGF-AA,PDGF-BB)和异源双聚体(PDGF-AB)等三种亚型,其中PDGF-BB促新生血管化的作用最强[8]。PDGF-BB及其受体在微血管内皮细胞表达、调节内皮细胞增殖和迁移,有利于血管发生。PDGF不仅作用于内皮细胞,也可作用于管壁其他细胞,如间质细胞和平滑肌细胞的分化和分裂,从而形成完整的血管[9]。本研究提示,PDGF-BB可以介导缺氧心肌和内皮细胞间的相互作用,使内皮细胞ICAM-2的表达增加。而ICAM-2的表达被证实在血管发生中有重要作用[5]。因此,缺氧心肌通过PDGF-BB诱导内皮细胞ICAM-2的表达,从而促进血管发生可能是缺血区域的血管新生发生的重要机制。但是,其中的作用通路还需要进一步研究证实,其中的信号通路调节还需要深入的研究。
(致谢:美国哈佛大学医学院附属医院心血管科血管生成研究中心李建教授)
[1]Keeley EC,Mehrad B,Strieter RM.Chemokines as mediators of neovascularization[J].Arterioscler Thromb Vasc Biol,2008,28:1928-1936.
[2]Frangogiannis NG,Smith CW,Entman M L.The inflammatory response in myocardial infarction[J].Cardiovasc Res,2002,53:31-47.
[3]Zhang Y,Pasparakis M,Kollias G,et al.Myocy te dependent regulation of endothelial cell syndecan-4 expression.Role of TNF-alpha[J].J Biol Chem,1999,274:14786-14790.
[4]Weber KS,Alon R,Klickstein LB.Sialylation of ICAM-2 on platelets impairs adhesion of leukocytes via LFA-1 and DCSIGN[J].Inflammation,2004,28:177-188.
[5]Huang M T,Mason JC,Birdsey GM,et al.Endothelial intercellular adhesion molecule(ICAM)-2 regulates angiogenesis[J].Blood,2005,106:1636-1643.
[6]McLaughlin F,Hayes BP,Horgan CM,et al.Tumor necrosis factor(T NF)-alpha and interleukin(IL)-1beta down-regulate intercellular adhesion molecule(ICAM)-2 expression on the endothelium[J].Cell Adhes Commun,1998,6:381-400.
[7]Silverman MD,Zamo ra DO,Pan Y,et al.Cell adhesion molecule expression in cultured human iris endothelial cells[J].Invest Ophthalmol Vis Sci,2001,42:2861-2866.
[8]Zigzag D.Angiogenic g rowth factors in normal embryogensis and neoplasia[J].Am J Pathol,1995,146:293.
[9]Sato N,Beitz JG,Kato J,et al.Platelet-derived growth factor indirectly stimulates angiogenesis in vitro[J].Am J Pathol,1993,142:1119.
