舟山野菊花序不同萃取物抑菌活性的研究
2010-06-13童国忠马剑茵石亚素
童国忠,马剑茵,石亚素,王 斌
(1.浙江海洋学院食品与药学学院,浙江舟山 316004;2.舟山市定海区疾病控制中心,浙江舟山 316000)
野菊花为菊科植物野菊Chrysanthemum indicum、北野菊Chrysanthemum boreale Mak.或岩香菊Chrysanthemum lavandulaefolium(Fisch.)Mak.的头状花序[1],性凉,味苦、辛,归肺肝经,具有疏风清热、消肿解毒的功效,主治风热感冒、高血压、肺炎、口疮、痈疖等。现代药理证明:野菊花具有广谱抗菌、抗病毒、降压、增加冠脉血流量、清除活性氧自由基等作用[2]。舟山野菊花资源非常丰富,但开发利用甚少。本研究选择舟山群岛野菊花的头状花序经微波乙醇提取得粗提物[3],通过石油醚、乙酸乙酯、正丁醇和水萃取得到4种分段部位,并对4种萃取部位首次进行临床常见致病菌体外抑菌实验,研究结果将为舟山群岛抗感染中草药的开发和临床用药提供依据。
1 材料与方法
1.1 材料
野菊花采自浙江省舟山市定海区马岙镇,鉴定为菊科Compositae菊属Dendranthema多年生草本植物野菊。样品去除杂质,取头状花序,自然风干,使用前45℃烘干、粉碎至40目,得野菊花粗粉,保存于干燥器中。
标准菌株:金黄色葡萄球菌 Staphylococcus aureus,ATCC-26003;大肠埃希氏菌Escherichia coli,ATCC-44102。临床分离菌株:大肠埃希氏菌、金黄色葡萄球菌,均由舟山市定海区疾控中心提供。
营养肉汤和营养琼脂培养基(杭州天和微生物试剂有限公司,批号 090605,090521);药敏纸片(杭州天和微生物试剂有限公司);其他试剂均为分析纯(国药集团化学试剂有限公司)。
1.2 仪器
微波催化合成/萃取仪(XH-100A型,北京祥鹄科技有限公司);生化培养箱(SPX-150B-2型,广东省医疗器械厂);高速药物粉碎机(WK-800A型,青州市精诚机械有限公司);旋转蒸发仪(RE-2000型,上海亚荣生化仪器厂)。
1.3 供试药制备
1.3.1 样品提取与分段
称取样品50 g加70%乙醇浸泡12 h后微波萃取(物料比1:40,功率800 W,温度50℃,萃取时间15 min),抽滤,重复3次合并滤液,减压浓缩得干浸膏。将浸膏用水悬浮分散,依次用石油醚、乙酸乙酯和正丁醇各萃取3次,减压浓缩得萃取物A(石油醚)、B(乙酸乙酯)、C(正丁醇)和D(水)4部分,计算各萃取物产率。
1.3.2 药液制备
将各萃取物用灭菌蒸馏水(用5%二甲基亚砜助溶)溶解配制成供试药液,分别将质量浓度调整为相当于生药1 g/mL,经115℃高压灭菌20 min后,于冰箱4℃保存备用。
1.4 菌种活化及菌悬液制备
菌种活化:将供试菌种在相应平板上分离后,接种到试管营养琼脂斜面培养基上,每种菌株接种2支试管,置37℃恒温培养箱内培养24 h后,于冰箱4℃保存供测试用。
菌悬液制备:将营养琼脂斜面活化的菌种用无菌生理盐水制成约1.0×109CFU/mL的菌悬液,同时用营养琼脂平板涂布法进行活菌计数。
1.5 抑菌试验[4]
1.5.1 琼脂平板孔穴法(K-B法)
抑菌圈直径作为药物敏感初筛。将大肠埃希氏菌、金黄色葡萄球菌等4种菌悬液各5 mL分别倒入150 mL融化且冷却至45~50℃的营养琼脂培养基中充分摇匀,迅速分装于培养皿(Φ 90 mm)中,培养基厚约5 mm,待凝固后,在琼脂平板上打4个对称且直径为6 mm的小孔,分别在每个小孔内注入0.2 mL各种提取液,每个菌种做3个平行样本。置于37℃恒温培箱中培养24 h,观察结果,测量抑菌圈直径(以完全不生长菌作为测量标准),以各产物对测试菌3次平均值为抑菌圈直径,抑菌圈大于10 mm为抑菌敏感,小于8 mm或无抑菌圈为抑菌不敏感。
1.5.2 耐药菌种敏感测试
琼脂平板同“1.5.1”项制作。临床分离的耐药菌敏感测试按照抗生素药敏常规测试方法(纸片法)进行[5]。
1.5.3 最低抑菌浓度(MIC)测定
采用试管倍比稀释法[6]测定MIC。取无菌试管12支,在第1、2管中分别加入各萃取药液0.5 mL,在第2管至第10管分别加人营养肉汤0.5 mL,用1 mL灭菌吸管从第2管开始管内倍比稀释药液至第10管,充分混匀后从第10管中弃去0.5 mL。第11管加营养肉汤1.5 mL,第1管至10管分别各加营养肉汤1.0 ml,第12管加2.0 mL;第1至11管各加菌悬液0.5 mL。第11管不加药液为阳性对照,第12管只加2.0 mL营养肉汤为阴性对照。充分混匀放置37℃恒温箱培养18~24 h。
MIC判断标准:37℃培养18~20 h后首先在观察阳性对照管长菌呈浑浊状,而阴性对照管不长菌、呈透明状的前提下,再观察其他试管的浑浊情况,以判断不同浓度药液的抑菌作用,如试管内呈浑浊,证明有细菌生长,用“+”表示;如试管内澄清透明,证明无菌生长,用“-”表示。以肉眼观不浑浊试管的最低药物浓度作为该药的MIC;若药液色素太深,从中取一环接种于营养琼脂平板上,培养后再进行观察。
2 结果与分析
2.1 耐药菌药物敏感试验
从表1结果来看,分离的大肠埃希菌不仅对临床常用的庆大霉素、诺氟沙星、阿莫西林产生耐药性,而且对近年应用于临床的氨曲南、环丙沙星等抗菌药物也呈现出耐药性。金黄色葡萄球菌多重耐药现象更为明显,所试药物中仅对万古霉素、头孢哌酮、亚胺培南敏感。
2.2 不同萃取物对产率的影响
依次用石油醚、乙酸乙酯及正丁醇进行萃取,分别减压浓缩各萃取物及萃余水相得4种萃取物。各萃取物产率水层(D)为最高,达 2.18%,正丁醇(C)、乙酸乙酯(B)、石油醚(A)分别为 1.55%、1.32%、0.98%,结果见表2。
2.3 抑菌圈直径药敏初筛
由表3可知,水相对金黄色葡萄球菌标准、耐药菌的抑菌圈直径分别为15.4 mm和16.5 mm,对大肠埃希菌的标准菌、耐药菌抑菌圈直径分别为14.2 mm和13.6 mm,表明抑菌效果显著。正丁醇相抑菌圈直径在10~12.8 mm之间,也有较强的抑菌作用。乙酸乙酯和石油醚抑菌圈直径小于10 mm,尤其是石油醚抗菌作用不明显,结果见表3。
2.4 萃取物MIC值测定
从表3中可以看出除石油醚萃取物外,其余3种萃取物对抑菌圈直径>8 mm,进一步作最低抑菌浓度测定。萃余水相对大肠埃希菌、金黄色葡萄球菌标准菌、耐药菌株的MIC分别为7.81、15.62、3.90、1.95 mg/mL。正丁醇相MIC除大肠埃希菌耐药菌为31.25 mg/mL外,其余均为15.62 mg/mL。乙酸乙酯MIC值低,仅显示微弱或无抑菌作用。MIC值与其相应抑菌圈大小的成一定的平行关系,结果见表4。

表1 2种临床分离菌株药敏试验结果Tab.1 Drugs resistant analysis of S.aureus and E.coli

表2 舟山野菊花不同萃取物产率Tab.2 Productivty of extraction in the inflorescence of C.indicum
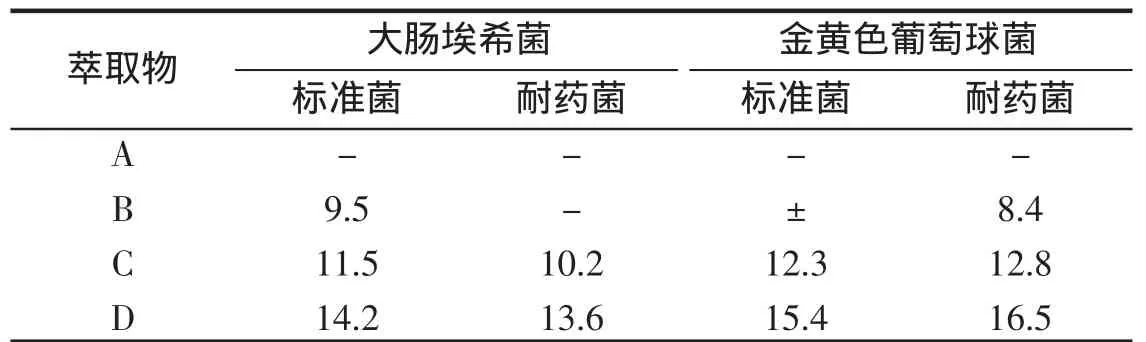
表3 舟山野菊花不同萃取物的抑菌圈直径(mm)Tab.3 Antimicrobial zone diameter of four extracts in the inflorescence of C.indicum
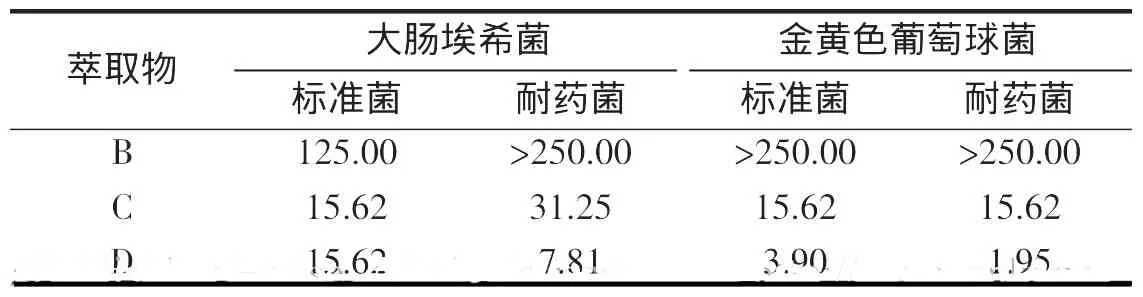
表4 舟山野菊花3种萃取物对细菌的MIC(mg·mL-1)Tab.4 MIC of three extract in the inflorescence of C.indicum
4 讨论
随着抗菌药物的广泛应用,人类误用、滥用抗菌药物的弊端也日益显现出来,不少细菌的耐药性正在逐年增加,尤其是大肠埃希菌、金黄色葡萄球菌对抗生素及其它化学合成抗感染药的耐药性非常显著[7-8],已成为临床最常见的感染病原之一,值得引起临床高度重视。本实验对临床分离的2株大肠埃希菌、金黄色葡萄球菌,分别进行药敏试验,呈现出多重耐药现象。
野菊花在中国民间有广泛用途,其对病原菌的抑制作用亦有报道[9]。本文对资源非常丰富,但开发利用甚少的舟山群岛野菊花,用不同极性的溶剂梯度分配萃取物首次进行抑菌研究。研究结果表明,舟山野菊花水、正丁醇相萃取物不仅对革兰氏阴性的大肠埃希菌、革兰氏阳性的金黄色葡萄球菌,而且对标准菌或耐药菌株都有较强的抑制作用。显示出抗菌作用强、抗菌谱较广、抗耐药性的特点。
从表3、4抑菌圈直径大小及MIC高低来看,抑菌效果显著的为产物C、D,产物B虽表现出一定的抗菌作用,但不是舟山野菊花主要抗菌活性成分。不同的溶剂可以提取出不同的抑菌活性物质,其抑菌效果也有差别。从本研究提取产物的溶剂组别研究来看,石油醚、乙酸乙酯、正丁醇极性顺序由小到大,从而得到不同极性的提取物。水相抑菌活性>正丁醇>乙酸乙酯相,抑菌活性与溶剂极性成正比,依据“相似相溶”规律,提示野菊花抑菌活性成分可能易溶解于极性强的溶剂中有关。据报道野菊花抑菌活性其主要为绿原酸、鞣质等,其中绿原酸是主要活性成分[10]。但关于野菊花抑菌机制研究较少,尚缺乏系统性、全面性,尚需进一步研究。本研究结果为舟山群岛野菊花开发和临床应用提供了依据。
[1]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1985:2 144.
[2]石兰萍,田琳琳,袁劲松,等.野菊花的研究概况[J].中西医结合心脑血管病杂志,2005,3(5):434-436.
[3]陈 猛,袁东星.微波萃取法研究进展[J].分析测试学报,1999,18(2):82-86.
[4]药理学实验编写组.药理学实验[M].北京:人民卫生出版社,1985:117-118.
[5]National Committee for Clinical Laboratory Standards.Method for dilution antimicrobial susceptibility test for bacteria that aerobically[S].Approved standard-fifth edition,2000.
[6]周邦靖.常用中药的抗菌作用及其测定方法[M].重庆:科学技术出版社重庆分社,1987:46-48.
[7]童国忠,石亚素,林奇龙,等.舟山海岛居民大肠埃希菌耐药性研究[J].浙江中医学院学报,2005,29(3):79-80.
[8]张 波,张晓兵,龚雅莉,等.4262株医院感染病原菌的分布及耐药性分析[J].中华医院感染学杂志,2008,18(3):418-421.
[9]曾 帅,王子寿,任永申,等.野菊花水煎液体外抗菌作用实验研究[J].中国中医急症,2008,17(7):971;1 032.
[10]凌伫怡,王 娟,沈 平.野菊花中绿原酸的微波辅助萃取研究[J].中草药,2008,39(1):60-62.
