体外感染实验探讨丙型肝炎病毒的ADE分子机制*
2010-06-08聂青和罗新栋黄晓峰张亚飞程勇前
聂青和 罗新栋 黄晓峰 张亚飞 程勇前
丙型肝炎病毒(HCV)在我国一般人群中的感染率约为3.2%。1991年后由于已对献血员常规进行HCV的筛检,使输血后丙型肝炎的发生率大为减少[1],但预防母婴间宫内、分娩时及产后感染HCV已成为当前及今后研究的重要问题[2]。现研究证实,HCV可经胎盘引起胎儿感染,宫内感染是HCV传播的一条重要途径。目前有关这方面的研究多数为流行病学调查,至于HCV如何在母婴间传播的分子机制研究报道还甚少[3]。理论上说,HCV经胎盘感染胎儿首先必须突破胎盘屏障的第一道防线,即滋养层细胞。近年来,国外学者在离体实验中发现人类免疫缺陷病毒(HIV)、流感A病毒、猫感染性腹膜炎病毒、柯萨奇病毒、登革热病毒等二十余种病毒在感染过程中存在抗体依赖的感染增强作用(ADE)[4]。HIV-1的ADE作用机制比较复杂,可能包括多种途径同时起作用,其中由FcγRⅢ(CD16)介导的进入滋养层细胞的ADE机制已经初步被证实。在HCV感染胎儿过程中是否也存在ADE作用机制?因而我们推测,HCV宫内感染存在同样的分子机制,其感染滋养层细胞需FcγRⅢ受体的非特异性介导。
材料与方法
一、主要试剂 Percoll细胞分离液为美国Pharmacia公司产品;免疫组织化学染色用ABC试剂盒及HCV RNA定性检测试剂盒购自华美公司;细胞角蛋白及波形蛋白抗体购自宝泰克公司;QIAmp viral RNA提取试剂盒为德国Qiagen公司产品;CD81和LDL-R鼠抗人单克隆抗体(McAb)均为Serotec公司产品。CD16鼠抗人单抗由本校免疫教研室欧阳为明博士惠赠;小鼠HCV NS5及NS3 McAb由北京大学人民医院魏来教授惠赠;小鼠HCV-C(CP10)McAb由第三军医大学西南医院郝飞教授惠赠;SPA-胶体金(5nm)购自武汉博士德生物技术公司。
二、引物 由宝生物(大连)有限公司合成。F外(493~518):5’-GCAACAGGGAACCTT CCTGGTTGCTC-3’,R外(987~964):5’-CGTAGGGGCCAGTTCATCATCATCATCAT-3’,F 内 (502 ~527):5’-AACCTTCCTGGTTGCTCTTTCTCTAT-3’,R 内 (957 ~952):5’-GTTCATCATC ATATCCCATGCCAT-3’,内引物扩增的cDNA长度为474bp。
三、HCV阳性血清 取自我科住院的丙型肝炎患者,经检测HAV、HBV、HDV、HEV标志物均阴性,抗-CMV、抗-EBV、抗-HIV均阴性;抗 HCV阳性,HCV RNA为2.1×106copies/ml。HCV基因分型为Ib型,患者尚未经抗病毒药物治疗。无菌采集血清,分装后-20℃冻存,用前经56℃、30min灭活补体。正常血清来自门诊体检人员,经检测 HAV、HBV、HCV、HDV、HEV标志物均阴性,抗-HIV阴性,肝功能正常。
四、体外细胞培养[5]取健康(血清HBV、HCV标志物均阴性,抗-HIV阴性,肝功能正常)妊娠6~10周孕妇新鲜流产胎儿胎盘组织。以Percoll等密度梯度沉降法纯化滋养层细胞,倒置显微镜下观察其生长特性,并采用ABC法检测细胞角蛋白、波形蛋白表达以对培养细胞进行鉴定。
五、体外细胞感染 将对数生长期的滋养层细胞弃去上清,分别用1ml抗HCV阳性血清和正常血清,置于37℃、CO2孵箱中培养2h,加入DMEM(不含小牛血清)3ml过夜。次日弃去上清,用1×PBS洗涤7次,再加入含10%小牛血清的完全DMEM培养液继续孵化2天,以透射电镜检测细胞内HCV颗粒。剩余的感染细胞重复感染1次,2天后进行免疫电镜法检测(采用包埋前反应法)[6]。另将4瓶滋养层细胞培养24小时后,留取上清待检。然后按照以下方式进行感染:(1)对照组:加入20%正常血清;(2)补体灭活组:加入20%HCV RNA阳性血清(经56℃、30min灭活补体);(3)CD16 McAb组:先以含 1:150 CD16 McAb的培养液与细胞在37℃培养箱内孵育1h,弃去,更换含HCV RNA阳性血清(未灭活)和20%高糖DMEM培养液;(4)全血清组:加入含HCV RNA阳性血清(未灭活)和20%高糖DMEM培养液。置于培养箱内37℃孵育24h后,以高糖DMEM培养液反复冲洗培养瓶内细胞5次,留取最后一次洗液待检。培养瓶内重新加入完全高糖DMEM培养液继续培养。感染后每3天收集培养上清和细胞,然后再加入新鲜培养液继续培养,保持培养液体积4ml。共观察21天,每次收集的上清和细胞立即提取RNA储存供检测用。
六、RNA提取及HCV RNA正链检测 将各组细胞置于培养箱内37℃孵育24小时后,以高糖DMEM培养液反复冲洗培养瓶内细胞5次。培养瓶内重新加入完全高糖DMEM培养液继续培养。感染3天后收集培养细胞,调整细胞浓度为1×106/ml,然后取细胞悬液200μl,用QIAmp viral RNA 提取试剂盒提取细胞内病毒RNA,操作步骤按说明书进行。然后收集病毒RNA,采用ROCHE Lightcycler荧光PCR检测仪定量检测(深圳匹基生物技术开发有限公司,拷贝数<102copies/ml为阴性)。
七、HCV RNA负链检测 检测材料为以上各组细胞提取的细胞内RNA和培养液上清RNA。取出冻存RNA,60℃水浴 5min以解聚。反应体系:RNA10μl、4dNTP2μl、AMV 逆转录酶 5 ×buffer4μl、RNasin1μl、AMV 逆转录酶 1μl、F 外 2μl混匀后,42℃保温 2h进行反转录反应生成cDNA。结束后95℃ 5min灭活AMV酶。第一次PCR循环:反应体系:cDNA2μl、F外、R 外各 1μl、4dNTP2μl、Taq 酶 10×buffer2μl、Taq酶 0.5μl、MgCL21.5μl、DEPC 纯水 10μl混匀后,滴加两滴液体石蜡,离心数秒钟,按下列参数进行扩增。预变性:95℃ 300s、94℃ 60s、56℃ 60s、72℃ 60s,共 35个循环,终延伸72℃ 300s;第二次PCR循环:反应体系:第一循环产物 2μl、F 内、R 内各 1μl、4dNTP2μl、Taq 酶 10×buffer2μl、Taq 酶 0.5μl、MgCL21.5μl、DEPC纯水10μl混匀后,滴加两滴液体石蜡,离心数秒钟,按下列参数进行第二次扩增。预变性:95℃ 300s、94℃ 60s、58℃ 30s、72℃ 60s,进行35个循环,终延伸72℃ 300s。各组细胞在感染后6天用细胞爬片同时进行HCV NS5、NS3和C区抗原的免疫组化检测,使用华美公司ABC试剂盒,按说明书步骤操作。
八、细胞内HCV包膜蛋白的免疫电镜检测 将PBS洗涤后的细胞1000r/min离心20min后,4%多聚甲醛和2.5%戊二醛混合液固定1h。加入1%Triton X-100(以 0.05mol/L TBS配制)37℃作用 10min;0.05mol/L TBS洗涤3次后加入1%牛血清白蛋白(BSA)37℃处理30min。感染组和对照组分别加入1:150的鼠抗HCV E2包膜蛋白多克隆抗体,置37℃1h。0.02mol/L TBS洗涤3次,再经1%BSA于37℃处理30min后,加入1:200胶体金标记羊抗鼠IgG,37℃作用1h。用0.02mol/L TBS洗涤10min,再用0.05mol/L PBS洗涤3次;加入1%BSA,2000r/m离心10min,弃上清。加入4%戊二醛使细胞固定成团,于LKBⅢ型切片机上做超薄切片(500埃),在本校电镜室透射电镜(日本Jeol公司JEM-100SX 型)下观察。
结 果
一、透射电镜观察 分离培养的滋养层细胞呈不规则多角形,核大,呈卵圆形,位于胞质近中央,胞浆丰富透明,细胞呈片状铺展生长。透射电镜下,可见培养的滋养层细胞外有大量的微绒毛,偶见包被陷窝,胞质中线粒体大而多,粗面内质网与糖原颗粒清晰可辩,还可见到电子密度高的脂滴。经鉴定培养的人绒毛膜滋养层细胞纯度超过95%。透射电镜下可见HCV感染的滋养层细胞内超微结构清晰,有明显的绒毛样突起,细胞核呈膜状结构包绕的电子密度较高区域。可明显分辨出胞浆中的线粒体、溶酶体等细胞器。部分细胞中有内质网扩张和空泡样变,有部分细胞胞浆内和内质网腔内可见病毒样颗粒,颗粒大小为50nm左右,表现为周围有电子密度较低的膜状结构包绕,中间有电子密度较高的物质(可能为其遗传物质),形状近圆形。还可以见到病毒进入细胞过程中形成的吞噬小泡,有的病毒样颗粒附近可见溶酶体聚集,同时溶酶体内也可见病毒样颗粒,可能反映了细胞对病毒的防卫作用。对照组细胞超微结构清晰,内质网等细胞器形态无改变,也未见有病毒样颗粒。
二、免疫电镜观察 免疫电镜下可见细胞内超微结构清晰,感染细胞胞浆表现与透射电镜相似,细胞内可见散在胶体金颗粒,细小的胶体金颗粒呈分散分布,也有胶体金颗粒呈簇状附着于病毒样颗粒邻近,提示胞浆中可能有HCV NS5抗原存在(图1)。有的胞浆内见电子密度大的金标颗粒,吸附于病毒样颗粒上,病毒样颗粒约为60μm(图2)。对照1组细胞内未见病毒样颗粒,对照2组细胞内可见病毒样颗粒,但无胶体金颗粒黏附。

图1 胞浆内散在胶体金及病毒颗粒

图2 胶体金颗粒附着于病毒表面
三、感染细胞HCV的存在 在培养21天时,可在全血清组的细胞内和上清液中间断测得HCV RNA正链;在补体灭活组、CD16 McAb组细胞内和上清液中均未检测到(表1、图3)。感染前培养液及感染后最后留取的洗液检测均为阴性。在培养21天时仅在全血清组的细胞内检测到2次HCV RNA负链,其余组均为阴性;各组培养上清中均未测到病毒核酸(表 2、图 4)。在全血清组可见到 NS3、NS5、C 区蛋白阳性信号,表达于胞浆中(图5),其余各组未见表达。

表1 细胞内和培养上清液HCV RNA正链的存在

表2 细胞内和培养上清液HCV RNA负链的存在

图3 细胞内HCV RNA正链的存在

图4 细胞内HCV RNA负链的存在
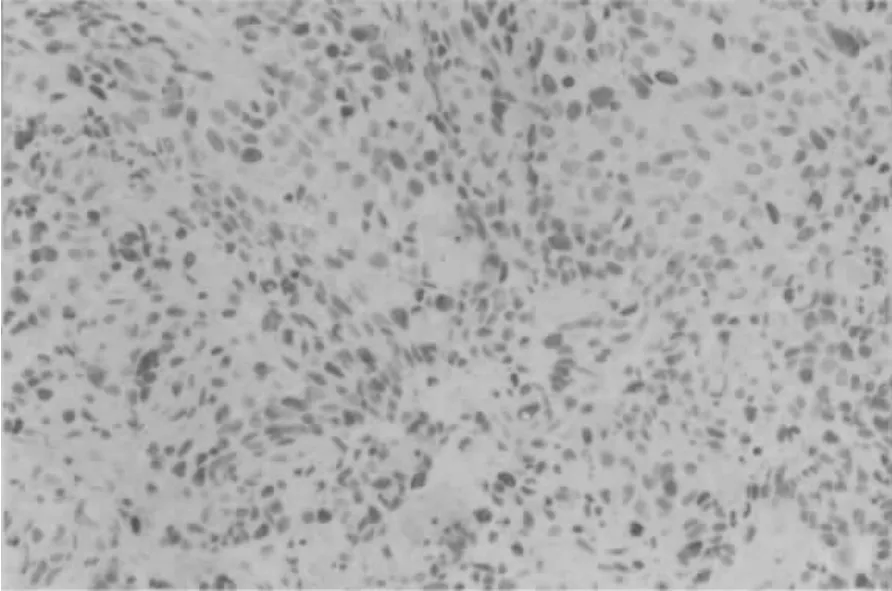
图5 全血清组细胞病毒蛋白的表达(ABC,×100)
讨 论
关于HCV颗粒形态,目前以日本Kaito的报道比较可信[8]。他们用兔抗HCV膜蛋白多克隆抗体为一抗,胶体金标记羊抗免IgG为二抗的间接免疫电镜技术,首次较清楚地显示了HCV形态。他们描述HCV直径为55~65nm,但陈良标等根据论文照片提供的标尺测量,病毒的实际大小是:含包膜的完整病毒直径为100~115nm,内含直径55~65nm圆球形核心或核壳体,核壳体表面6nm长的细钉状突起,可能是病毒核壳体的子粒结构。本研究参照国外学者用HCV感染体外培养细胞的方法,对滋养层细胞进行感染实验。我们采用电子显微镜技术直接观察转染细胞内HCV颗粒及细胞的超微结构改变,感染后的细胞胞质内存在许多病毒颗粒样结构,核心直径约为50nm左右,有明确的外膜和棘突,完整病毒颗粒直径约100nm左右。进行间接免疫电镜检测,发现病毒外膜有胶体金颗粒特异性标记,证明所见确为HCV颗粒。这也是判定HCV感染滋养层细胞是否成功的一个可靠标准。
近年来,病毒感染中的ADE作用越来越受到人们的重视。所谓ADE作用指抗体依赖的感染增强作用,即特异性抗体对病毒感染有促进作用。一般来说,机体产生的病毒抗体或者对病毒有中和及抵抗作用,或者是一些无中和作用的抗体,ADE则主要表现在有特异性抗体存在的情况下,病毒在体外培养的细胞中数量增多和(或)病毒感染的动物症状加重或出现早死现象,从而引起疾病的进展、导致疾病的进一步恶化及对疫苗的应用产生明显的影响。此时抗体多在中度水平或亚中和滴度水平与病毒形成病毒-抗体复合物,易感细胞具有Fc受体(FcR)或补体受体(CR)。最初ADE的发现仅仅局限于抗体,随后发现不仅抗体而且抗体及补体的复合物,甚至单纯补体同样有增强作用。故现在该定义实际上为一种泛指的、与补体及抗体相关的、增强病毒感染的作用。
经血液或血制品传播是HCV的主要传播途径,但在HCV感染者中只有约50%的人有血及血制品暴露史或其它可确认的传染途径,进一步研究表明还存在其它非经血液传播途径。随着对血制品检测的加强及检测技术的提高,HCV经输血传播的发生率已大大降低[9],而对HCV存在的母婴传播途径开始重视起来。我们曾用荧光定量PCR技术检测HCV感染孕妇羊水,结果发现羊水中HCV RNA阳性率极低,仅为5.9%。提示羊水传播不是HCV母婴传播的主要途径[10]。从早期接触、长期持续接触等特点分析,理论上讲HCV经胎盘感染的可能性最大。
近年来,有关IgG穿越胎盘具体机制的研究取得了很大的进展。在胎盘绒毛组织中FcγRⅢ(CD16)仅分布于胎盘屏障的最外层,即滋养层细胞层。推测IgG穿越胎盘屏障通过如下分子机制模式:即由滋养层细胞上的FcγRⅢ介导IgG最初的内吞活动,在酸化内吞体中,IgG可从受体中释放,释放的IgG与位于内吞体表面的hFcRn特异性结合,通过胞吞转运作用而至合胞体滋养层细胞碱性一侧,IgG从hFcRn上解离,进入毛细血管内皮,由位于毛细血管内皮上的FcγRⅡ介导,最终进入胎儿血液[11,12]。
已有报道表明,在母体内的HIV-1病毒与其抗体形成复合物,然后由滋养层细胞表面的FcγR介导复合物内化,从而导致胎盘细胞的病毒感染,机制属于经典的ADE形式之一[13]。因此,HCV的母婴传播很可能与之相似。
本实验结果初步证实,在HCV感染滋养层细胞的过程中存在ADE现象。而缺乏补体或者应用CD16单克隆抗体则明显影响HCV进入滋养层细胞,免疫组化实验不能发现HCV NS5、NS3及C区抗原的表达,说明抗体和补体均参与HCV的跨膜转运过程,但是两者的主次关系未明,也可能是单独的2种ADE途径。在全血清感染细胞检出HCV RNA负链,说明HCV能在滋养层细胞中复制,ADE可能起了增强作用。最近有关ADE研究结果表明,病毒经过Fc R-ADE进入细胞,可以通过抑制抗病毒基因的表达而增强复制,这也属于增强的感染结果。HCV感染细胞后21天在细胞内外均不能检出HCV RNA正、负链。由于患者的抗体仅仅是定量检测,所以本实验中HCV抗体滴度与HCV的ADE现象关系不明确,而且参与ADE的补体种类也有待进一步查明。滋养层细胞也并非HCV的靶细胞,HCV感染及复制均较困难。因而我们推测,HCV宫内感染存在同样的分子机制,其感染滋养层细胞不需要已知HCV感染特异性靶受体(CD81分子和LDLR分子)的介导,而仅需FcγRⅢ受体的非特异性介导。本实验初步证实了我们的科研课题设想。
ADE给HCV疫苗研制带来了新的研究课题[14]。HCV进入滋养层细胞时ADE的准确分子机制,以及如何经过内化作用跨膜转运,进入细胞后是否抑制宿主抗病毒基因的表达等,均有待进一步深入研究阐明。
[1]罗新栋,聂青和,何云,等.检测抗-HCV IgG κ/λ 轻链比值及其临床意义[J].中国医师杂志,2004,6:32-36.
[2]SHEBL FM,EL-KAMARY SS,SALEH DA,et al.Prospective cohort study of mother-to-infant infection and clearance of hepatitis C in rural Egyptian villages[J].J Med Virol,2009,81;1024-1031.
[3]聂青和.丙型肝炎病毒母婴感染研究及其预防现状[J].世界华人消化杂志,2005,13;1257-1262.
[4]VILLINGER F,MAYNE AE,BOSTIK P,et al.Evidence for antibody-mediated enhancement of simian immunodeficiency virus(SIV)Gag antigen processing and cross presentation in SIV-infected rhesus macaques[J].J Virol,2003,77:10-24.
[5]程勇前,聂青和,周永兴,等.人胎盘滋养层细胞的分离培养及IgGFcγRⅢ在人胎盘组织中的表达[J].医学研究生学报,2002,15:105-107.
[6]程勇前,聂青和,周永兴,等.人滋养层细胞分离培养及HCV体外感染试验 [J].第四军医大学学报,2002,23:1544-1547.
[7]ZINI N,SOLIMANDO L,CINTI C,et al.Single and double colloidal gold labeling in postembedding immunoelectron microscopy[J].Methods Mol Biol,2004,285:161-169.
[8]程勇前,聂青和,周永兴.丙型肝炎病毒超微结构研究进展[J]. 世界华人消化杂志,2003,11:233-237.
[9]聂青和,李梦东,胡大荣,等.HCV感染后机体保护性免疫缺陷原因探讨[J].世界华人消化杂志,2000,8:28-30.
[10]聂青和,王平忠,周永兴.丙型肝炎病毒感染孕妇羊水中丙型肝炎病毒RNA检测的临床意义[J].中华妇产科杂志,2002,37:19-21.
[11]FENG HM,WHITWORTH T,VSEVOLOD P,et al.Effect of antibody on the Rickettsia-host cell interaction[J].Infect Immunol,2004,72:3524-3530.
[12]GETAHUN A,DAHLSTROM J,WERNERSSON S,et al.IgG2a-mediated enhancement of antibody and T cell responses and its relation to inhibitory and activating Fc gamma receptors[J].J Immunol,2004,172:5269-5276.
[13]BEGEMANN M,POLICAR M.Pneumococcal vaccine failure in an HIV-infected patient with fatal pneumococcal sepsis and HCV-related cirrhosis[J].Mt Sinai J Med,2001,68:396-399.
[14]聂青和,罗新栋.丙型肝炎疫苗研究及面临的挑战[J].世界华人消化杂志,2004,12:2405-2409.
