反义Waxy基因共转化籼型杂交稻亲本的初步研究
2010-06-08赵严伟
程 鹏 ,刘 清 ,彭 琼 ,赵严伟 ,龚 晓
(1.湖南农业大学植物激素与生长发育湖南省重点实验室,湖南 长沙 410128;2.湖南省作物种质创新与资源利用重点实验室,湖南 长沙 410128)
常规育种与生物技术育种相结合是作物育种的发展趋势[1]。根癌农杆菌介导的水稻转基因研究始于20世纪90年代初。转化籼稻体系的优化有诸多报道,Aldemita等[2]转化籼稻,其稳定转化率仅在1%~5%之间。由于籼稻基因型较多,影响转化率的因素较为复杂,从而增大了籼稻转化技术的复杂性。本研究着重探讨不同激素配比、菌液浓度、侵染时间、潮霉素敏感性等因素对农杆菌共转化籼型亲本的影响,以期能与前人的研究结果互为补充,建立一个转化率高、稳定性好的农杆菌共转化体系,并利用此体系获得有价值的转基因植株。
1 材料与方法
1.1 试验材料
籼型杂交稻亲本(Oryza Sativa L.subsp indica)II32B由湖南农业大学水稻科学研究所提供。工程质粒pCAMBIA1300(简称p1300,仅含抗潮霉素抗性基因),p13w8(仅含反义蜡质基因)均由上海植物生理生态研究所提供。
1.2 培养基配置
愈伤组织诱导和分化的培养基:基本培养基是NB培养基,即N6培养基的大量元素,B5培养基的微量元素和有机附加物,添加酶解酪蛋白500 mg/L,脯氨酸 500 mg/L,琼脂粉 8 g/L,蔗糖 30 g/L,pH 5.8。按表1添加不同浓度的2,4-D、NAA、KT和6-BA,观察愈伤组织的生长状态并统计诱导率和分化率。共转化所用的其他培养基配方如表2所示。
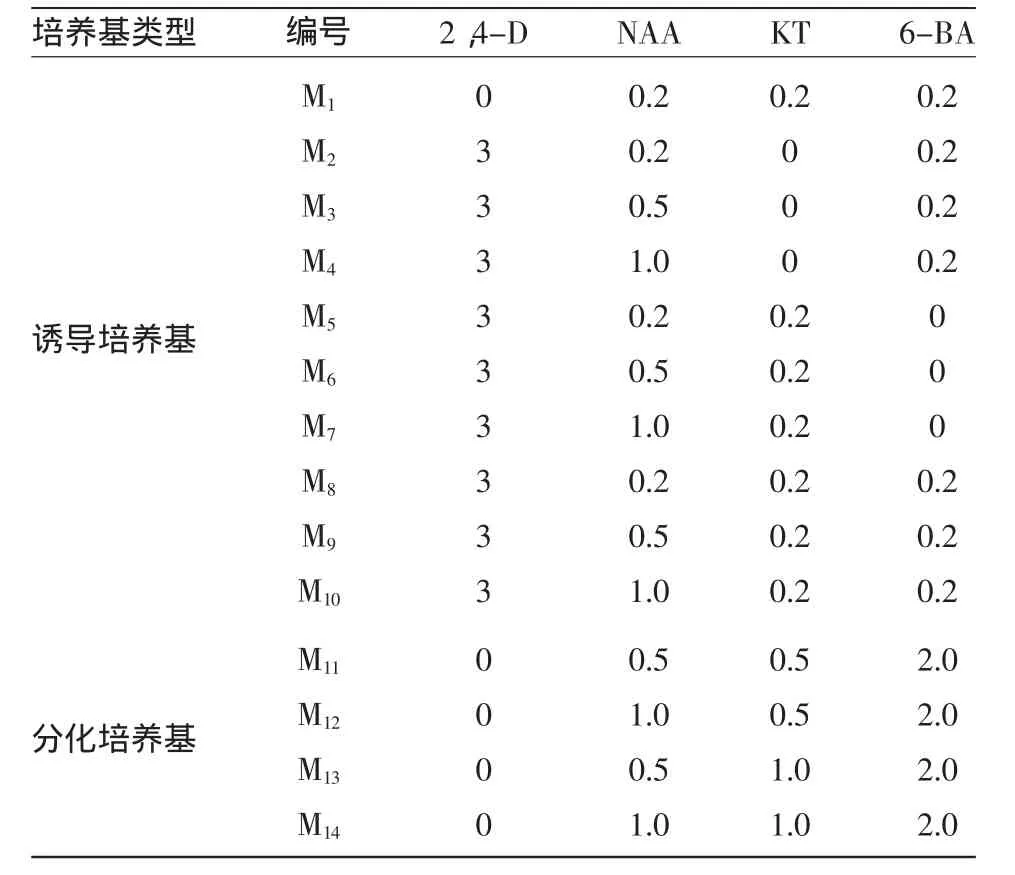
表1 愈伤组织诱导和分化培养基中植物激素类物质的组合 (mg/L)

表2 共转化所用培养基
1.3 水稻愈伤组织的诱导和继代培养
将水稻种子去壳,每200粒种子为1个处理,依次用70%乙醇浸泡5 min,0.1%升汞浸泡8 min,1%次氯酸钠处理35 min消毒;无菌水冲洗6~8次,接种到诱导培养基上,27±1℃下暗培养5~10 d诱导愈伤组织,待胚芽长到1 cm,严格挑选质量好的无菌胚性盾片愈伤组织继代数次。
1.4 农杆菌菌液浓度和侵染时间
根癌农杆菌培养参照Hiei等[3]的方法。将质地、大小和生理状态基本一致的愈伤组织分两组处理:第1组农杆菌菌液OD600值分别为0.4、0.6、0.8、1.0和1.2,侵染10 min;第2组菌液 OD600值0.8,分别侵染2、5、10、15和20 min。经共培养后统计和比较不同处理的愈伤组织状态,然后经筛选培养,统计愈伤组织污染率和存活率,确定最佳的农杆菌菌液浓度和侵染时间。
1.5 潮霉素筛选浓度的确定
以成熟胚愈伤组织为材料,在选择培养基中分别加入 0、10、20、30、40 、50 mg/L 的潮霉素(Hyg),每处理3皿,3次重复,20 d后统计愈伤组织的存活率。
1.6 转化植株的DNA提取和PCR检测
取水稻植株叶片0.1 g,按照Edwards[4]的方法提取基因组DNA,检测p13W8引物为W8P1(5’-CTC TCGGAGAGGTTCAGCTG-3’)和 W8P2(5’-ATGAT AATCATCGCAAGATC-3’),PCR 反应条件为 94℃预变性 2 min,然后 94℃变性 35 s,55℃退火 30s,72℃延伸30 s,循环30次,PCR产物大小为450 bp。检测 p1300 引物为 Hyg1(5’-GCTTCTGCGGGCGATTT GTGT-3’)和 Hyg2(5’-GGTCGCG AGGCTATGG AT GC-3’),PCR反应条件为94℃预变性5 min,然后94℃变性 45 s,58℃退火 45 s,72℃延伸 1 min,循环30次,PCR产物大小为598 bp。
2 结果与分析
2.1 不同植物激素类物质的组合对愈伤组织诱导和分化的影响
培养基中激素的种类和配比,对愈伤组织的形成和分化起决定作用。供试材料II32B在M8培养基中愈伤组织诱导率最高(图1)。从外形上看,这些愈伤组织比较致密、较硬,呈颗粒状结构较多;而在没有添加2,4-D的培养基中愈伤组织诱导率极低;在分化培养基中加入1.0 mg/L NAA、0.5 mg/L KT和2 mg/L 6-BA,分化率达25.6%~31.4%。资料显示[5-6],2,4-D 是诱导愈伤组织最有效的物质,通过调节细胞分裂周期蛋白的合成,控制脱分化和细胞分裂重新启动;2,4-D与作用缓和的NAA联合,再配合一定浓度的细胞分裂素,既有利于细胞的持续分裂,又促进后期苗的分化。因此,在诱导培养基和继代培养基中附加NAA、KT和6-BA可以改进愈伤组织质量,从而提高再生频率。

图1 不同植物激素类物质的组合对愈伤组织诱导的影响
2.2 农杆菌菌液浓度和侵染时间对愈伤转化频率的影响
农杆菌菌液浓度和侵染时间对转化频率的影响很大,菌液浓度过高或侵染时间过长,都会导致受体死亡,很难得到转化体。菌液浓度过低或侵染时间过短,不能让足够的农杆菌附着于受体愈伤组织,大大降低转化频率。从表3可以看出,OD600值为0.8时,II32B愈伤存活率最高,约为28.7%,筛选培养时农杆菌污染转少;OD600值超过1.2时死亡愈伤数增多,并且筛选培养时出现农杆菌污染,大量的农杆菌覆盖在愈伤组织上抑制其生长。
从表4可以看出,侵染时间10 min时,转化体产生的频率较高,侵染时间延长至15~20 min时,较难获得转化体。侵染时间2 min时,获得的抗性愈伤数较侵染10 min明显减少。因此,供试材料II32B适宜的农杆菌菌液浓度OD600为0.8,侵染时间为10 min。
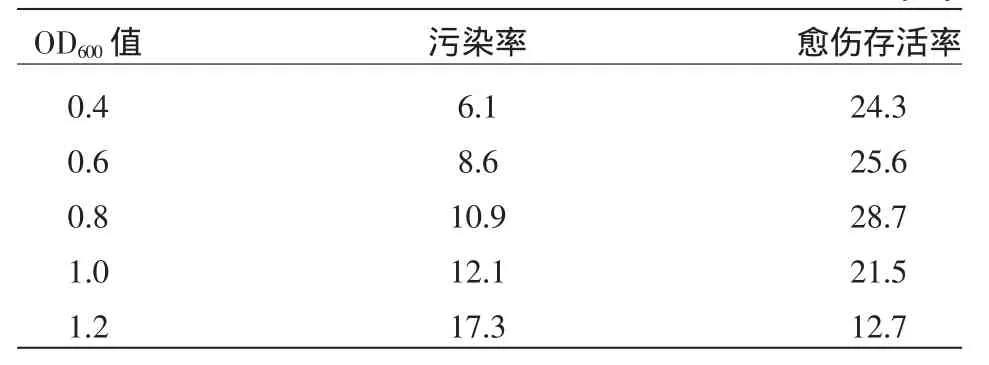
表3 农杆菌菌液浓度对水稻愈伤组织遗传转化的影响 (%)
2.3 潮霉素敏感性试验
在对转化愈伤组织进行抗性筛选时,如果Hyg浓度过高会造成愈伤组织迅速死亡,而细胞在死亡过程中会分泌大量次生代谢物质,使转化细胞的生长受到抑制,影响转化效率;而Hyg浓度太低则不能有效的抑制非转化愈伤组织生长,容易使非转化细胞逃逸。对II32B成熟胚诱导的愈伤组织进行敏感性试验表明,较低浓度的Hyg能抑制其生长,Hyg浓度达到40 mg/L时愈伤组织褐化严重,50 mg/L时愈伤组织褐化致死。图2结果表明比较理想的Hyg筛选浓度为30 mg/L。
2.4 转基因植株的鉴定
采用共转化方法获得再生植株71株,PCR检测表明,有43个样品检测到598 bp的抗潮霉素抗性基因片段,占再生植株总数的60.6%。有8个样品检测到450 bp的反义蜡质基因片段(图3),占再生植株总数的11.2%。反义蜡质基因检测为阳性的植株,潮霉素抗性基因的PCR检测也为阳性,这表明本研究获得了含有反义蜡质基因的转基因植株。
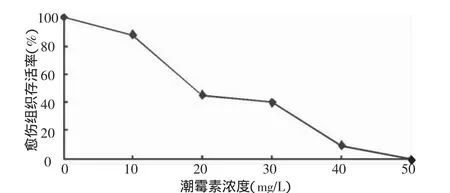
图2 不同浓度潮霉素对愈伤组织成活率的影响
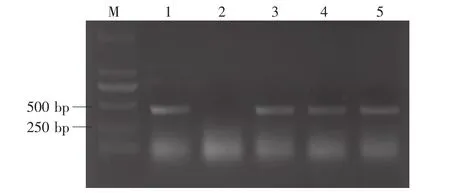
图3 再生植株中反义蜡质基因的PCR检测
3 讨论
农杆菌共转化法是一个细菌和愈伤组织共同作用的复杂过程。凡是涉及到细菌活性或愈伤组织状态的因素都可能影响转化效果。本研究试图从转化前不同激素配比来改进愈伤组织质量、转化中菌株状态、侵染时间等转化过程本身因素以及潮霉素筛选浓度等方面来探讨其对转化率的影响,取得了较为理想的效果。应用此转化体系,获得了转基因植株,转化率较常规转化方法有了显著的提高,但是研究表明农杆菌转化水稻的影响因素纷繁复杂,要建立一个转化率高、稳定性好、通用性强的水稻农杆菌共转化体系还需要深入系统的研究。
[1] 袁隆平.超级杂交稻研究.上海:上海科学技术出版社,2006.
[2] Aldemita R R,Hodges T K,Agrobaeterium tumefaeiens mediated transformation of Japonica and Indiea rice varieties[J].Planta,1999(4):612-615.
[3] Hiei Y,Ohta T,Komari T,et a1.Efficient transformation of rice mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA[J].Plant J,1994,6:271-282.
[4] Edwards K,Johnstone C,Thompson C.A simple and rapid method for the preparation of plant genomic DNA for PCR analysis.Nucleic Acids Research,1991,1(6):1349.
[5] 刘庆昌,吴国良.植物组织细胞培养[J].北京:中国农业大学出版社,2003,21-62.
[6] 张献龙,唐克轩.植物生物技术[M].北京:科学出版社,2004,21-33.
