宁夏枸杞潮霉素抗性浓度筛选研究
2022-07-14樊云芳刘露露张晶罗青张波曹有龙
樊云芳 刘露露 张晶 罗青 张波 曹有龙
摘要:研究旨在探索适合枸杞的潮霉素筛选剂量,为枸杞基因功能的研究、遗传转化提供参考。以宁夏枸杞无菌苗叶片为外植体,设置4个潮霉素浓度梯度,研究其对诱导愈伤组织和愈伤组织诱导分化芽的影响,以选出适合枸杞转化体筛选的抗生素剂量。结果表明,随着潮霉素浓度的升高,其对枸杞诱导愈伤组织和愈伤组织诱导芽分化的抑制作用加强。潮霉素浓度越高,枸杞叶片的出愈率越低,愈伤组织的褐化率越高,且叶片逐渐变黄、白化甚至死亡。将潮霉素作为抗性选择标记时,抗性浓度以2 mg/L为最佳。
关键词:宁夏枸杞;潮霉素;抗性浓度;选择标记;遗传转化
中图分类号:Q789文献标志码:A论文编号:cjas2020-0017
Screening on Hygromycin Resistance Concentration of Lycium barbarum
FAN Yunfang1, LIU Lulu2, ZHANG Jing1, LUO Qing1, ZHANG Bo1, CAO Youlong1
(1Lycium Engineering Technology Research Center, Ningxia Academy of Agricultural and Forestry Sciences, Yinchuan 750002, Ningxia, China;2Natural Resources Bureau of Longde County, Guyuan 756300, Ningxia, China)
Abstract: This study aims to explore the screening dose of hygromycin suitable for Lycium barbarum, and lay a foundation for the study of gene function and genetic transformation of L. barbarum. In this study, the leaves of germless L. barbarum seedlings from Ningxia were used as explants, and four hygromycin concentration gradients were set to study the effect of hygromycin on the induction of callus and callus differentiation buds, to screen out the appropriate antibiotic dose for L. barbarum transformation body screening. The results showed that the increased concentration of hygromycin had a significant inhibitory effect on the induced callus and bud differentiation of L. barbarum. The higher the concentration of hygromycin, the lower the recovering rate of L. barbarum leaves was, and the browning rate of callus increased, and the leaves gradually became yellow, albino, and even died. Using hygromycin as a selective marker for resistance, the optimal concentration of hygromycin is 2 mg/L.
Keywords: Lycium barbarum; hygromycin; resistance concentration; selected marker; genetic transformation
0引言
寧夏枸杞(Lycium barbarum)属茄科(Solanaceae)枸杞属(Lycium)多年生落叶灌木,是宁夏的特色植物资源,为宁夏“五宝”之首。与其他物种相比,枸杞的遗传转化研究起步较晚,到目前为止虽然取得了一定的进展[1-5]但仍然落后于其他物种。对潮霉素的筛选剂量未见报道。
在植物基因工程研究中,快速、有效地从大量转化体中筛选出含有外源目的基因的转化体是成功获得转基因植株的关键[6]。为筛选出阳性转化体植株,需要用到抗生素筛选、除草剂筛选和β-葡萄苷酸酶(GUS)染色反应筛选等诸多筛选方法,其中抗生素筛选是较为常见的方法之一。潮霉素(Hygromycin B,HygB)是一种常用的抗性筛选药物,其抗性基因(潮霉素磷酸转移酶基因htp)表达产物是一个蛋白激酶,通过磷酸化潮霉素B使其丧失活性[7]。遗传转化中转化细胞具备了潮霉素磷酸转移酶活性,能忍耐较高浓度潮霉素的毒性,转化细胞的生长和分化受影响较小,叶绿体和线粒体蛋白质呈正常的绿色,而非转基因植株由于缺乏潮霉素磷酸转移酶基因,表现为植株绿色器官黄化或死亡,因此潮霉素可以明显区分转化组织与未转化组织[8-9]。由于潮霉素Hyg在真原核生物中拥有较好的重复性和较短的筛选时间等优点,所以被广泛地应用在植物研究中[10-17]。笔者对潮霉素的不同浓度筛选效果进行研究,以期为基因的功能研究、潮霉素在枸杞遗传转化中的应用提供参考。
1材料与方法
1.1试验时间、地点
试验于2019年4—12月在宁夏农林科学院枸杞工程技术研究所组织培养实验室进行。
1.2试验材料
枸杞种子采摘于宁夏农林科学院枸杞工程技术研究所资源圃。
MS培养基粉、琼脂粉、蔗糖、6-BA(苄基腺嘌呤)、NAA(萘乙酸)、AS(乙酰丁香酮)、利福平、硫酸卡那霉素(Kan)、LB固体培养基(干粉)、LB液体培养基(干粉)、羧苄青霉素二钠盐(carb)、潮霉素(hyg)、DMSO。所用试剂均为分析纯级别,其中MS培养基粉采购于青岛日水生物技术有限公司,蔗糖采购于国药集团化学试剂有限公司,其余均采购于索莱宝生物科技有限公司。
枸杞共培养基为MS+6-BA0.5mg/L+NAA1mg/L+琼脂7 g/L+蔗糖30 g/L+AS 2 mg/L;枸杞愈伤培养基为MS+琼脂7 g/L+蔗糖30 g/L+6-BA 0.5 mg/L+NAA 1 mg/L+hyg+carb 500 mg/L;枸杞分化培养基为MS+琼脂7g/L+蔗糖30g/L+6-BA0.4mg/L+NAA0.02mg/L+ hyg+carb 500 mg/L;枸杞生根培养基为MS+琼脂7 g/L+蔗糖30 g/L+NAA0.04 mg/L+hyg+carb 500 mg/L。
1.3主要仪器
超净工作台(型号SW-C5-2F,输出功率300 W)、D-1型自动蒸汽灭菌锅、紫外灯、离心机、pH计、风光光度计、人工气候箱、电子天平、4℃冰箱、电热恒温鼓风干燥箱、50 mL无菌离心管、150 mL无菌三角瓶、无菌滤纸、无菌培养皿、镊子、手术刀。
1.4试验方法
1.4.1无菌苗的培养用NaClO:H2O体积比1:3的溶液浸泡枸杞种子,在摇床轻摇40 min,取出用无菌水冲洗3遍,滤出种子,用滤纸吸干,在超净工作台中播种于MS培养基上,于25℃、光照16 h/天、光照强度2000 lx培养箱中培养21天获得枸杞种子苗,叶片用于后续侵染再生体系。
1.4.2潮霉素对叶片愈伤组织形成的敏感性试验在苗龄为20天左右的生根试管苗上选取平展的叶片,切去叶柄和叶边缘,切成0.5 cm×0.5 cm的方块,将切好的叶片用镊子放入MS培养基活化的农杆菌菌液(OD600= 0.5)浸染10 min后,接种到共培养基上,进行暗培养3天。
将共培养3天的叶片分别转到不同潮霉素浓度的培养基上,潮霉素浓度分别设为2、4、6、8 mg/L 4個梯度,每个梯度设置3个重复处理,每个培养皿接种15个叶片,叶片背面朝下,在25℃、12 h/12 h、光照度1500~ 2000 lx的条件下培养。接种后连续观察,观察叶片愈伤组织诱导的状况以及叶片的生长情况,统计叶片诱导出愈伤组织的个数和叶片死亡的个数,计算出愈率、存活率、污染率和褐化率以及玻璃化的情况,如式(1)~(4)。
1.4.3潮霉素对愈伤组织诱导分化的敏感性试验将诱导的愈伤组织接种到设有不同潮霉素浓度的分化培养基上。共设置2、4、6、8 mg/L 4种处理,每组接种5瓶,每瓶接种2个愈伤组织。接种后观察并统计各处理组愈伤组织诱导芽分化的情况,观察并记录其分化芽的叶色、生芽数、芽色、芽长势。

2结果与分析
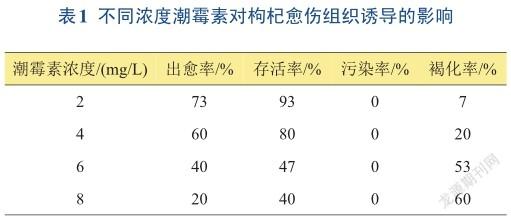
2.1不同潮霉素浓度对枸杞愈伤组织诱导的影响
由表1可知,当潮霉素浓度为2 mg/L时,枸杞愈伤组织出愈率、成活率最高,褐化率最低,无污染和玻璃化现象;当潮霉素浓度为8 mg/L时,出愈率、成活率最低,褐化率最高,无污染和玻璃化现象。
由图1可知,当潮霉素的浓度为2 mg/L时,枸杞叶片愈伤组织生长较多,且诱导所产生的愈伤组织为绿色并有绿色的生长芽点;当潮霉素的浓度升至4 mg/L时,枸杞叶片出愈率降低,诱导产生的愈伤组织颜色呈浅绿色,叶片部分变黄,出现褐化;当潮霉素的浓度升至6 mg/L时,枸杞叶片愈伤组织明显减少,出愈率开始大幅降低,叶片已大部分出现白化死亡;当潮霉素的浓度升至8 mg/L时,枸杞叶片愈伤组织基本没有,叶片呈淡绿色,大部分出现褐化死亡的现象。
从以上结果可以得出,不同浓度潮霉素对枸杞愈伤组织有一定影响,对枸杞叶片诱导愈伤组织有明显的抑制作用。随着潮霉素浓度的提高,出愈率降低,枸杞叶片逐渐变黄,褐化,甚至死亡。枸杞叶片诱导愈伤组织的潮霉素抗性筛选浓度以2 mg/L为最佳。

2.2不同潮霉素浓度对枸杞愈伤组织诱导芽分化的影响
由表2可知,枸杞叶片愈伤组织诱导芽分化,当潮霉素浓度为2 mg/L时,其叶色呈现黄绿色,生芽数较多,生芽率为20%,芽色为浅绿色,芽长势弱;当潮霉素浓度为4 mg/L时,其叶色呈现淡黄色,生芽数较少,生芽率为2%,芽色为白色芽点,芽长势基本不生长;当潮霉素浓度为≥6 mg/L时,其叶色多白化,变黄,直到死亡。

由图2可知,当潮霉素的浓度为2 mg/L时,枸杞叶片愈伤组织诱导的分化芽较多,其芽色和叶色都较正常;当潮霉素的浓度升至4 mg/L时,枸杞叶片愈伤组织诱导的分化芽较少,且芽色呈浅绿色有轻微变紫现象。
可以看出,潮霉素对枸杞叶片愈伤组织诱导芽分化起抑制作用。随着潮霉素浓度的升高,枸杞叶片愈伤组织诱导芽分化率降低。在将潮霉素作为抗性选择标记时,枸杞叶片直接诱导芽分化再生苗的潮霉素筛选浓度为2 mg/L。
3结论与讨论
潮霉素经常被用做遗传转化体系中的抗生素筛选剂,在许多单子叶植物(如水稻[18]、大麦[19]、棉花[20]、玉米[21]、谷子[22]等)的科研试验中得到广泛的应用,同时也应用于双子叶植物在基因转化过程中,比如黑杉、针叶类、花生、菊花、黑刺槐、大豆、黄梁木等[23]。王哲等[24]用潮霉素作为烟草遗传转化筛选剂时使用浓度为5~ 20 mg/L。任永霞等[25]在番茄和菊花的遗传转化时使用潮霉素,浓度分别15、15~20 mg/L。王丹等[1]研究将潮霉素作为杨树遗传转化筛选剂,以山新杨、欧美杨和小黑杨的叶片为材料,山新杨、欧美杨进行分化的潮霉素适宜浓度为2.0 mg/L,小黑杨为3.0 mg/L;当以杨树的不定芽作为研究材料,生长和生根时山新杨和小黑杨的敏感浓度为2.0 mg/L,欧美杨为1.0 mg/L;当以茎段为材料,其生长和生根时山新杨和小黑杨的敏感性为6.0 mg/L,欧美杨2.0 mg/L。本试验中确定枸杞无菌苗叶片诱导愈伤组织和愈伤组织诱导芽分化对潮霉素抗性标记较合适的筛选浓度为2 mg/L。上述所得结论说明,不同的材料对潮霉素产生影响的浓度不同,对同一材料的不同部位产生的敏感性也不同。应用农杆菌介导植物,在转化之前应对不同的外植体进行选择压力筛选,找出既能有效抑制非转化细胞生长又对转化细胞影响较小的筛选剂敏感浓度,既能降低假阳性又能减少转化苗的损失,获得较高的转化效率[2-3]。
由本试验结果可以看出,枸杞遗传转化过程,潮霉素作为筛选剂时所用的剂量要比其他抗生素低很多,本研究枸杞潮霉素的选择剂量为2 mg/L,而卡那霉素选择剂量为50 mg/L[4]。说明潮霉素对植物细胞的伤害要远大于卡那霉素,植物对其更敏感。愈伤组織诱导芽分化时,剂量4 mg/L时芽几乎不生长,2 mg/L时芽长势比较弱,说明后期诱导芽分化时,潮霉素的剂量可能需要更小一些。在敏感性筛选试验中,浓度跨度设置要小一些,这样可能更准确。
另外,为了提高转化率,所选用的外植体都较幼嫩,抗性较弱,而潮霉素对植物的毒性很强,所以在加入筛选剂潮霉素时,加入的质量浓度要稍低于筛选出的选择压力,避免造成抗性芽的死亡。转化过程中选择剂加入的时间也很关键,选择压力(即筛选剂)加得太迟或太少,可能会使非转化细胞分裂分化,致使假转化体的比例增高,给转基因工作(如转基因植株或组织的鉴定)增加额外的工作[26]。

参考文献
[1]薛定磊.枸杞遗传转化体系建立及FT转基因植株的获得[D].北京:中国科学院大学,2015:4-7.
[2]曲玲,曹有龙,罗青,等.转基因枸杞研究中的问题探究[J].宁夏农学院学报,2001,22(2):25-27.
[3]马俊,吴祖河,唐劲天.宁夏枸杞的转基因研究进展[J].安徽农业科学,2013,41(10):4262-4263.
[4]罗青,曲玲,曹有龙,等.抗蚜虫转基因枸杞的初步研究[J].宁夏农林科技,2001(1):1-3.
[5]朱永兴,曹鹏,许兴,等.多基因表达载体KCTB转化宁夏枸杞的研究[J].中国农学通报,2010,26(9):74-77.
[6]王丹,邹莉,王义,等.杨树对潮霉素的敏感性研究[J].吉林农业大学学报,2010,32(1):47-50.
[7]OLHOFT P M, FLAGEL L E, DONOVAN C M, et al. Efficient soybean transformation using hygromycin B selection in the cotyledonary-node method[J]. Planta,2003,5:723-735
[8]王坚,李永玲,刘炜.潮霉素B在遗传转化中应用的研究进展[J].宁夏农林科技,2017,58(12):36-43.
[9]李东杰.植物生长调节剂对黑果枸杞愈伤组织诱导、增殖及分化的影响[J].河北林业科技,2016(4):1-5.
[10]蔡莹.农杆菌介导的玉米茎尖遗传转化及优化[J].辽宁大学学报, 2015(42):186-189.
[11]王宏伟,王宏伟,吕颖颖,等.农杆菌介导法将抗草甘膦基因转入玉米自交系[J].玉米科学,2013(3):24-28.
[12]渠柏艳,于海清,韩兆雪,等.可去除选择标记的转Bt基因抗虫玉米研究[J].分子植物育种,2004,2(5):649-653.
[13]于海清,渠柏艳,付凤玲,等.可去除选择标记的转CpTl基因抗虫玉米研究[J].玉米科学,2005,13(3):44-46.
[14]张洪,马俊,胡国成,等.用叶片检测转基因水稻对潮霉素反应的可靠性研究[J].浙江农业学报,2005,17(6):341-345.
[15]刘巧泉,陈秀花,王兴稳,等.一种快速检测转基因水稻中潮霉素抗性的简易方法[J].农业生物技术学报,2001,9(3):264.
[16]殷奎德,张兴梅,郑桂萍,等.一种快速检测转基因水稻潮霉素抗性标记的方法[J].黑龙江八一农垦大学学报,2010,22(1):45-48.
[17]康海岐,申国安.水稻愈伤组织对不同培养基的适应性、潮霉素的敏感性及其在遗传转化中的利用[J].中国生物工程杂志,2009(10):50-54.
[18]杨歧生,颜秋生,金小平,等.抗潮霉素B的水稻原生质体的再生[J].浙江大学学报,1996,30(5):583-588.
[19]李静雯,张正英,王立光,等.大群体转基因大麦后代快速筛选研究[J].甘肃农业科技,2019(8):12-17.
[20]楚敏,张丽娟,徐建辉,等一种以潮霉素为筛选标记的新疆早熟陆地棉筛选体系的建立[J].新疆农学,2015,52(7):1285-1291.
[21]赵姝华,张世萍,王富德.玉米、水稻种子及转Bt基因水稻种子对抗生素的抗性检测.[J].国外农学-杂粮作物,1997(4):30-32.
[22]王节之,郝晓芬,郑向阳,等.谷子潮霉素抗性浓度的筛选与研究[J].华北农学报,1990,14(4):60-62.
[23]黄浩,韦莹,翟勇进,等.黄梁木遗传转化受体系统对筛选物敏感性研究[J].四川农业大学学报,2020,38(1):58-64.
[24]王哲,孙敬克,王世祥,等.烟草潮霉素抗性浓度的筛选与研究[J].河南城建学院学报,2009,18(4):65-67.
[25]任永霞,季静,王罡,等.番茄子叶、茎段及菊花愈伤组织对潮霉素敏感性的研究[J].河北北方学院学报,2006,22(2):19-33.
[26]王晓春,刘尚前,王罡,等.菊花对潮霉素敏感性研究[J].安徽农业科学,2008,36(10):3948-3949.
