LEN-5型β-内酰胺酶基因的克隆及原核表达
2010-06-07卢月梅张阮章胡玉华钟运华武学成陈升汶王沙燕
卢月梅,张阮章,胡玉华,钟运华,武学成,陈升汶,王沙燕
随着抗生素的大量使用,病原菌产生多种耐药机制以逃避抗生素的攻击。β-内酰胺类抗生素是临床上用得最多的抗生素,产生β-内酰胺酶是细菌对该类抗生素耐药的最重要和最常见的机制。由于β-内酰胺酶编码基因的突变,导致新型β-内酰胺酶的不断出现。LEN-5为本研究组首次发现于深圳市人民医院临床分离株的β-内酰胺酶(GenBank登录号为AY790341)〔1〕。为了进一步研究酶的特性,本研究对LEN-5基因进行原核表达。现报告如下。
1 材料和方法
1.1 材料
1.1.1 菌株和质粒 含LEN-5质粒由深圳市人民医院临床分离株中获得;pET26b(+)表达载体购于默克公司、大肠杆菌DH5α、大肠杆菌 BL21(DE3)购自上海生工,SHV-1型标准产酶菌由陈民均教授惠赠。
1.1.2 主要试剂 PCR引物由Invitrogen公司合成,限制性内切酶 Nde I、Xho I、T4连接酶、高保真Pfu DNA聚合酶为Fermentas公司产品、胶回收试剂盒为QIAgen公司产品、异丙基硫代-β-D半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、质粒提取试剂盒为BBI公司产品;Nitrocefin购自基因公司,两性电解质载体凝胶(pH3~10)为Bio-Rad公司产品。等电点标准(pH 3~10)为Amersham公司产品。凝胶纯化试剂盒(QIAquick Gel Extraction kit)为 QIAgen公司产品。
1.2 方法
1.2.1 PCR扩增LEN-5基因 根据LEN-5编码基因序列(gb|AY790341)设计PCR引物并分别引入Nde I和Xho I酶切位点。正向引物:5 -ATTGTGCATATGCGT TATATTCGCCTGTGTATTAT(划线为 Nde I酶切位点),反向引物:5 -ATACTGCTCGAGGCGTTGCCAGTGCTCGATC(划线为 Xho I酶切位点)。以含LEN-5基因的质粒DNA为模板进行 PCR反应。PCR反应条件为:95℃5min,接着 94℃45s、58℃45s、72℃60s,共 30个循环,72℃延伸 10min。目的PCR产物为879bp。设大肠埃希菌ATCC25922为阴性对照,SHV-1型标准产酶菌为阳性对照。PCR扩增产物经1%琼脂糖凝胶电泳,溴化乙锭染色,用凝胶成像系统观察结果并照相。
1.2.2 pET-26b(+)/LEN-5重组质粒的构建和鉴定 LEN-5扩增产物和pET-26b(+)质粒分别用Nde I、Xho I双酶切,经琼脂糖凝胶切胶纯化,用T4连接酶于16℃连接过夜后,转化感受态大肠杆菌DH5α,再将转化菌涂布于含卡那霉素(浓度30μ g/mL)的 LB平板上,于 37℃培养过夜,挑取单菌落扩增培养,提取质粒,予酶切电泳鉴定,并对插入质粒载体中的目的片断进行DNA测序。待确证插入片断为目的基因后,将重组质粒转化感受态大肠杆菌BL21(DE3),用含卡那霉素的LB平板上进行筛选。该方案使重组的LEN-5基因在pET-26b(+)质粒T7启动子的控制下,形成6×His的融合蛋白。
1.2.3 重组大肠杆菌BL21(DE3)的诱导 挑取确证的重组菌单菌落于5 mL LB培养基中,37℃、150 r/min振荡培养过夜,吸取1mL加至30mL LB培养基中,37℃振荡培养,当菌体密度生长至OD600为0.6时,加入诱导剂IPTG至终浓度为1.0 mmol/L,37℃振荡4 h后,离心收集细胞并悬浮于0.01 mmol/L的磷酸盐缓冲液(pH7.0)1.5mL中,冰浴中超声破碎,参数为:750W,振幅 35%,处理2,间隔5s,共 8min。裂解液 13 000 r/min,4℃离心 30 min,上清液为β-内酰胺酶粗提液。上清液用头孢硝噻吩(Nitrocefin)检测活性,如果细菌裂解液能使黄色头孢硝噻吩(Nitrocefin)变为红色,表明细菌表达有活力的酶。
1.2.4 等电点的测定 为了避免6×his标签对β-内酰胺酶等电点的影响,针对基因序列重新设计反向引物,使反向引物位于终止密码子之外,引物为5-ATACTGCTCGAGCCAGTCATATCGCCCGGCAC(划线为Xho I酶切位点),与上述正向引物配对重新对PCR产物进行克隆和表达(方法同上),表达产物用于等电点的测定,取β-内酰胺酶粗提液2μL,与等电点标准品同时进行电泳,用Model III Mini IEF Cell电泳仪(BIO-RAD公司)进行等电聚焦电泳,电泳条件如下:先100V电泳15min。之后增加电压到200V电泳 15min。最后450V电泳60min。电泳结束后先用头孢硝噻吩(nitrocefin)染色,测量条带至阳极的距离,再用考马斯亮蓝染色,测各PI标准条带至阳极的距离并绘制标准曲线,根据标准曲线计算β-内酰胺酶LEN-5的等电点(PI)。
2 结 果
2.1 LEN-5基因PCR扩增 PCR产物经琼脂糖凝胶电泳显示在约 800~900bp位置出现一条带(图1),与引物设计的扩增片段基本吻合(图1)。
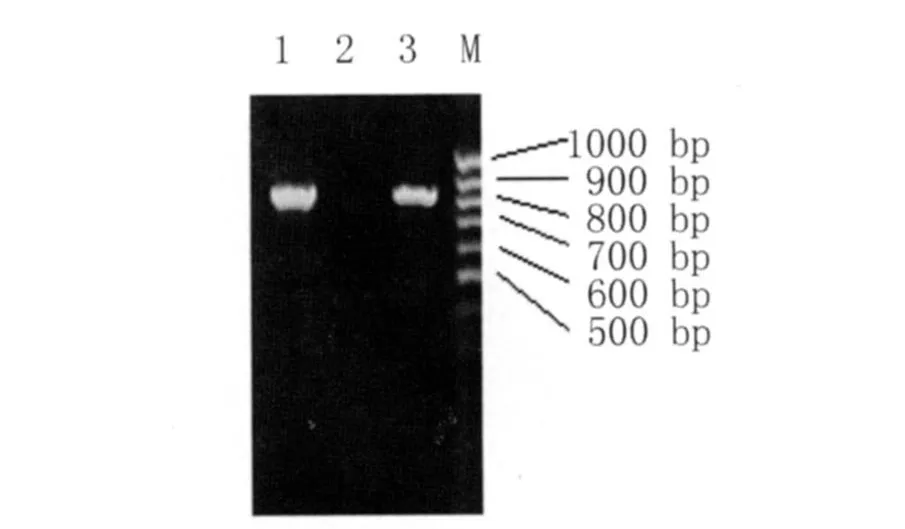
图1 LEN-5基因PCR产物电泳图Fig.1 electropherogram of LEN-5 gene PCR amplification
2.2 pET26b(+)/LEN-5重组质粒的鉴定和表达由重组DH5α大肠杆菌中提取重组质粒pET26b(+)/LEN-5,经 Nde I和Xho I双酶切后得到861 bp和5230 bp两条片段(图2),对插入的目的基因的测序结果与预期序列完全一致,表明LEN-5基因已成功克隆。BL21(DE3)重组菌经诱导后,取 2μL重组菌裂解液加入1μL头孢硝噻吩(1 mmol/L)中,几秒钟后头孢硝噻吩由黄变红,而转入空质粒的阴性菌裂解液不能使之变色,确证重组质菌构建成功,且其表达产物具有酶活力。
2.3 LEN-5等电点的检测 根据等电点(pI)标准蛋白各条带与阳极的距离,应用SPSS软件13.0进行线性回归,以条带与阳极的距离为自变量(X),pI为因变量(Y),获得回归方程Y=0.024X+4.86,根据表达产物与阳极的距离算出PI为7.6(图3)。
3 讨 论
LEN 型 β-内酰胺酶由 Yoshichika等〔2〕在 1986年首次报道,他们从一株肺炎克雷伯菌株(LEN-1)染色体DNA中克隆出一种β-内酰胺酶基因,发现它可导致菌株对氨苄青霉素耐药,因此将该β-内酰胺酶称为LEN-1。研究显示LEN-1属于A类,2 a组β-内酶胺酶,主要由肺炎克雷伯菌染色体基因编码产生,其编码基因产生的蛋白质含279个氨基酸,等电点为7.1。与质粒介导的 TEM-1 β-内酰胺酶的氨基酸序列同源性为 67%〔2〕。

本次研究的LEN-5型酶与LEN-1差异较大,如LEN-5含286个氨基酸,其等电点为7.6,两者氨基酸序列同源性为96.2%〔1〕。氨基酸序列的差异可导致β-内酰胺酶特性的变化,为了获得高产量、高纯度的β-内酰胺酶以便进一步分析酶的特性,本实验选用PET-26b(+)质粒对LEN-5基因进行了克隆及原核表达,表达产物为带6×His标签的融合蛋白,带这种His标签的融合蛋白方便了下游的纯化,通过亲和层析法可获得高纯度LEN-5酶。由于一株细菌可同时产生多种β-内酰胺酶〔3-4〕,与天然产酶菌相比,应用基因工程技术表达该酶可以避免多种β-内酰胺酶的相互干扰 ,更确切地研究该β-内酰胺酶的性质。PET-26b(+)/LEN-5表达载体的成功构建和表达,为进一步研究酶动力学以及其它特性奠定了基础。
〔1〕Chen SW,Zhang RZ,Lu YM,et al.A novel LEN-derived β-lactamase from K lebsiela pneumoniae〔J〕.Chin Med J,2005,118(16):1380-1383.
〔2〕Arakawa Y,Ohta M,Kido N,et al.Close evolutionary relationship between the chromosomally encoded β-lactamase gene of K lebsiella pneumoniae and the TEM-1β-lactamase gene mediated by R-plasmids〔J〕.FEBS Lett,1986,207(1):69-74.
〔3〕卢月梅,陈升汶,何林,等.呼吸道产ESBLs分离株耐药基因的研究〔J〕.中国微生态学杂志,2004,16(6):340-341.
〔4〕Tofteland S,Haldorsen B,Dahl K,et al.Effects of phenotype and genotype on methods for detection of extended-spectrum-βlactamase-producing clinical osolates of Escherichia coliand K lebsiella pneumoniae in Norway〔J〕.J Clin Microbiol,2007,45(1):199-205.
