一种新型转基因斑马鱼毒物检测系统的建立
2010-06-05纪喜文,田雪,徐殿胜
斑马鱼(Brachydaniorerio),遗传背景清楚、繁殖周期短、产卵过程可人为控制、怀卵量大、体外受精、胚胎透明便于观察,因此被广泛应用于胚胎学、发育生物学、毒理学、分子生物学等研究,是理想的分子生物学和免疫学研究的脊椎动物模型,也是四大模式生物之一[1]。
斑马鱼的转基因研究始于1988年,此后进展迅速。目前转基因技术已成熟,因而斑马鱼成为鱼类基因工程中基因同源重组、基因表达调控和基因功能研究的理想材料,斑马鱼卵母细胞体外成熟、配子发生和受精的调控机制、胚胎干细胞的分离、基因克隆及基因敲除等都已成为研究热点[2,3]。据报道,有3种方法利用转基因斑马鱼检测环境有害化学物:一种是利用携带了整合高拷贝数量的大肠杆菌穿梭载体的斑马鱼来测试环境诱变剂[4];第二种方法利用标记转基因斑马鱼,其荧光或荧光素酶受到某种启动调控元件的诱导,而这种启动调控元件又受到不同的环境污染物如芳烃、重金属或环境雌激素的影响[5];第三种是利用组织限制的荧光标记鱼来筛选对其特定发育途径产生特别作用的环境毒素。
绿色荧光蛋白(Green fluorescent protein,GFP) 是20 世纪90 年代中期发展起来的一种全新的报告分子,它不需要任何外源性底物和辅助因子,无毒、稳定、无污染,可以在UV或蓝光激发下直接观察,而且能在多种异源细胞内表达,被誉为“活细胞探针”。GFP作为报告基因,在转基因动物研究中应用广泛。

1 实验
1.1 材料
1.1.1 质粒和菌株
芳香烃反应元件AHRDtk和pFRMwg+plasmid 载体,自行收藏。DH5α感受态细胞,博大泰克。
1.1.2 斑马鱼
野生型斑马鱼购自青岛水族商店,在实验室于28℃ 淡水中培养,调节12 h明/12 h暗的光照周期,使之产卵,收集受精卵,培养于胚胎培养液或者驱除氯气的无菌自来水中,根据Kimmel 等的斑马鱼发育时期进行分期。
1.1.3 主要试剂
胚胎培养溶液、胚胎固定液,自制。
限制性内切酶、T4 DNA连接酶、PCR相关试剂等,Takara;RNase A,Merck。
1.1.4 PCR引物与测序
PCR引物与测序均由上海生工完成。
1.2 方法
1.2.1 目的片段扩增
在PCR引物末端设计好酶切位点,上游引物中引入AflⅡ内切酶位点,下游引物中引入SacⅠ位点,以AHRDtk片段为模板扩增目的片断。
1.2.2 重组载体构建
用AflⅡ和SacⅠ双酶切pFRMwg+plasmid 载体,胶回收并纯化500 bp大小片段。将AHRDtk目的片段克隆至pFRMwg+plasmid 载体,构建重组载体。将其转化至DH5α感受态细胞,涂板培养过夜后挑出阳性克隆。
1.2.3 阳性克隆的鉴定
分别用AflⅡ和SacⅠ双酶切、PCR和DNA序列测定的方法对阳性重组子进行鉴定。
1.2.4 显微注射
将筛选鉴定出的阳性重组子显微注射至斑马鱼受精卵,经过胚胎繁殖并筛选可稳定遗传的斑马鱼。
2 结果与讨论
2.1 AHRDtk目的片段的扩增
胶回收AHRDtk目的片断,电泳鉴定结果见图1。DNA Marker DL2000分别由片段(从大到小)2000 bp、1000 bp、750 bp、500 bp、250 bp和100 bp组成。
由图1可知,扩增出约425 bp的目的片段,在1、2两种退火温度(分别为60℃和64℃)下,扩增效率明显不同,因此选择退火温度2(64℃)作为最佳实验条件。
2.2 pFRMwg+plasmid 载体双酶切
用AflⅡ和SacⅠ双酶切pFRMwg+plasmid 载体,得到500 bp大小的片段,胶回收纯化大片段。pFRMwg+plasmid载体酶切电泳鉴定结果见图2。
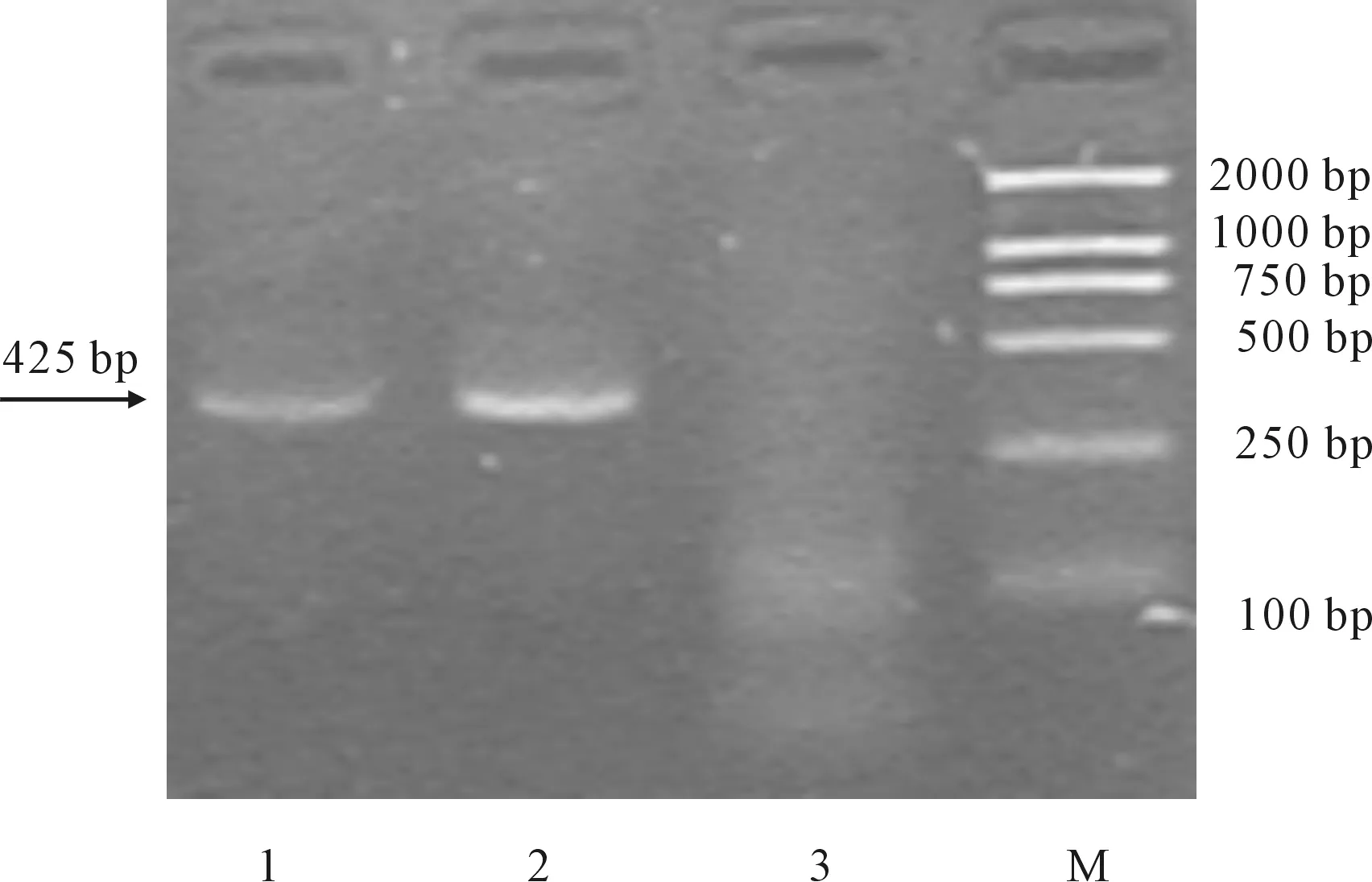
M.DL2000 1.60℃的扩增 2.64℃下的扩增 3.阴性对照
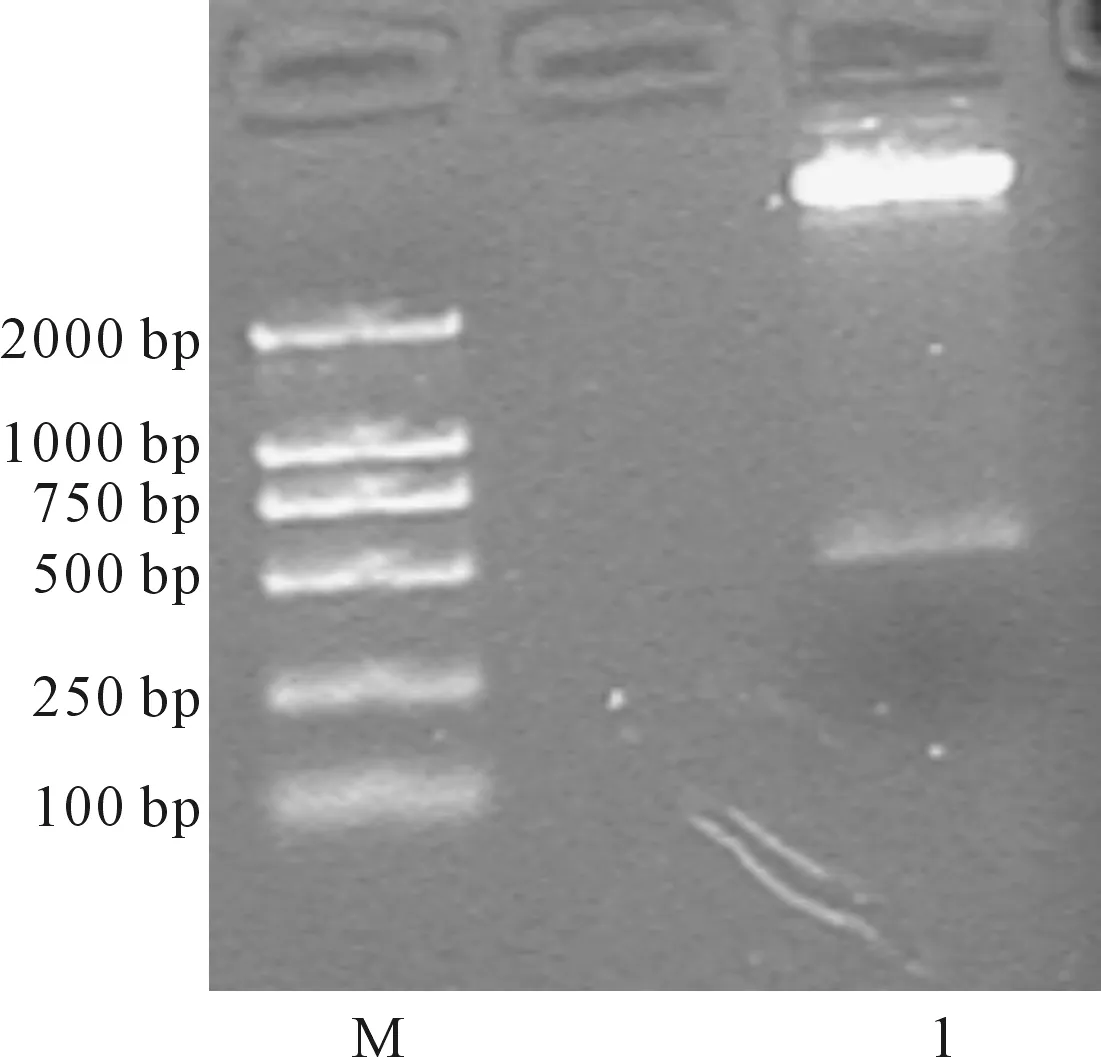
M.DL2000 1.双酶切片段
2.3 筛选重组子
用T4 DNA连接酶连接纯化的AHRDtk目的片段和pFRMwg+plasmid 载体双酶切的产物,然后用AflⅡ和SacⅠ两种限制性内切酶双酶切来鉴定重组子,鉴定结果见图3。
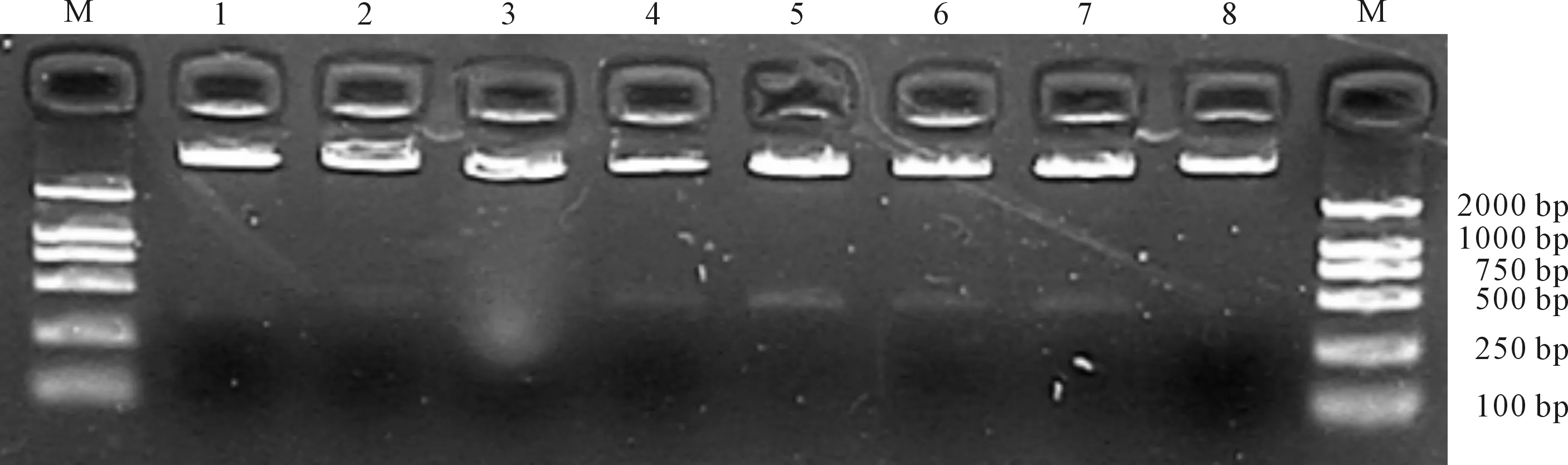
M.DL2000 1~8.重组子
由图3可知,5#、7#为阳性重组子。
2.4 PCR鉴定重组子
对于双酶切鉴定的阳性重组子(5#、7#)进行PCR鉴定,模板是质粒 AHRDtkLUC3,鉴定结果见图4。
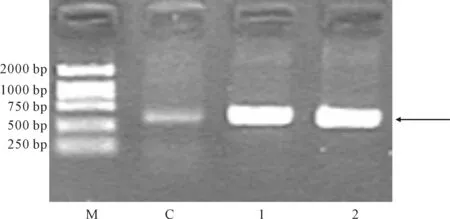
M.DL2000 C.对照 1.5#重组子 2.7#重组子
2.5 DNA 序列测定
AHRDtk序列:
GGATCCCCTGAGGCTAGCGTGCGTAAGCCTGCTCCATCCTCTGGGGGCAG
AGGTCGGGCTGCCTGTCTCCGCCCCACCTGGCTGGGGACAAGGTGCCCCG
GAGTTGCGTGAGAAGAGCCTGGAGGCCCGCGCAGCCACCCAGCTACCCA
ACTCACAACCGGGCGCGGGTCCCAGTGCTGTCACGCTAGCTGGGGGAGGG
GAACCGTGGGTGAGGCTCTTAAGGGGATCGAGCTCTTACGCGTGCTAGTC
TAGATTCGAACACGCAGATGCAGTCGGGGCGGCGCGGTCCGAGGTCCACT
TCGCATATTAAGGTGACGCGTGTGGCCTCGAACACCGAGCGACCCTGCAG
CGACCCGCTTAACAGCGTCAACAGCGTGCCGCAGATCTGCGATCTAAGTA
AGCTT
DNA序列测序正确,大量制备载体DNA,用于转化斑马鱼卵。
2.6 显微注射载体DNA,传代筛选得到受AHRE元件控制的GFP转基因斑马鱼

2.7 讨论
本研究构建的转基因斑马鱼报告系统,利用AHRDtk元件响应TCDD污染物,调控绿色荧光蛋白(EGFP)的表达,因此斑马鱼体内EGFP的表达反映了AHRDtk元件的活性,从而可以反映水环境中的TCDD污染状况。当水环境中含有TCDD时,这些物质与转基因斑马鱼中的AHRDtk顺式作用元件结合,启动EGFP基因的表达,通过荧光显微镜能观察到转基因鱼出现绿色荧光;而当水环境中不含TCDD时,EGFP不能被激活,不能观察到转基因鱼的绿色荧光。因此,这种转基因鱼可用于TCDD类污染物的水环境检测。
本研究采用显微注射的方法获得转基因斑马鱼,为提高胚胎的存活率和获得第一代转基因鱼的总效率,需要用保证DNA 最佳纯度的标准方法制备线形DNA片断。转基因整合的效率取决于注射的DNA 浓度,而卵的存活能力与DNA 浓度则呈相反的关系[8]。因此,需在胚胎存活与整合效率之间寻求平衡兼顾。控制注射到细胞的DNA量是通过DNA 浓度而不是注射DNA 溶液的体积来调节。为代偿注射到大体积的细胞质导致DNA 的稀释、使注射的DNA 进入细胞核达到适当的概率,而同时也使注射后的胚胎维持令人满意的存活率,DNA通过微量移液管反填装入注射针。注意不要引入气泡,以免干扰DNA的流速。
一般认为,外源基因在受精卵中的整合发生在胚胎的晚期,原肠末期之前胚胎的核酸酶系统发育不完善,外源基因的复制速度大于降解速度,大量的外源基因积累在胚胎内[9];原肠末期之后,外源基因的数量逐步减少,最终只有少量整合到基因组。如果外源基因在原肠末期之前表达,会产生过量的外源蛋白,干扰胚胎的正常发育,可导致高死亡率。所以转基因斑马鱼的荧光稳定性,与其表达时期、表达量相关。转基因斑马鱼体内积聚一定的毒素后就会发光,不过目前的转基因斑马鱼发出的光还比较微弱。
3 结论
利用转基因技术成功建立了一套绿色荧光蛋白(GFP)转基因斑马鱼毒物检测系统。选用AHRDtk片段和pFRMwg+plasmid 载体,通过酶切、连接和PCR鉴定等程序成功构建载体DNA,然后通过显微注射转入斑马鱼,经不断传代和筛选得到稳定的受芳香烃反应元件AHRE控制的转基因斑马鱼,可用于水环境中毒物的检测。
参考文献:
[1] Cooper M S,D′Amico L A,Henry C A.Analyzing morphogenetic cell behaviors in vitally stained zebrafish embryos[J].Methods Mol Biol,1999,122:185-204.
[2] Herbomel P,Thisse B,Thisse C.Ontogeny and behaviour of early macrophages in the zebrafish embryo[J].Development,1999,126(17):3735-3745.
[3] Cole L K,Ross L S.Apoptosis in the developing zebrafish embryo[J].Dev Biol,2001,240(1):123-142.
[4] Amanuma K,Tone S,Saito H,et al.Mutational spectra of benzo a pyrene and MelQx in rpsL transenic zebrafish embryos[J].Mutat Res,2002,513(1-2):83-92.
[5] Vitozzi L,De Angelis G.A critical review of comparative acute toxicity data on freshwater fish[J].Aquat Toxicol,1991,19(3):167-204.
[6] Ensenbach U,Nagel R.Toxicity of complex chemical mixtures:Acute and long-term effects on different life stages of zebrafish[J].Ecotoxicol Env Saf,1995,30(2):151-157.
[7] Carvan M J,Dalton T P,Stuart G W,et al.Transgenic zebrafish as sentinels for aquatic pollution[J].Ann N Y Acad Sci,2000,919:133-147.
[8] Li Li,Zhang Shi-cui,Wang Rui,et al.Cloning of zebrafish:Development of non-enucleated unfertilized eggs provided with nuclei from blastula cells[J].High Technology Letters,2000,10(7):24-27.
[9] Chen S L,Hong Y H,Schartl M.Development of a positive-negative selection procedure for gene targeting in fish cells[J].Aquaculture,2002,214(1-4):67-69.
