T-2毒素人工抗原的制备
2010-06-05徐娟,洪淑娟,付建英等
T-2毒素(T-2 Toxin)是一种真菌毒素,属于单端孢霉烯族化合物中的A族,是该类化合物中毒性最强的毒素之一,主要由三线镰刀菌、梨抱镰刀菌、拟枝抱镰刀菌和木贼镰刀菌等霉菌产生。T-2毒素为白色针状结晶,熔点150~151℃,难溶于水,易溶于极性溶剂,如三氯甲烷、丙酮和乙酸乙酯等。烹调过程不易将其破坏。分子式为C24H34O9,分子量为466。基本结构为四环的半倍萜,C-9和C-10位上有不饱和双键,在紫外灯下不显荧光。T-2毒素的分子结构见图1[1]。
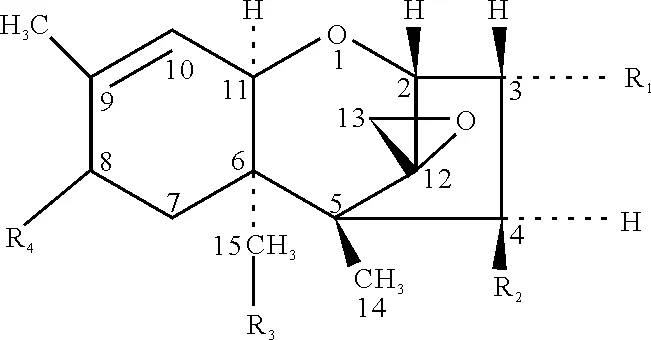
R1=OH R2=R3=OAc R4=OCOCH2CH(CH3)2
目前国内外T-2毒素的检测方法有很多种,其中TLC法用目测半定量,灵敏度不高,不适于检测大量样品,选择性和敏感性也低,近年来应用较少。LC、GC是定量的检测方法,结果准确可靠,但检出限较高,且所用仪器设备较为昂贵。ELISA法是一种准确、可靠、快速、特异的检测方法,适合于大量样品的快速筛选。为了开发ELISA法,必须首先制成 T-2毒素抗原 。目前,国外合成T-2完全抗原的常用方法主要包括琥珀酸酐(HS)法 、戊二酸酐(HG)法和羧甲基肟(CMO)法[2],其中羧甲基肟法试剂较贵,琥珀酸酐法和戊二酸酐法比较常用。作者在此对琥珀酸酐(HS)法做了改进,成功合成了T-2毒素完全抗原,为获得T-2毒素单克隆抗体奠定了基础。
1 实验
1.1 试剂及仪器
牛血清白蛋白(Bovine serum albumin,BSA)、卵清白蛋白(Ovalbumin,OVA)、T-2毒素、碳二亚胺(EDPC),Sigma公司;琥珀酸酐(HS),中国医药集团上海化学试剂公司;GF254,青岛海洋化工厂;羟甲基纤维素钠(CMCNa)、二甲基酰胺(DMF)、三氯甲烷、甲醇、无水乙醇、乙酸乙酯、氯化钠、无水碳酸钠、碳酸氢钠,国药集团化学试剂有限公司。
CO2恒温培养箱(气套式),Binder;振荡器,海门其林贝尔仪器制造有限公司;酶标板(96孔),金灿华实业有限公司;紫外分光光度计、小型高速离心机,德国Eppendorf;超净工作台,哈尔滨东联;核酸电泳仪,六一仪器厂;Alpha Imager 2200型凝胶成像系统,美国Alpha Innotech Corporation;ELX800型酶标仪,美国Bio-Tek公司;Astell高压灭菌锅,Mettler。
1.2 T-2HS的制备
参照文献[3],将2 mg T-2毒素和42 mg琥珀酸酐置于0.8 mL吡啶中,在蒸气浴中反应4 h。然后将反应混合物于氮气下吹干干燥,再溶于适量氯仿。用蒸馏水洗 4次,将氯仿抽提物蒸发干燥,得T-2HS,用TLC法[以乙酸乙酯∶ 丙酮∶甲醇 (50∶50∶1)为展开剂]检测。
1.3 T-2BSA偶联物的制备
将2 mg T-2HS用0.2 mL二甲基甲酰胺(DMF)溶解,制得A液;将5 mg BSA、3 mg EDPC加25 mL蒸馏水溶解,制得B液;将A液逐滴加入B液中,边加边搅拌,10 min后,加1 mg EDPC,室温、pH值5.5条件下继续搅拌18 h,然后用PBS溶液(0.01 mol·L-1,pH值7.2)透析3 d,每天换液一次。透析后,分装冷冻干燥保存。
1.4 T-2OVA偶联物的制备
将2 mg T-2HS用0.2 mL二甲基甲酰胺(DMF)溶解,制得A液;将5 mg OVA、3 mg EDPC加25 mL蒸馏水溶解,制得B′液;将A液逐滴加入B′液中,边加边搅拌,10 min后,加1 mg EDPC,室温、pH值5.5条件下继续搅拌18 h,然后用PBS溶液(0.01 mol·L-1,pH值7.2)透析3 d,每天换液一次。透析后,分装冷冻干燥保存。
1.5 偶联比的计算
对于大分子和小分子的偶联物,由于两种分子均有各自不同的最大紫外吸收峰,根据波长叠加原理,偶联物应有不同的紫外吸收峰,且在最大吸收峰波长处的吸光度值与其相应的浓度成比例,但在偶联物的紫外扫描光谱中,则表现为各自的光谱图呈叠加性质。该法操作简单且无样本损耗[4]。实验所用 T-2HS的浓度为 1 mg·mL-1,BSA和OVA浓度均为1 mg·mL-1。T-2BSA和T-2OVA的浓度为0.5 mg·mL-1,偶联比c1/c2计算如下∶
KAxm=AAxm/(ρx/Mx)
KBxm=ABxm/(ρx/Mx)
式中:c1、c2为偶联物中A、B两种物质分子浓度比;AAam、ABam和ACam分别为毒素、蛋白、偶联物在小分子毒素T-2HS特征吸收波长处的紫外吸光值;AAbm、ABbm和ACbm分别为毒素、蛋白、偶联物在蛋白质特征吸收波长处的紫外吸光值;x=a、b,分别代表毒素、蛋白;ρ为浓度,M为摩尔质量。
2 结果与讨论
2.1 T-2与HS的连接
由TLC可以得到,T-2的Rf=0.729,T-2HS的Rf=0.705,其中T-2的Rf大于T-2HS的Rf值,说明T-2与HS 连接成功,可以继续与蛋白OVA和BSA连接。
2.2 T-2HS与蛋白的连接
对T-2HS与蛋白的偶联物进行紫外扫描,结果见图2、图3。

图2 T-2、T-2HS、BSA和T-2BSA的紫外扫描图谱
由图2可以看出,T-2的紫外吸收峰在190 nm左右,T-2HS的紫外吸收峰在209 nm,BSA的紫外吸收峰在275 nm,此处T-2有弱吸收,偶联物T-2BSA的紫外吸收峰在276 nm左右,推测为载体和偶联于载体上的蛋白的吸收累加所致,表明T-2毒素连接到了载体蛋白上,全抗原合成成功。T-2BSA和BSA的最大吸收峰分别在波长276 nm和275 nm处。计算T-2与BSA的偶联比是6.66∶1。
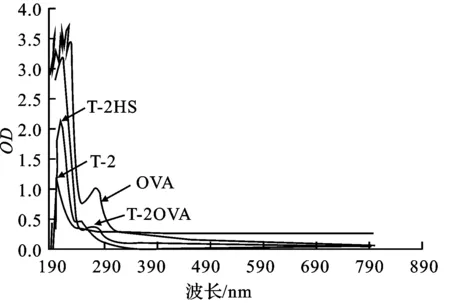
图3 T-2、T-2HS、OVA和T-2OVA的紫外扫描图谱
由图3可以看出,T-2的紫外吸收峰在190 nm左右,T-2HS的紫外吸收峰在209 nm,OVA的紫外吸收峰在278 nm,偶联物T-2OVA的紫外吸收峰在277 nm左右,此处T-2没有峰,说明该峰是由OVA贡献,表明T-2毒素接到了载体蛋白上,全抗原合成成功。T-2OVA和OVA的最大吸收峰分别在波长277 nm和278 nm处。计算T-2与OVA的偶联比是10.11∶1。
对T-2HS与蛋白的偶联物进行电泳分析,结果见图4。
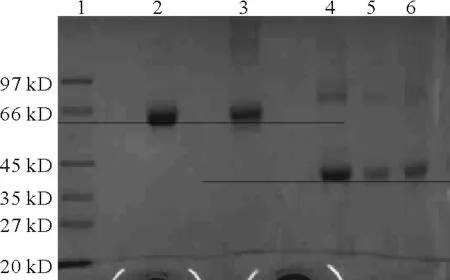
1.Marker 2.BSA 3.T-2BSA 4.OVA 5,6.T-2OVA
由图4可以看出,偶联物T-2BSA分子量略大于BSA分子量,说明T-2BSA偶联成功。T-2OVA分子量大于OVA分子量,说明T-2OVA偶联成功。
2.3 讨论
T-2毒素属于倍半萜烯类化合物,是含有羟基的小分子半抗原,其本身不具有免疫原性,不能像细菌等天然抗原一样可单独用于动物免疫,刺激其产生特异性抗体。因此,获得T-2抗体的关键是将T-2半抗原与蛋白质大分子偶联,转变成 T-2完全抗原。本实验采用琥珀酸酐法制备T-2毒素抗原,即T-2BSA和T-2OVA,预备用来免疫动物以获得 T-2抗体。
通过紫外和SDS聚丙烯酰胺电泳分析确定人工抗原的分子量。由于半抗原抗体的特异性不仅取决于半抗原整个分子或部分结构的性质,还与其人工抗原中载体上连接的半抗原数目有关,因此在免疫前测定偶联比,即合成的人工抗原载体上连接的半抗原数目,具有特殊意义。本实验在合成方法上采用氮气吹干避免氧化,能够较好地制备人工抗原,偶联比较好,一般来说当半抗原与载体的偶联比为(3~45)∶1 时免疫原性较强,在(8~25)∶1时能得到效价较高的抗体[5]。本实验合成的人工抗原T-2BSA和T-2OVA的偶联比为 6.66∶1和10.11∶1,为进一步研究奠定了基础。
3 结论
在蒸气浴条件下,T-2毒素与琥珀酸酐(HS)反应合成了T-2HS,薄层层析显示,目标半抗原合成成功;然后通过碳二亚胺法将半抗原与载体蛋白偶联制备人工抗原,采用紫外扫描及SDS-PAGE鉴定。结果显示,T-2HS能与牛血清白蛋白和卵清蛋白结合生成T-2毒素抗原。紫外扫描分析表明,T-2毒素与牛血清白蛋白的偶联比为6.66∶1,与卵清蛋白的偶联比为10.11∶1,表明此完全抗原能够用于免疫动物。为进一步制备T-2毒素抗体奠定了基础。
参考文献:
[1] Bsuer J.The metabolism of trichothecenes in swine[J].Dtsch Tierarztl Wochenschr,1995,102(1):50-52.
[2] 唐小波.制备T-2毒素抗体方法研究进展[J].中国地方病学杂志,1998,17(2):124-126.
[3] Zhang Guang-shi,Schubring Susan L,Chu F S,et al.Improved method for production of antibodies against T-2 toxin and diacetoxyscirpenol in rabbits[J].Applied and Environmental Microbiology,1986,51(1):132-137.
[4] Altieri S L,Khan A,Nazmul H,et al.Exosomes from plasmacytoma cells as a tumor vaccine[J].J Immunother,2004,27(4):282-288.
[5] Erlanger B F.The preparation of antigenic hapten-carrier conjugate:A survey[J].Methods in Enzymology,1980,70:70-74.
