增殖期血管瘤和卡波西样血管内皮瘤的病理比较研究
2010-06-05袁斯明沈卫民王修坤陈荣亮周航波姚育英章如松周晓军
袁斯明 沈卫民 王修坤 陈荣亮 周航波 姚育英 章如松 周晓军
增殖期血管瘤和卡波西样血管内皮瘤的病理比较研究
袁斯明 沈卫民 王修坤 陈荣亮 周航波 姚育英 章如松 周晓军
目的正确鉴别体表软组织深部的增殖期婴幼儿血管瘤(Infantile hemangioma,IH)和卡波西样血管内皮瘤(Kaporsiform Hemangioendothelioma,KHE)是选择合适治疗方案的重要条件。从多方面比较增殖期IH和KHE的病理特征,为更准确地鉴别诊断这两种疾病提供依据。方法在2001年1月至2009年6月期间,收集21例增殖期IH和12例KHE标本。采用HE染色、透射电镜和免疫组化染色等方法,比较增殖期IH和KHE的病理结构和抗原标记(D2-40和Glut1)的表达。结果HE染色显示,增殖期IH有众多毛细血管丛,新生毛细血管壁内可见扁平状周细胞;KHE由肿瘤结节组成,结节中心是大量狭缝状管腔,结节边缘可见毛细血管。在电镜下观察,增殖期IH的毛细血管壁基底膜呈多层板状结构,基底膜内有周细胞;KHE的狭缝状管腔和毛细血管壁基底膜仅有数层,且不连续,基底膜内也可见周细胞。增殖期IH肿瘤内皮细胞不表达D2-40,强烈表达Glut1;而KHE仅表达D2-40,不表达Glut1。结论增殖期IH的病理结构与KHE有明显差别。D2-40和Glut1可以作为鉴别增殖期IH和KHE的可靠抗原标记。
婴幼儿血管瘤卡波西样血管内皮瘤病理学抗原标记
婴幼儿血管瘤(Infantile hemangioma,IH),又称真性血管瘤,是儿童期常见肿瘤。IH的演变过程包括增殖期(1岁之前)、消退期(1~5岁)和消退完成期(5岁以后)[1]。自行消退是IH的最显著特点。卡波西样血管内皮瘤(Kaporsiform hemangioendothelioma,KHE)是一种内皮源性梭状细胞肿瘤,绝大部分发生于儿童和青少年,常位于体表软组织,也见于腹腔和腹膜后腔[2]。KHE不会消退,部分伴有卡-梅现象(Kasabach-Merritt phenomenon,KMP),死亡率较高[3]。增殖期IH和KHE的治疗方法差异很大。增殖期IH可以采用激素口服或局部注射、手术等方法治疗,如增殖速度不快、位于非外观部位,也可以观察等待[4]。而KHE,尤其是伴有KMP的KHE,治疗比较困难,需要采用以手术切除为主,并结合支持治疗、栓塞治疗、化学治疗、干扰素治疗等的综合治疗[5]。因此,必须诊断明确,并采用针对性治疗才能取得良好效果。
增殖期IH和KHE,尤其是体表软组织内的增殖期IH和KHE,外观、体格检查和影像学检查均具有一定的相似性,鉴别诊断往往需要病理检查。以往研究对增殖期IH和KHE的病理结构已有阐述[6-7],但系统、全面比较这两种疾病的报道仍然很少见。我们采用HE染色、透射电镜和免疫组化染色等方法,多方面比较增殖期IH和KHE的光镜病理、超微病理和抗原标记表达的差异,为更准确地鉴别诊断这两种疾病提供依据。
1 材料与方法
1.1 病例收集
在2001年1月至2009年6月期间,收集在南京市儿童医院和南京军区南京总医院治疗的增殖期IH和KHE病例标本。诊断依据临床表现、影像学检查、血液检验和病理检查。所有病理诊断均由病理科医师单独完成。
1.2 光镜病理
石蜡包埋标本,HE染色,光镜下观察病理结构。
1.3 超微结构研究
取新鲜的IH和KHE标本,在最短时间内将组织修成1 mm×1 mm×2 mm的长条形小块,2.5%戊二醛固定,经梯度脱水、浸透和包埋、修块、半薄切片定位、制刀、载网和支持膜、超薄切片、枸橼酸铅溶液染色等步骤,JEM-1011型透射电镜观察。
1.4 免疫组化染色
石蜡包埋标本,行免疫组化染色,观察D2-40(Invitrogen公司)和Glut1(NeoMarkers公司)在增殖期IH和KHE中的表达。采用MaxvisionTM即用型快速免疫组化一步法,步骤参考说明书。均以PBS代替一抗作为阴性对照。细胞浆内或细胞外基质中出现棕黄或棕黑色物为阳性染色,不着色为阴性。
1.5 统计方法
所有数据为计数资料,用Microsoft Office Excel处理。
2 结果
2.1 病例收集结果
共收集21例增殖期IH和12例KHE。21例增殖期IH中,男性11例,女性10例;最小年龄1月龄,最大年龄5月龄,平均就诊年龄2.81月龄;肿瘤分布于头面部(10例)、颈部(2例)、躯干部(4例)、上肢(3例)和下肢(2例)。12例KHE中,男性4例,女性8例;8例患者有KMP;最小年龄1天龄,最大年龄120天龄,平均就诊年龄68.5天龄;肿瘤分布于头面部(2例)、颈部(2例)、躯干部(4例)、上肢(3例)和下肢(1例)。
2.2 HE染色
增殖期IH:由众多不规则毛细血管丛组成,毛细血管呈圆形、排列较整齐(图1A)。毛细血管内皮细胞核大呈卵圆形,胞浆丰富,可见核分裂像。毛细血管壁边缘可见典型的扁平状周细胞(图1B)。
KHE:肿瘤由不规则结节组成(图2A),结节中心区域由梭形或圆形内皮细胞组成,形成众多狭缝状管腔,排列紊乱,管腔内常含有红细胞碎片和微栓子(图2B)。瘤结节边缘有椭圆形毛细血管丛,毛细血管内皮细胞呈扁平状。HE染色不能明确分辨周细胞。
2.3 透射电镜
增殖期IH:微血管数量多,由数目不等的单层内皮细胞围绕形成管壁,内皮细胞胞核饱满、核浆比大。内皮下基底膜结构清晰,呈多层板状结构,基底膜内可见数量不等的周细胞(图1C)。内皮细胞和周细胞紧密接触,可见胞浆胞膜突起相互嵌合(图1D)。还有少量萎缩的凋亡细胞(图1E)。
KHE:观察3例有KMP的卡波西样血管内皮瘤新鲜标本,可见肿瘤结节内含大量狭缝状管腔和毛细血管,管腔内皮细胞胞核大、染色质丰富、胞核呈乳头状向管腔突起(图2C)。毛细血管内皮细胞呈扁平状(图2D)。狭缝状管腔和毛细血管壁的基底膜很薄,仅有数层,且不连续,基底膜也可见周细胞(图2C,D)。胞浆内包含细微的含铁血黄素颗粒、透明小球和空泡(图2E)。部分狭缝状管腔内可见血小板(图2F)。
2.4 免疫组化染色
增殖期IH:毛细血管团无D2-40表达(图1F),毛细血管壁强烈表达Glut1(图1G)。
KHE:D2-40主要表达于肿瘤结节边缘的毛细血管(图2G);狭缝状管腔内皮细胞和毛细血管内皮细胞均不表达Glut1,管腔内可见较多Glut1阳性的红细胞(图2H)。

图1 增殖期婴幼儿血管瘤的病理特点
3 讨论
婴幼儿血管瘤是儿童常见肿瘤,白色人种的儿童发病率接近10%,亚洲儿童的发病率接近1%,女童发病率较高[1]。增殖期IH如位于体表,呈鲜红色,边界清楚,如草莓状,容易诊断;如位于深部软组织内,根据瘤体与皮肤的距离不同,表面皮肤可能呈暗红色、蓝色甚至正常肤色。IH是一种良性肿瘤,仅在局部膨胀性生长,不会浸润、毁坏局部组织器官[1];可能由于外伤等原因发生局部破溃出血,但不会发生局部广泛出血。因此,对颜面部位、增长较慢的IH可以采用局部注射或口服激素、观察等保守治疗;对增长快速,可能引起并发症的IH,可以手术治疗[4,8]。
KHE,尤其是伴有KMP的KHE,绝大多数发生于婴幼儿。位于体表软组织内的KHE也表现为皮下肿物,皮肤表面呈暗红色或正常肤色。如瘤体出血,则表现为瘤体周围广泛出血和淤斑[9]。KHE是一种交界性肿瘤,可以在局部广泛浸润,毁坏局部组织器官,甚至发生KMP而危及生命[7]。鉴于KHE的破坏性很大,需要及时采取手术切除[5]、化学治疗[10]、栓塞治疗[11]、干扰素治疗[12]和放射治疗[13]等的综合治疗。
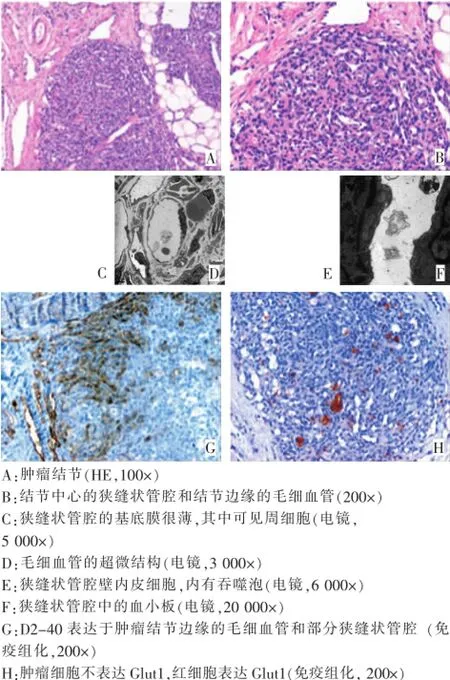
图2 卡波西样血管内皮瘤的病理特点
对于软组织内的增殖期IH和KHE,需要尽早明确诊断,采用合适的治疗方法。既要避免将KHE误诊为IH,不采取积极的治疗措施,导致KHE快速发展、造成破坏性后果;又要避免将IH误诊为KHE,采取不必要的手术治疗,破坏局部外形和引起功能障碍。对于软组织内的增殖期IH和早期KHE,体格检查和影像学检查均难于鉴别,病理检查(穿刺活检)是最可靠的鉴别方法。
HE染色可见,增殖期IH由大量新生毛细血管团组成;新生毛细血管呈圆形或卵圆性,内皮细胞胞核大,胞浆丰富;毛细血管壁内可见典型的扁平状周细胞。KHE同时具有卡波西肉瘤和毛细血管瘤的病理特征;肿瘤结节中心是大量狭缝状管腔,管壁由梭形内皮细胞围绕;结节边缘可见长条形或椭圆性毛细血管。电镜观察显示,增殖期IH的新生毛细血管内皮下基底膜呈多层板状结构,基底膜内有典型的周细胞,周细胞与内皮细胞紧密接触;而KHE的狭缝状管腔内皮下基底膜很薄而不连续,基底膜内也有周细胞。
研究证实[14-15],伴有KMP的血管肿瘤中潴留有大量血小板,并推测血小板被血管肿瘤捕获、破坏是KMP的发病原因。我们通过电镜观察发现,KHE的部分狭缝状管腔中有血小板的存在,提示血小板在狭缝状管腔中被捕获,为研究KMP的病因提供了更直接的形态学证据。另有少数报道认为,IH也可能导致KMP[16],但更多报道认为IH与KMP无关[17-18]。我们在IH的毛细血管团中未发现血小板,提示增殖期IH不会导致KMP。此外,凋亡被认为是IH自发消退的最主要原因[19],我们也观察到增殖期IH内有少量凋亡细胞,提示IH内同时存在增殖和凋亡现象。
我们选择D2-40和Glut1作为抗原标记物。已有研究报道KHE内有淋巴管存在[20],而Glut1是IH内皮细胞的特异标记抗原[21]。我们的研究证实,KHE内肿瘤结节边缘的毛细血管表达D2-40,而增殖期IH的毛细血管不表达D2-40。KHE的狭缝状管腔和毛细血管均不表达Glut1,而增殖期IH毛细血管强烈表达Glut1。因此,D2-40和Glut1可以作为鉴别KHE和增殖期IH的可靠抗原标记。
[1]Chiller KG,Passaro D,Frieden IJ.Hemangiomas of infancy:clinical characteristics,morphologic subtypes,and their relationship to race, ethnicity,and sex[J].Arch Dermatol,2002,138(12):1567-1576.
[2]Lyons LL,North PE,Mac-Moune LF,et al.Kaposiform hemangioendothelioma:a study of 33 cases emphasizing its pathologic, immunophenotypic,and biologic uniqueness from juvenile hemangioma [J].Am J Surg Pathol,2004,28(5):559-568.
[3]Zukerberg LR,Nickoloff BJ,Weiss SW.Kaposiform hemangioendothelioma of infancy and childhood;an aggressive neoplasm associated with Kasabach-Merritt syndrome and lymphangiomatosis [J].Am J Surg Pathol,1993,7(4):321-328.
[4]林晓曦.血管瘤和血管畸形:经验,进展与挑战[J].中华整形外科杂志,2007,23(2):81-82.
[5]Abass K,Saad H,Kherala M,et al.Successful treatment of Kasabach-Merritt syndrome with vincristine and surgery:a case report and review of literature[J].Cases J,2008,1:9.
[6]袁斯明,邢新,欧阳天祥,等.婴幼儿血管瘤病理演变过程的形态学观察与分析[J].临床与实验病理学杂志,2005,20(3):290-294.
[7]Weiss SW,Goldblum JR.Hemangioendothelioma:vascular tumors of intermediate malignancy//Enzinger and Weiss’s soft tissue tumors[M].St.Louis:Mosby,2001,891-915.
[8]袁斯明,姜会庆,洪志坚,等.复方倍他米松局部注射控制性治疗婴幼儿真性血管瘤[J].中国美容整形外科杂志,2009,20(5):292-294.
[9]Rodriguez V,Lee A,Witman PM,et al.Kasabach-merritt phenomenon: case series and retrospective review of the mayo clinic experience [J].J Pediatr Hematol Oncol,2009,31(7):522-526.
[10]López V,Martí N,Pereda C,et al.Successful management of kaposiform hemangioendothelioma with kasabach-merritt phenomenon using vincristine and ticlopidine[J].Pediatr Dermatol,2009,26(3): 365-366.
[11]Hosono S,Ohno T,Kimoto H,et al.Successful transcutaneous arterial embolization of a giant hemangioma associated with highoutput cardiac failure and Kasabach-Merritt syndrome in a neonate: a case report[J].J Perinat Med,1999,27(5):399-403.
[12]Hartman KR,Moncur JT,Minniti CP,et al.Mediastinal Kaposiform hemangioendothelioma and Kasabach-Merritt phenomenon in an infant:treatment with interferon[J].J Pediatr Hematol Oncol,2009, 31(9):690-692.
[13]Kwok-Williams M,Perez Z,Squire R,et al.Radiotherapy for life-threatening mediastinal hemangioma with Kasabach-Merritt syndrome[J].Pediatr Blood Cancer,2007,49(5):739-744.
[14]Warrell RP Jr,Kempin SJ,Benua RS,et al.Intratumoral consumption of indium-111 labeled platelets in a patient with hemangiomatosis and intravascular coagulation(Kasabach-Merritt syndrome)[J]. Cancer,1983,52(12):2256-2260.
[15]Seon KS,Jin CS,Gun YN,et al.Kasabach-Merritt syndrome: Identification of platelet trapping in a tufted angioma by immunohistochemistry technique using monoclonal antibody to CD61[J]. Pediatric dermatology,1999,16(5):392-394.
[16]Alvarez-Mendoza A,Lourdes TS,Ridaura-Sanz C,et al.Histopathology of vascular lesions found in Kasabach-Merritt syndrome:review based on 13 cases[J].Pediatr Dev Pathol,2000,3(6):556-560.
[17]Sarkar M,Mulliken JB,Kozakewich HPW,et al.Thrombocytopenic coagulopathy(Kasabach-Merritt phenomenon)is associated with kaposiform hemangioendothelioma and not with common infantile hemangioma[J].Plast Reconstr Surg,1997,100(6):1377-1386.
[18]Enjolras O,Wassef M,Mazoyer E,et al.Infants with Kasabach-Merritt syndrome do not have"true"hemangiomas[J].J Pediatr, 1997,130(4):631-640.
[19]Razon MJ,Kraling BM,Mulliken JB,et al.Increased apoptosis coincides with onset of involution in infantile hemangioma[J]. Microcirculation,1998,5(2-3):189-195.
[20]Folpe AL,Veikkola T,Valtola R,et al.Vascular endothelial growth factor receptor-3(VEGFR-3):a marker of vascular tumors with presumed lymphatic differentiation,including Kaposi’s sarcoma, kaposiform and Dabska-type hemangioendotheliomas and a subset of angiosarcomas[J].Modern Pathol,2000,13(2):180-185.
[21]North PE,Waner M,Mizeracki A,et al.GLUT1:a newly discovered immunohistochemical marker for juvenile hemangiomas[J].Hum Pathol,2000,31(1):11-22.
Comparative Study On Pathology of Proliferating Infantile Hemangioma and Kaporsiform Hemangioendothelioma
YUAN Siming1,2,SHEN Weimin3,WANG Xiukun2,CHEN Rongliang2,ZHOU Hangbo1,YAO Yuying1,ZHANG Rusong1, ZHOU Xiaojun1.
1 Department of Pathology;2 Department of Plastic Surgery,Jinling Hospital,Nanjing 210002,China;3 Department of Plastic Surgery,Nanjing Children′s Hospital Affiliated to Nanjing Medical University,Nanjing 210008,China. Corresponding Author:ZHOU XiaoJun.
ObjectiveTo distinguish proliferating infantile hemangioma(IH)and kaporsiform hemangioendothelioma (KHE)by comparing the pathological structure and marker antigen expression.MethodsFrom January 2001 to June 2009, 33 paraffin-embedded and fresh samples,21 proliferating IH and 11 KHE,were collected from Nanjing Children′s Hospital and Jinling Hospital.Hematoxylin-eosin(HE)staining and transmission electron microscopy(TEM)were used to observe the pathological structure.Immunohistochemical analysis was also performed to investigate the expression of D2-40 and Glut1. ResultsHE staining revealed that proliferating IH had dense capillary plexus and flat pericytes in the wall of neocapillaries,and that KHE was composed of tumor nodules with slit-like channels in the center and capillaries in the margin. TEM revealed multi-layer basement membrane of neo-capllaries in IH,and slit-like channels and capillaries with thinlayered basement membrane in KHE.There were pericytes in the basement membrane in both.Immunochemistry revealed that the endothelial cells expressed Glut1,but not D2-40 in IH;while D2-40,but not Glut1 in KHE.ConclusionThe pathological structure of proliferating IH is obviously different from that of KHE.D2-40 and Glut1 are the reliable marker antigens for differential diagnosis of proliferating IH and KHE.
Infantile hemangioma;Kaporsiform hemangioendothelioma;Pathology;Marker antigen
R730.4
A
1673-0364(2010)02-0085-04
2010年2月6日;
2010年2月28日)
10.3969/j.issn.1673-0364.2010.02.007
国家自然科学基金项目(30700874);中国博士后科学基金项目(20090451571);江苏省博士后科研资助计划项目(0901062C);南京军区南京总医院科研基金资助(2009Q038)。
210002江苏省南京市南京军区南京总医院病理科(袁斯明,周航波,姚育英,章如松,周晓军);整形外科(袁斯明,王修坤,陈荣亮);210008江苏省南京市南京市儿童医院整形外科(沈卫民)。
周晓军。
