淋巴管内皮细胞与PGA的相容性研究
2010-06-14戴婷婷蒋朝华周广东刘伟李圣利
戴婷婷 蒋朝华 周广东 刘伟 李圣利
组织工程技术构建淋巴管的关键是要形成淋巴管内皮细胞(Lymphatic endothelial cells,LEC)与生物支架的三维复合体。目前,组织工程研究中,应用较多的可降解人工合成材料是聚羟基乙酸(Polyglycolic acids,PGA)。该材料可加工成直径 15 μm 的纤维,具有以下特点:能形成稳定的三维空间结构;具有较好的生物相容性;通过调整分子量大小,可以控制降解速度;其体内最终降解产物为CO2和水,对机体无毒副作用。作为一种生物相容性良好的人工合成生物材料,PGA已在软骨、骨和肌腱等组织工程的临床研究中显示出巨大的优势和应用潜力[1-3]。
本实验选用PGA作为人LEC黏附生长的支架,研究LEC与PGA的生物相容性,探讨PGA支架应用于组织工程化淋巴管构建的可能性
1 材料和方法
1.1 生物支架PGA的制备
取直径为15 μm,重量为60 mg的PGA纤维(ALBANY公司),制成20 mm×15 mm×1 mm的薄片,75%乙醇浸泡1 h后,PBS反复冲洗3次,吸干水分后,紫外灯照射30 min消毒备用。
1.2 LEC的分离、培养
取幼儿包皮环切术后废弃的包皮,2块为一组,反复清洗,去除皮下疏松结缔组织,采用中性蛋白酶(Roche 公司)结合胶原酶(Gibco 公司)消化,CD34阴性分选和CD31阳性磁珠(Dynal公司)分选,获得CD34-/CD31+细胞[4-6]。用完全内皮细胞培养基(EGM-2-MV)(Lonza公司)重悬细胞,计数,调整细胞浓度至1×105cells/mL后,接种于用20 ng/mL纤维连接蛋白(Sigma公司)铺底的6孔板中培养。3~4 d换液1次。细胞生长到90%融合后,以0.05%胰蛋白酶消化,1∶3~4传代于6孔板中 (无需纤维连接蛋白铺盘)。用于制作细胞爬片的玻片也需预先用20 ng/mL纤维连接蛋白处理。
1.3 细胞免疫荧光鉴定[7-9]
CD34-/CD31+细胞爬片用4%多聚甲醛固定10 min,PBS漂洗3次,分别滴加鼠抗人Podoplanin抗体(1∶100)和 VEGFR-3 抗体(1∶100),37 ℃孵育30 min;PBS漂洗3次,滴加FITC荧光二抗,37℃孵育30 min;PBS漂洗3次,蒸馏水漂洗3次,荧光显微镜观察。
1.4 细胞与PGA支架复合物的体外培养
消化、离心第4代LEC,将细胞浓度浓度至1×107cells/mL,制成细胞悬液,接种到PGA支架上,置 37℃、5%CO2细胞培养箱中,4 h后加 10 mL EGM-2培养液,培养7 d,每隔2天换液一次。
1.5 扫描电镜观察
取培养1周的LEC-PGA复合物,PBS洗涤,2.5%戊二醛固定,系列脱水,乙腈置换,真空干燥,表面喷金后行扫描电镜观察并摄像。
1.6 RT-PCR检测
取培养1周的LEC-PGA复合物,TRIzol法行RNA 抽提。 RT:20 μL 反应体系,25 mmol/L MgCl24 μL,10×逆转录缓冲液 2 μL,10 mmol/L dNTP 2 μL,40 U/L RNase抑制剂 0.5 μL,5 U/L AMV 逆转录酶1 μL,200 ng/I~LOligo dT-Adaptor Primer 1 μL,RNA 2 μg,加无 RNase 水至 20 μL;反应条件为 30℃ 10 min,42 ℃ 60 min,99 ℃ 5 min,5 ℃ 5 min。PCR:引物序列包括人Prox上游引物5-CTCATAAAGTCCGAGTGCG-3, 下 游 引 物 5-AACATCTTTGCCTGCGATA-3;人Podoplanin上游引物5-GTGTAACAGGCATTCGCATCG-3,下游引物5-GGCAAGTGTTCCACGGGTC-3;人LYVE-1上游引物5-GTTTCTTTCATGCTCCTTACCC-3,下游引物5-GTCTCAGTGACTCCTTGGCTTT-3; 人 VEGFR-3上游引物5-AGAGGAACCAGGAGGACAAG-3,下游引物 5-CAGGTGCTGAAGGGACATT-3。 20 μL 反应体系:ddH2O 13.8 μL,25 mmol/L MgC121.6 μL,10×逆转录缓冲液 2 μL,10 mmol/L dNTP 0.5 μL,5 U/L Taq 酶 0.5 μL,cDNA 1.0 μL,20 pmo~L 目的基因上下游引物各0.3 μL。反应条件:95℃变性5 min;95℃ 30 s、55 ℃ 30 s、72 ℃ 30 s, 共 35 个循环;72 ℃延伸10 min。电泳图像分析:PCR产物 20 μL经1.2%琼脂糖、70 V电压电泳1.5 h后,进行图像分析。
2 结果
2.1 LEC的鉴定
酶消化结合免疫磁珠分选法获取的LEC,纯度高,呈内皮细胞典型的铺路石样排列(图1);细胞免疫荧光检测显示,CD34-/CD31+细胞呈现LEC特异性标志Podoplanin和VEGFR-3(图2)。
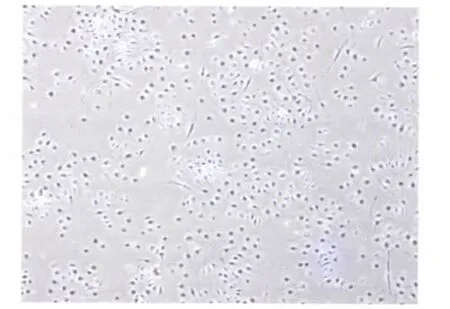
图1 单层培养的LEC呈典型的铺路石样排列(40×)
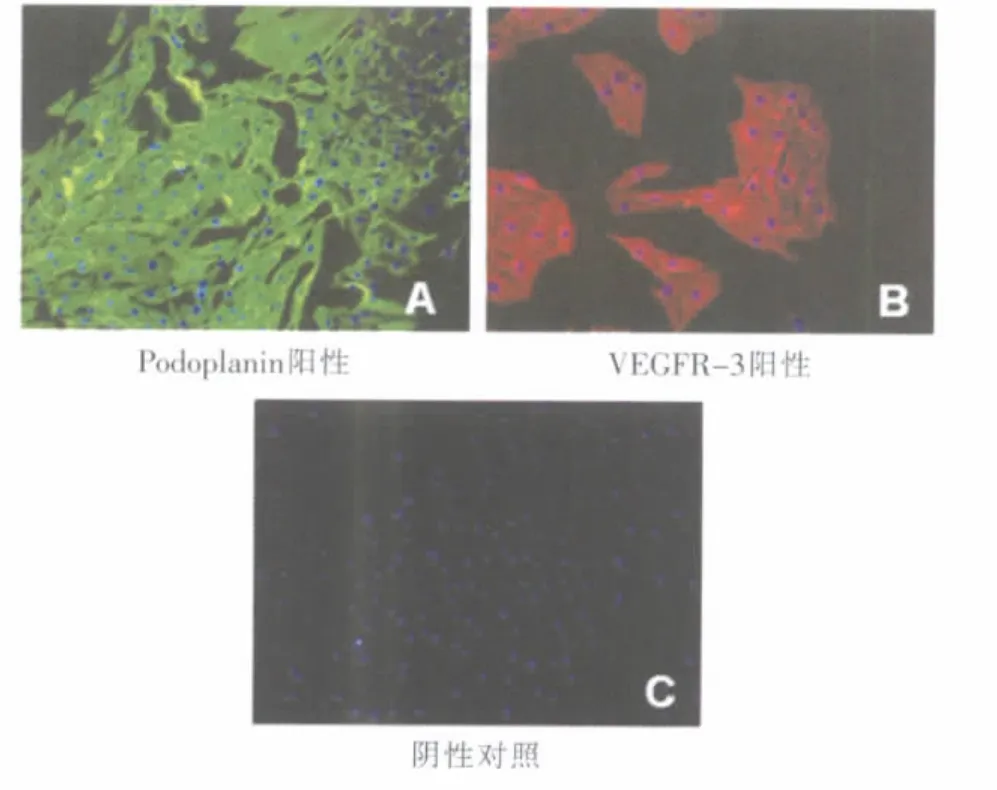
图2 细胞免疫荧光染色
2.2 LEC-PGA复合物扫描电镜观察
复合物体外培养3 d时,可见单个LEC呈类圆形,较扁平,细胞在与PGA接触部位伸出细小伪足,黏附于PGA纤维;体外培养1周后,可见细胞分泌大量细胞外基质(图3)。

图3 LEC-PGA扫描电镜观察
2.3 RT-PCR
琼脂糖凝胶电泳显示,构建产物能特异性表达LYVE-1 mRNA、Podoplanin mRNA、Prox-1 mRNA和 VEGFR-3 mRNA(图 4)。

图4 RT-PCR检测LEC特异性表型
3 讨论
淋巴系统阻塞性疾病的治疗,迄今仍然是临床的难题[10]。通过显微淋巴外科技术吻合淋巴管,实现淋巴回流的重建,是目前治疗阻塞性淋巴水肿的有效手段。但淋巴管移植材料缺乏,自身淋巴管移植后易引起供区水肿。组织工程技术的发展为上述难题的解决提供了新的思路[11-12]。
淋巴管内皮细胞层是执行淋巴管生理功能的重要物质基础。因此,获取足够量的健康、有活力的种子细胞是构建淋巴管内皮层的首要问题。我们从幼儿包皮组织中获取大量的LEC[5-6],同时还证实了冻存的内皮细胞复苏后无明显形态学改变,并保持了较高的活力及体外增殖能力[13]。此方法获得的LEC经过鉴定,不仅纯度高,而且表型可以维持10代以上。我们采用第4代细胞接种材料,细胞状态成熟稳定,增值能力强,接种时将其调整到合适的细胞浓度(5×107cells/mL),使其达到与PGA支架复合的最佳条件。PGA纤维为细胞生长、迁移、分化和细胞外基质的分泌提供了条件,同时伴随着自身的降解,引导新生的组织按照支架模型的三维结构生长。PGA是典型的合成可降解聚合物,降解后生成羟基乙酸。由于羟基乙酸是体内三羧酸循环的中间代谢物,且吸收和代谢机理已经明确,并具有可靠的生物安全性,已被美国FDA批准用于临床,广泛用于组织工程化软骨、骨、肌腱和皮肤等的研究。Niklason等[14]以PGA为支架材料,成功构建了组织工程化血管。
本实验首次选用PGA作为支架材料,进行LEC-PGA复合物体外培养研究。结果表明:淋巴管内皮细胞可在PGA形成的三维空间结构中生长并分泌基质,维持其表型不变;PGA对细胞生长无明显不良影响。综上所述,可以认为PGA是构建组织工程化淋巴管内皮层的合适材料。我们将在此基础上,进一步开展构建含平滑肌层与内皮层的组织工程化淋巴管的研究。
[1]Cao Y,Vacanti JP,Paige KT,et al.Transplantation of chondrocytes utilizing a polymer-cell construct to produce tissue-engineered cartilage in the shape of a human ear[J].Plast Reconstr Surg,1997,100(2):297-302.
[2]Zhou G,Liu W,Cui L,et al.Repair of porcine articular osteochondral defects in non-weightbearing areas with autologous bone marrow stromal cells[J].Tissue Eng,2006,12(11):3209-3221.
[3]徐梁,曹德君,刘伟,等.体内构建组织工程腱鞘的初步研究[J].组织工程与重建外科杂志,2008,4(6):308-311.
[4]Hu XQ,Jiang ZH,Liu NF.A novel approach for harvesting lymphatic endothelial cells from human foreskin dermis[J].Lymphatic Research&Biology,2006,4:15-22.
[5]胡学庆,蒋朝华,刘宁飞.人真皮微淋巴管内皮细胞的分离培养与鉴定[J].中华实验外科杂志,2007,24(3):336-338.
[6]蒋朝华,胡学庆,刘宁飞,等.血管生成素-2在新生淋巴管中的调节作用[J].组织工程与重建外科杂志,2007,3(4):237-239.
[7]Banerji S,Ni J,Wang SX,et al.LYVE-1,a new homologue of the CD44 glycoprotein,is a lymph-specific receptor for hyaluronan[J].J Cell Biol,1999,144(4):789-801.
[8]Partanen TA,Paavonen K.Lymphatic versus blood vascular endothelial growth factors and receptors in humans[J].Microsc Res Tech,2001,55(2):108-121.
[9]Lymboussaki A,Partanen TA,Olofsson B,et al.Expression of the vascular endothelial growth factor C receptor VEGFR-3 in lymphatic endothelium of the skin and in vascular tumors[J].Am J Pathol,1998,153(2):395-403.
[10]Halperin TJ,Slavin SA,Olumi AF,et al.Surgical Management of scrotal lymphedema using local flaps[J].Annals of Plastic Surg,2007,59:67-72.
[11]Langer R,Vacanti JP.Tissue engineering[J].Sci,1993,260:920-926.
[12]Vacanti JP,Langer R.Tissue engineering:the design and fabrication of living replacement devices for surgical reconstruction and transplantation[J].Lancet,1999,354(1):32-34.
[13]蒋朝华,胡学庆,刘宁飞.人真皮淋巴管内皮细胞分离及冷冻保存技术[J].上海交通大学学报医学版,2007,27(9):1092-1095.
[14]Niklason LE,Gao J,Abbott WM,et al.Functional arteries grown in vitro[J].Sci,1999,284:489-493.
