Survivin、VEGF、Caspase-3 在血管瘤不同时期的表达及其相关性研究
2010-06-14张莉张成书李旭文王怀谷徐静李光早林晓曦
张莉 张成书 李旭文 王怀谷 徐静 李光早 林晓曦
血管瘤是婴幼儿最常见的良性肿瘤,其确切的发病机制目前尚未阐明[1]。血管瘤具有很奇特的自然病程:出生后1~12个月瘤体迅速增大(增生期),随后的2~5年内出现缓慢的、必然的消退(消退期)。由于这一特殊的生物学现象,血管瘤增生与消退的机制一直是人们研究的热点。张莉等[2]用基因芯片技术检测增生期和消退期血管瘤差异基因的表达,发现大量与细胞增殖相关的基因在增生期高表达,而与细胞凋亡有关的基因在消退期高表达,提示血管内皮细胞的增殖和凋亡与血管瘤的增生和消退密切相关,即血管瘤的增生和消退可能就是血管瘤内皮细胞增殖和凋亡的外在表现,但引起血管瘤内皮细胞增殖和凋亡的分子机制尚不明确。
本实验拟用免疫组织化学方法,检测不同时期血管瘤组织中的Survivin、VEGF和活化Caspase-3的表达,并且进行相关性分析,探讨上述分子的变化对血管瘤增生、消退病程演化的影响,为临床治疗血管瘤提供新的思路。
1 材料与方法
1.1 研究对象
收集我院病理科2005年至2008年血管瘤蜡块标本45例,其中女性35例,男性10例;年龄最小1月龄,最大5岁。依据Mulliken对血管瘤的分期标准,并经病理证实,确诊增生期血管瘤30例,消退期血管瘤15例。另以瘤体周围正常皮肤组织15例为正常对照。
1.2 免疫组化染色
1.2.1 载玻片的处理
重铬酸钾-硫酸液浸泡24 h,用流水冲洗2 h,置于60℃温箱中烤干,并以1∶10多聚L-赖氨酸溶液浸数秒,沥干,置于60℃温箱中烤干备用。
1.2.2 免疫组化染色
石蜡切片经二甲苯脱蜡和梯度乙醇水化后,蒸馏水冲洗3遍,滴加3%H2O2,室温孵育10 min,置于抗原修复液,中火修复10 min,室温冷却20 min,蒸馏水冲洗2遍,0.1%PBS液冲洗2遍,甩去PBS液,滴加50 μL非免疫动物血清,室温下孵育10 min,滴加一抗50 μL,4℃温箱中过夜。切片取出后PBS冲洗3 min(3次),滴加生物素标记的第二抗体50 μL,室温下孵育 10 min,PBS 液冲洗 3 min(3 次),滴加链霉素抗生物素-过氧化物酶溶液50 μL,室温下孵育 10 min,PBS液冲洗 3 min(3次),滴加 100 μL新鲜配置的二氨基苯联氨(DAB),显色5 min,自来水冲洗,苏木素复染,中性树胶封片。分别设立阳性对照和阴性对照。阳性对照即试剂公司提供的阳性照片,阴性对照为一抗用PBS液。
1.2.3 染色结果的评定
由两位病理科医师采用双盲法对结果进行评定。光镜下观察,免疫组织化学染色显示:VEGF阳性时,细胞质有棕黄色细颗粒沉着;Caspase-3阳性时,胞浆或胞核出现黄色、棕黄色、棕褐色细颗粒沉着;Survivin阳性时,胞核出现棕黄色、棕褐色细颗粒沉着。评定标准如下:以同一显微镜倍数(400×)观察全片,选择5个高倍视野,合并计算所分析的5个不同视野染色的强度及阳性细胞百分率。基本不染色者为0分,染色淡者为1分,染色中等者为2分,染色深者为3分。阳性细胞百分率小于5%为0分,6%~25%为1分,26%~50%为 2分,大于 51%为3分。将每张片子的染色强度得分与阳性细胞百分率得分各自相乘,则为阳性系数。阳性系数0~1分者为阴性(-),2~3 分者为弱阳性(+),4~6 分者为中等阳性(++),9 分者为强阳性(+++)。 阳性表达率以表达阳性的病例(包括弱阳性、中等阳性和强阳性之和)占总病例数的百分比表示。
1.3 统计学分析
以SPSS 11.5软件对数据进行处理,统计方法为Kuskal-Wallis H检验、Mann-Whittney U检验、Spearman等级相关分析,P<0.05为有统计学意义。
2 结果
2.1 Survivin在血管瘤和正常组织中的表达
Survivin主要在血管瘤内皮细胞胞核中表达,增生期阳性(+~+++)表达率为 80%(24/30);消退期阳性(+~+++)表达率为 60%(9/15);在正常组织中不表达。血管瘤增生期与消退期的差异有统计学意义(P<0.05);增生期和消退期分别与正常组织比较,差异均有显著意义(P<0.01)(表 1)。

表1 Survivin在血管瘤及正常组织中的表达
2.2 VEGF在血管瘤和正常组织中的表达
VEGF主要在血管瘤内皮细胞的胞浆和胞膜表达,增生期和消退期阳性(+~+++)表达率分别为90%(27/30)和 46.7%(13/15),具有显著性差异(P<0.01);在正常组织不表达。增生期与消退期血管瘤与正常组织相比,差异均具有显著意义(P<0.01)(表2)。
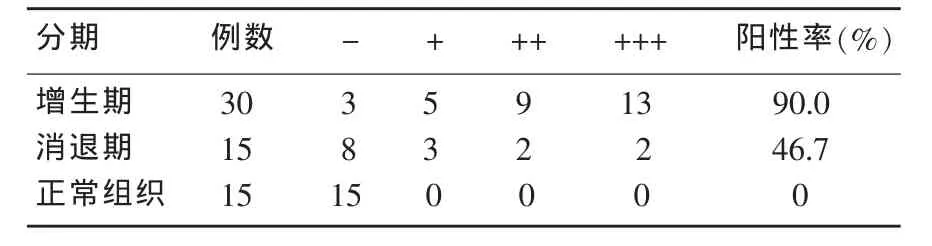
表2 VEGF在血管瘤及正常组织中的表达
2.3 活化Caspase-3在增生期、消退期血管瘤及正常组织中的表达
血管瘤中活化Caspase-3增生期主要在内皮细胞核中表达,消退期也出现在胞浆中,增生期和消退期阳性(+~+++)表达率分别为 60.0%(18/30)和 86.7%(13/15),在正常组织中不表达。血管瘤在增生期与消退期的差异具有显著意义(P<0.01),增生期、消退期与正常组织的差异均有显著意义(P<0.01)(表3)。

表3 活化Caspase-3在血管瘤及正常组织中的表达
2.4 血管瘤组织中Survivin和VEGF的相关性
经Spearman等级相关分析,Survivin和 VEGF在45例血管瘤组织的表达具有正相关性 (r=0.54,P<0.01)(表 4)。

表4 血管瘤中Survivin和VEGF表达的相关性
2.5 血管瘤组织中Survivin和活化Caspase-3的相关性
经Spearman等级相关分析,Survivin和活化Caspase-3在45例血管瘤组织的表达具有负相关性(r=-0.51,P<0.01)(表 5)。
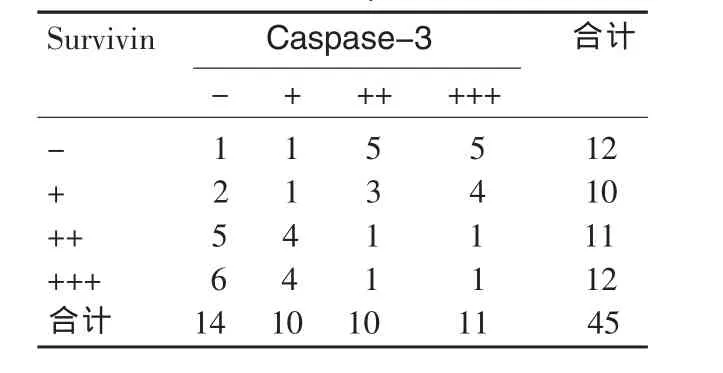
表5 血管瘤中Survivin、Caspase-3表达的相关性分析
3 讨论
血管瘤增生和消退的确切发病机制目前尚不明确,血管内皮细胞增殖和凋亡相关因子在该机制中的作用是目前研究的热点。
本实验发现,VEGF在增生期血管瘤的阳性率为90%(27/30),明显高于消退期和正常组织,与文献报道一致[3]。Caspase-3是细胞凋亡的重要信号分子,其活化可诱导血管瘤内皮细胞发生凋亡,并可能最终导致血管瘤的自发消退[4]。本实验显示,活化Caspase-3在消退期的阳性率为86.7%,明显高于增生期血管瘤(60.0%)和正常组织(不表达)。Survivin是新近发现的、最强的凋亡抑制蛋白,表达不足可导致内皮细胞及新生毛细血管的退化[5]。我们发现,其在增生期血管瘤中的阳性表达率(80%)明显高于消退期(60%)和正常组织(不表达),提示Survivin可抑制血管瘤内皮细胞凋亡,促进血管瘤组织增生,是调控血管瘤内皮细胞凋亡的重要基因之一。
通过等级相关分析,我们发现血管瘤组织中VEGF和Survivin的表达具有强正相关性,提示血管瘤内皮细胞中Survivin的高表达可能与VEGF表达上调有关。VEGF刺激血管瘤内皮细胞增生,还通过Survivin抑制了内皮细胞的凋亡,它们共同作用促成了血管瘤早期的快速增生。Survivin在增生期血管瘤高表达,在退化期血管瘤中低表达;而活化Caspase-3的表达则相反,两者的表达呈负相关,证实在血管瘤的增生过程中,Survivin可能通过抑制Caspase-3而参与了血管瘤的发生;相反,血管瘤的消退则可能是由于Survivin的表达降低,Caspase-3的活性增高,诱导血管瘤内皮细胞凋亡所致。
我们对比了血管瘤增生期和消退期中Survivin、VEGF、Caspase-3的表达及其相关性,发现三者在血管瘤的不同时期表达不同,且具有相关性,其差异变化可能主导了血管瘤增生、消退的演化过程。结果提示,血管瘤内皮细胞中高表达的VEGF一方面促进自身的增殖,另一方面上调了Survivin的表达,抑制了Caspase-3等凋亡蛋白的活性,从而导致了血管瘤早期的快速增生;相反,VEGF的表达下调,减少了凋亡抑制蛋白Survivin的表达,使凋亡蛋白Caspase-3等活性升高,促进了内皮细胞的凋亡,使血管瘤趋于消退。结合文献分析[6-7],可以推测,在血管瘤的增生与消退过程中,VEGF/Survivin抑制Caspase-3的途径可能起着关键性的作用,将来有望通过改变VEGF/Survivin抑制Caspase-3的途径中的某一环节,如用反义核苷技术和/或RNA干扰技术等阻断VEGF或Survivin在血管瘤中的表达,提高Caspase-3的活性,诱发血管瘤内皮细胞的凋亡,促进血管瘤的早日消退,为血管瘤的基因治疗开辟新的途径。
[1]Lo K,Mihm M,Fay A.Current theories on the pathogenesis of infantile hemangioma[J].Semin Ophthalmol,2009,24(3):172-177.
[2]张莉,王炜,祁佐良,等.用基因芯片研究同一血管瘤增生和消退期差异表达基因[J].中华整形外科杂志,2003,19(6):452-455.
[3]Zhang L,Lin X,Wang W,et al.Circulating level of vascular endothelial growth factor in differentiating hemangioma from vascular malformation patients[J].Plast Reconstr Surg,2005,116(1):200-204.
[4]陈志雄,张端莲,陕声国,等.Caspase-3在人皮肤血管瘤不同时期的表达及意义[J].中华实验外科杂志,2004,21(9):1109-1110.
[5]O'Connor DS,Schechner JS,Adida C,et al.Control of apoptosis during angiogenesis by survivin expression in endothelial cells[J].Am J Pathol,2000,156(2):393-398.
[6]Tran J,Rak J,Sheehan C,et al.Marked induction of the IAP family antiapoptotic proteins survivin and XIAP by VEGF in vascular endothelial cells[J].Biochem Biophys Res Commun,1999,264(3):781-788.
[7]Shin S,Sung BJ,Cho YS,et al.An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and-7[J].Biochemistry,2001,40(4):1117-1123.
