光学纯酰腙的合成及结构研究
2010-06-04周霞,吴旖,赵斌
由于酰腙希夫碱碳氮双键存在顺反异构,且酰胺键具有部分双键性质,所以酰腙希夫碱化合物均有顺反异构体,如图1所示。
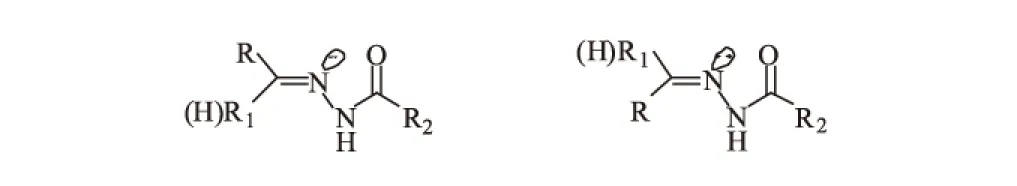
图1 酰腙希夫碱的顺反异构体
Lyubchova等[1]用X-Ray分析水杨醛-苯甲酰腙结构发现,E-式构型是唯一构型;Colonna等[2]用二维核磁谱研究水杨醛-苯甲酰腙在溶剂DMSO中的结构得到同样结论,另外,水杨醛-苯甲酰腙作为配体与金属形成配合物时也都是E-式构型[3~7]。这些结果表明E-式构型是酰腙化合物的稳定构型。图2是几种酰腙希夫碱化合物的结构式。

图2 几种酰腙希夫碱化合物的结构式
酰腙化合物Ⅰ是一种选择性肌肉激动剂[8]。
化合物Ⅱ[9]和化合物Ⅲ[10]是一类雌激素相关孤核受体激动剂。雌激素相关孤核受体存在于人体基因组中,是脂肪代谢动态平衡的重要调节剂,可调节与肠内脂肪吸收、吃饱信号和动脉松弛有关的基因。因而雌激素相关孤核受体是治疗代谢疾病如肥胖病、糖尿病、动脉硬化的靶标。
化合物Ⅳ是一种组织蛋白酶抑制剂[11]。
化合物Ⅴ[N-(4-t-Butylbenzoyl)-2-hydroxy-l-naphthaldehyde hydrazone]是羧肽酶A抑制剂。羧肽酶A可以催化蛋白水解,化合物Ⅴ也是一种潜在的HIV-1逆转录酶抑制剂,其萘环与羟基是必不可少的活性基团[12]。
化合物Ⅵ是一种有效的胰增血糖素(Glucagon)受体抑制剂[13]。胰增血糖素可以刺激肝糖分解和糖质新生,从而增加血糖浓度。
化合物Ⅶ是含杂环的双酰腙,可以抑制激酶或磷酸酯酶的活性,精确有效地控制基因表达、细胞生长、代谢及免疫应答等,从而控制糖尿病、高血压、传染疾病和肿瘤疾病[14]。
为了寻找生物活性较强的酰腙化合物,作者以光学纯的抗炎药物萘普生为原料合成了一种光学纯的酰腙,并用核磁共振氢谱对其结构进行了鉴定。
1 实验
1.1 试剂与仪器
羧酸,甲醇,二氯亚砜,无水乙醚,碳酸氢钠,乙醇,85%水合肼,乙酸乙酯,水杨醛,乙酸。
500 mL单口烧瓶,150 mL烧瓶,恒压滴液漏斗,冷凝管,冰水浴,油浴。
1.2 合成路线(图3)
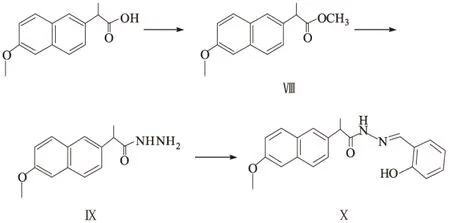
图3 酰腙希夫碱Ⅹ的合成路线
1.3 步骤
1.3.1 羧酸甲酯(Ⅷ)的合成
将100 mmol羧酸加入到500 mL单口烧瓶中,加250 mL甲醇搅拌溶解,冰水浴,用恒压滴液漏斗向反应液中滴加1.5倍物质的量的二氯亚砜,滴毕,装上冷凝管,油浴加热回流4~5 h,蒸干,得油状液体或固体。充分干燥后,溶入适量无水乙醚或二氯甲烷中,搅拌使其充分溶解,向有机溶剂中加入适量碳酸氢钠水溶液萃取,浓缩有机相得油状物质。
1.3.2 酰肼(Ⅸ)的合成
向150 mL烧瓶中加入0.05 mol化合物Ⅷ,加50 mL乙醇,溶解,再加入0.06 mol 85%水合肼,加热回流2 h,浓缩,将剩余物倒入少量冷水中,搅拌产生大量白色固体,过滤,得固体产物;滤液用乙酸乙酯萃取,合并固体产物与萃取物,即得化合物Ⅸ,产率约85%。
1.3.3 酰腙(Ⅹ)的合成
在20 mL乙醇溶液中,加入5.0 mmol化合物Ⅸ和5.0 mmol水杨醛,以乙酸作催化剂,回流反应1 h,冷却至室温,产生白色固体,过滤,用冷乙醇洗产物,干燥,得无色固体,产率约80%。
2 结果与讨论
2.1 酰腙化合物Ⅹ的性质及元素分析
2.2 酰腙化合物Ⅹ的核磁共振氢谱
1HNMR,CDCl3: 7.71(m, 2H,-C10H6), 7.19~6.81(m, 7H,-C10H6,-C6H3), 其它1HNMR数据见表1。1HNMR,DMSO:7.73(m, 2H,-C10H6), 7.46~6.81(m, 7H,-C10H6,-C6H3), 其它1HNMR数据见表1。

表1 酰腙希夫碱Ⅹ在不同溶剂中的核磁共振氢谱数据
由表1可看出,酰腙化合物Ⅹ顺反异构体中,非活泼氢亦在核磁上显示不同信号。1HNMR谱图中有两组信号,类似化合物羟基质子的文献报道[15~19],确定化合物Ⅹ在溶液状态下出现了E和Z异构体(图4),从谱图的信号可以分辨出各个质子的信号及积分值(质子编号与图4一致)。
2.3 酰腙化合物Ⅹ的顺反异构体
目前,有关水杨醛-苯甲酰腙在溶液状态下的E-Z异构化现象[20]报道较少。本实验中,酰腙化合物Ⅹ在溶剂CDCl3和DMSO中有顺反异构现象,如图4所示。
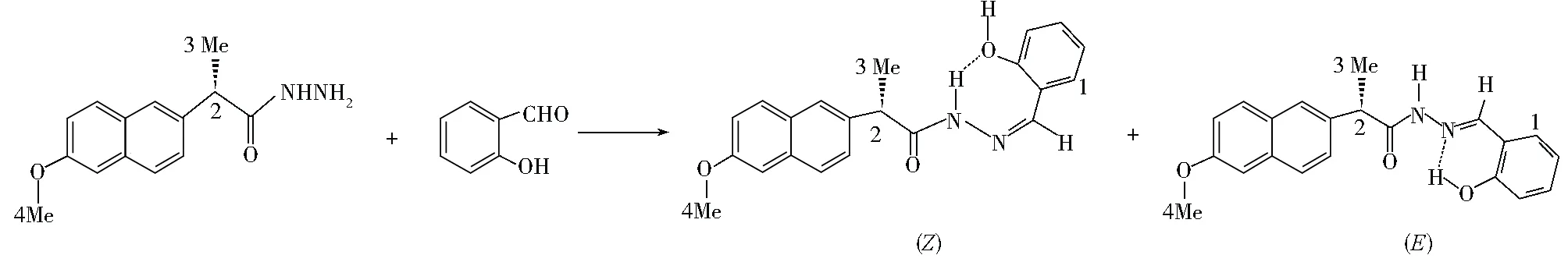
图4 酰腙希夫碱化合物Ⅹ的顺反异构体
由图4可看出,在E异构体中,由于存在分子内氢键OH…N(imine),所以-OH质子信号向低场位移;而在Z异构体中,由于存在分子内氢键NH…O(H),所以-NH质子信号向低场位移。
固体状态下,化合物Ⅹ全部以E异构体(图5)存在,室温下固体溶于CDCl3中,E异构体互变为Z异构体,一定时间内E-Z互变达到平衡E/Z比例约49∶51(表1);当样品溶于DMSO中,E/Z比例约70∶30。这表明,在溶液状态下,存在E/Z构型互变平衡,在CDCl3中互变较快而在DMSO中互变较慢。原因可能是,一方面,DMSO的高粘度抑制了原有的E异构体转变为Z异构体;另一方面,DMSO能作为氢键受体与化合物Ⅹ中-NH和-OH形成分子间氢键,使E异构体转变为Z异构体更困难,从而也使N-H 和O-H质子信号在DMSO中明显向低场位移,而其它质子信号在DMSO和CDCl3中则没有明显差别。但是用TLC无法分离得到两种异构体,用高效液相色谱(λ=230 nm,v=1.0 mL ·min-1,T=30℃, M∶H=78∶22)也不能分离得到两种异构体。
图5 酰腙希夫碱化合物Ⅹ在固态下的反式异构体
3 结论
合成了一种未见报道的光学纯酰腙化合物,用核磁共振氢谱研究了这种化合物在不同溶剂中的顺反异构现象,并用不同氢键的形成解释了这一现象。
参考文献:
[1] Lyubchova A,Cosse-Barbi A,Doucet J P,et al.Salicylaldehyde benzoyl hydrazone[J]. Acta Crystallogr Sect C,1995, 51(9): 1893-1895.
[2] Colonna C,Cosse-Barbi A,Massat A,et al.IR studies of pyridoxal isonicotinosyl hydrazone and analogs[J]. Bull Soc Chim Belg,1993, 102(6): 411-430.
[3] Aruffo A A,Murphy T B,Johnson D K,et al.Structures ofcis-dichloro(methanol) (salicylaldehyde benzoylhydrazonato) iron(Ⅲ), [FeCl2(C14H11N2O2) (CH4O)], and chloro (salicylaldehyde benzoylhydrazonato) copper(Ⅱ) monohydrate, [CuCl(C14H11N2O2)]·H2O[J]. Acta Crystallogr Sect C,1984, 40(7): 1164-1169.
[4] Aruffo A A,Murphy T B,Johnson D K,et al.Structural studies of iron(Ⅲ) and copper(Ⅱ) complexes of salicylaldehyde benzoyl hydrazone, a synthetic chelating agent exhibiting diverse biological properties[J]. Inorg Chim Acta,1982, 67(4): L25-L27.
[5] Ainscough E W,Brodie A M,Dobbs A J,et al. Antitumor copper(Ⅱ) salicylaldehyde benzoylhydrazone (H2sb) complexes: Physicochemical properties and the single-crystal X-ray structures of [{Cu(H2sb)(CCl3CO2)2}2] and [{Cu(Hsb)(ClO4)(C2H5OH)}2] and the related salicylaldehyde acetylhydrazone (H2sa) complex, [Cu(Hsa)Cl(H2O)]·H2O[J].Inorg Chim Acta,1998, 267(1): 27-38.
[6] Ainscough E W,Brodie A M,Ranford J D,et al. Hexafluorosilicate coordination to the antitumor copper(Ⅱ) salicylaldehyde benzoylhydrazone (H2L) system: Single-crystal X-ray structure of [{Cu(HL)H2O}2SiF6]·2H2O[J]. Inorg Chim Acta,1995, 236(1-2): 83-88.
[7] Dutta S,Manivannan V,Babu L G,et al.A mononuclear manganese(Ⅲ) Schiff base complex, [Mn(C14H10N2O2)(C8H7O3)(CH4O)][J].Acta Crystallogr Sect C,1995, 51(5): 813-815.
[8] Wu E S C, Kover A,Loch Ⅲ J T,et al.Acylhydrazones as M1/M3 selective muscarinic agonists[J]. Bioorganic & Medicinal Chemistry Letters, 1996, 6(21): 2525-2530.
[9] Zuercher W J,Gaillard S,Orband-Miller L A, et al.Identification and structure-activity relationship of phenolic acylhydrazones as selective agonists for the estrogen-related orphan nuclear receptors ERRβand ERRγ[J]. J Med Chem, 2005, 48(9): 3107-3109.
[10] Yu D D,Forman B M. Identification of an agonist ligand for estrogen-related receptors ERRβ/γ[J]. Bioorganic & Medicinal Chemistry Letters, 2005, 15(5): 1311-1313.
[11] Cywin C L,Firestone R A,McNeil D W,et al. The design of potent hydrazones and disulfides as cathepsin S inhibitors[J]. Bioorganic & Medicinal Chemistry, 2003, 11(5): 733-740.
[12] Lanthier C M,Parniak M A,Dmitrienko G I. Inhibition of carboxypeptidase A byN-(4-t-butylbenzoyl)-2-hydroxy-1-naphthaldehyde hydrazone[J]. Bioorganic & Medicinal Chemistry Letters,1997, 7(12): 1557-1562.
[13] Ling A,Hong Y,Gonzalez J,et al. Identification of alkylidene hydrazides as glucagon receptor antagonists[J]. J Med Chem, 2001, 44(19): 3141-3149.
[14] Bunyapaiboonsri T,Ramström H,Ramström O,et al.Generation of bis-cationic heterocyclic inhibitors ofBacillussubtilisHPr kinase/phosphatase from a ditopic dynamic combinatorial library[J]. J Med Chem, 2003, 46(26): 5803-5811.
[15] Cook R J, Mislow K. Barrier to planar inversion in anN-germyl imine[J]. J Am Chem Soc, 1971, 93(24): 6703-6704.
[16] Wong J L, Zady M F. Photochromism of quinolylhydrazones. Ⅲ. Mechanism of isomerization of the photocolored.α-quinolylimino-(Z)-hydrazone to theα-quinolylamino-(E)-hydrazone[J].J Org Chem, 1975, 40(17): 2512-2516.
[17] Pichon R,Le Saint J,Courtot P. Photoisomerization of 2-arylhydrazones of 2-substituted 1,2-diketones. Mechanism of thermal isomerization of carbon nitrogen double bond[J]. Tetrahedron, 1981, 37(8): 1517-1524.
[18] Butler R N,Johnston S M.Stereoisomerization in heterocyclic hydrazones derived from 2-acylpyridines and their oxidative cyclization with mercury(Ⅱ) acetate and lead tetraacetate to fused 1,2,4-triazoles and 1,2,3-triazolium systems[J]. J Chem Soc Perkin Trans, 1984,1(9): 2109-2116.
[19] Pelagatti P, Carcelli M,Franchi F,et al. Potentially tridentate hydrazonic ligands in the synthesis of methyl and acetyl palladium(Ⅱ) complexes[J]. Eur J Inorg Chem,2000,(3): 463-475.
[20] Cordier C,Vauthier E,Adenier A,et al.Salicylaldehyde benzoyl hydrazone: Isomerization due to water. A structural analysis using a combination of NMR, IR, and theoretical investigations[J]. Structural Chemistry, 2004, 15(4): 295-307.
